10. Продуктивность птицы при применении ветома 1.1 и ветома 3
Фармакологическая стимуляция роста является ценным вспомогательным фактором не только увеличения живой массы, улучшения развития, но и повышения резистентности организма цыплят. Наивысшая эффективность достигается только правильным выбором и точным применением нужных препаратов (Андреева и соавт., 1987; Антипов, 1989; Экпеньонг, 1990).
Из большого разнообразия биологически активных веществ в животноводстве широко применяют кормовые антибиотики и пробиотики. Однако в последнее время все чаще ставится вопрос о необходимости отказа от применения антибиотиков в качестве стимуляторов роста и замены их другими препаратами (Гамко и соавт., 1999).
Перспективными препаратами для стимулирования роста и профилактики желудочно-кишечных заболеваний молодняка сельскохозяйственных животных считаются пробиотики. Они действуют главным образом на микрофлору пищеварительного тракта и обмен веществ, благодаря чему улучшаются процессы расщепления и усвоения питательных веществ кормов.
Пробиотики довольно часто используют в качестве добавок к комбикормам с повышенным уровнем клетчатки, которую птица, особенно молодая, не способна хорошо переваривать (Федулина и соавт., 1989). Внесенные в желудочно-кишечный тракт животных с кормом, они разрушают оболочку растительных клеток и делают доступными для усвоения содержащиеся в них питательные вещества (Тараканов и соавт., 1998).
Н.И. Федулина и соавт. (1989) в экспериментальном хозяйстве ВНИИРГЖ в течение 3 лет проводили опыты на цыплятах-бройлерах, которым с 8-10-дневного возраста скармливали целлобактерин – пробиотик, изготовленный на основе трех физиологических групп микроорганизмов, взятых из рубца жвачных животных. Результаты эксперимента: суточный прирост живой массы цыплят-бройлеров находился в пределах 31,5-34 г, а в контроле – 28,3 г. Авторы дают заключение, что целлобактерин можно использовать как добавку к комбикормам, в которых значительную долю составляют компоненты растительного происхождения.
Р. Жук и соавт. (1992) испытывали ростостимулирующий эффект лактина (пробиотик из лактобацилл и стрептококков) на ремонтном молодняке яичных кур, цыплятах-бройлерах кросса «Таврия», индюшатах белой широкогрудой породы и линейных утятах кросса «Медео». Самое эффективное действие лактина проявлялось при скармливании его молодняку всех видов сельскохозяйственной птицы, за исключением индюшат, в течение 4 недель в дозе 2 г на 1 кг комбикорма. Индюшатам препарат нужно скармливать по 0,2 г на 1 кг комбикорма одну неделю.
А. Тихомирова и соавт. (1993) в своих экспериментах изучали влияние на жизнеспособность и деловой выход молодняка птицы лечебно-профилактического кисло-молочного продукта бифивета, содержащего физиологически активные клетки бифидобактерий, в дозе 1-2 мл на 100 г живой массы. Живая масса опытных цыплят увеличилась на 5-6 % в сравнении с контролем.
И.Г. Пивняк и соавт. (1998) сообщают о ростостимулирующем влиянии нового пробиотика каротинобактерина на молодняк сельскохозяйственной птицы.
Е. Букреева и соавт. (2000) изучали эффективность использования симбиотического кисло-молочного продукта кефинар в птицеводстве. Установили, что препарат повысил сохранность птицы: в опытной группе на 3 % по сравнению с контролем; яйценоскость в контроле составила 70,02, в группе с кефинаром – 76,17 %. На живую массу перепелок и массу яиц введение в состав кормосмеси пробиотика не оказало достоверного влияния.
Б.Ф. Бессарабов и соавт. (1996) изучали влияние пробиотиков галлиферма и энтероцида на рост и сохранность цыплят. Авторы установили, что оба препарата положительно влияют на цыплят, причем лучшие результаты дал галлиферм. Живая масса молодняка была на 34,8 г, среднесуточный прирост – на 0,58 г, сохранность – на 2,6 % выше, чем в группе, получавшей энтероцид.
Бифацидобактерин обладает ростостимулирующим эффектом. Так, сохранность бройлерных цыплят во время испытаний повышалась на 10,1 %, а их масса на день убоя превышала массу контрольных на 6,5 % (Суботин и соавт., 1998).
И.В. Наумкин и соавт. (1999) установили, что применение ветома 1.1 курам-молодкам стимулирует их рост и развитие. Наиболее выраженные изменения динамики роста (на 45,6 %) отмечали через 5 дней после введения препарата в дозе 75 мг/кг 2 раза в день. Однако и в последующий период куры, получавшие ветом 1.1 в дозе 100 мг/кг 1 раз в день, имели более высокую интенсивность роста. В конце эксперимента куры опытных групп превосходили по скорости роста аналогов из контроля соответственно на 8,4 и 6,6 %.
Б.В. Тараканов и соавт. (2000) указывают, что применение пробиотика лактоамиловорина оказало благоприятное влияние на сохранность и рост цыплят-бройлеров кросса «Смена-2». Так, в контроле сохранность к 49-дневному возрасту составила 88,9 %, в опытной группе – 90 %, а масса превосходила таковую в контроле на 7,8 %.
Ю.П. Фомичев и соавт. (2003), изучая эффективность использования тококарина на молодняке птицы, установили, что среднесуточные приросты у цыплят-бройлеров увеличиваются на 9,6 % в сравнении с аналогами из контроля.
Таким образом, пробиотики нашли широкое применение в стимуляции роста и развития молодняка сельскохозяйственной птицы. Исходя из изложенного, можно отметить, что применение ветома 1.1 в птицеводстве сдерживается недостаточной изученностью его влияния на макроорганизм, клеточные и гуморальные факторы неспецифической защиты молодняка сельскохозяйственной птицы.
Мы решили изучить возможность применения пробиотика ветом 1.1 для стимуляции роста цыплят-бройлеров. По принципу аналогов сформировали четыре группы из суточных цыплят-бройлеров кросса «Смена-2» по 55 голов каждая: три опытных и одну контрольную. При подборе учитывали: кросс, возраст, живую массу. Цыплятам опытных групп ветом 1.1 назначали с кормом в дозе 75 мг на 1 кг массы 1 раз в сутки до конца периода выращивания с использованием трех схем. В 1-й опытной группе двукратно – по 10 дней подряд, с интервалом в 20 дней, во 2-й опытной группе – 5-дневными циклами, с интервалом между назначением 5 дней, всего 5 циклов, в 3-й опытной группе – через 24 ч до завершения эксперимента. В контрольной группе препарат не применяли.
Для изучения влияния препарата в динамике на интенсивность роста цыплят-бройлеров определяли абсолютный, среднесуточный и относительный приросты живой массы, их взвешивали до применения препарата и каждые 10 дней.
Условия содержания и ухода для всех групп птицы были одинаковыми. Цыплят содержали в типовом птичнике, на глубокой подстилке. Плотность посадки на 1 м2 пола составляла 18 цыплят, фронт кормления – 2,5 см, фронт поения – 1 см на голову, что соответствовало нормам ВНИТИП. Комбикорм раздавали вручную после ступенчатого предварительного смешивания с ветомом 1.1.
Период выращивания цыплят-бройлеров разделяли на 2 этапа (согласно принятой технологии с использованием беспересадочных птичников): первый – в возрасте 1-4 недель, второй – старше 4 недель. За цыплятами опытных и контрольных групп наблюдали в течение 60 дней.
Интенсивность прироста является одним из основных экономических показателей при выращивании птицы.
До применения препарата живая масса цыплят контрольной и опытных групп не имела достоверных различий (табл. 43).Живая масса цыплят-бройлеров 1-й опытной группы на 10-е сутки исследования была ниже на 5 % по сравнению с аналогами из контроля. Затем интенсивность роста повышалась и на 20, 30, 40, 50 и 60-е сутки исследования они превышали аналогов из контроля соответственно на 11,5; 6,7; 4,2; 6,2 и 15,2 % (Р<0,001).
Цыплята 2-й опытной группы по абсолютной массе достоверно превосходили аналогов из контроля на 10, 20, 30, 40, 50 и 60-е сутки соответственно на 5; 5; 3,3; 3,2; 13,5 и 24,7 % (Р<0,001).
Таблица 43. Динамика живой массы подопытных цыплят-бройлеров, г
Возраст, сутки | Группа | |||
контрольная | 1-я опытная | 2-я опытная | 3-я опытная | |
1 | 39,12±0,02 | 39,12±0,02 | 39,12±0,02 | 39,12±0,02 |
10 | 100,06±0,50 | 95,00±0,46*** | 105,00±0,22*** | 105,00±0,27*** |
20 | 305,00±2,62 | 340,00±2,31*** | 320,00±0,68*** | 300,00±2,37 |
30 | 600,00±3,99 | 640,00±1,39*** | 620,00±2,50*** | 585,00±1,86** |
40 | 950,00±8,21 | 989,64±3,81*** | 980,00±7,99* | 1010,00±7,03*** |
50 | 1413,00±6,29 | 1501,00±7,81*** | 1604,00±7,88*** | 1548,50±11,88*** |
60 | 1700,00±14,20 | 1957,95±14,98*** | 2119,15±27,82*** | 2023,81±33,88*** |
*Р<0,05. **Р<0,01. ***Р<0,001.
Абсолютная масса цыплят 3-й опытной группы на 10-е сутки исследования была выше аналогов из контроля на 5 %(Р<0,001), на 20-е и 30-е сутки соответственно на 1,6 и 2,6 %. Затем на 40, 50 и 60-е сутки исследования цыплята опытной группы по живой массе превышали аналогов из контроля соответственно на 6,3; 9,6 и 19 % (Р<0,001).
Таким образом, динамика изменения абсолютной массы у цыплят-бройлеров опытных групп зависела от схем применения ветома 1.1.
Максимальный эффект отмечали при даче препарата 5-дневными циклами в дозе 75 мг/кг массы один раз в сутки с интервалом 5 дней. По абсолютной массе цыплята этой опытной группы превышали аналогов 1-й и 3-й опытных групп за опытный период соответственно на 7,6 и 4,5 %.
Абсолютный прирост за опытный период у цыплят-бройлеров 1-й, 2-й и 3-й опытных групп был выше по сравнению с аналогами из контроля соответственно на 257,9; 419,2 и 323,8 г.
Установленные закономерности в изменении абсолютной массы у цыплят-бройлеров наблюдались и при изучении влияния ветома 1.1 на среднесуточный прирост живой массы (табл. 44).
Таблица 44. Динамика среднесуточного прироста подопытных цыплят-бройлеров, г
Возраст, сутки | Группа | |||
контрольная | 1-я опытная | 2-я опытная | 3-я опытная | |
10 | 6,10±0,05 | 5,60±0,05*** | 6,60±0,02*** | 6,60±0,03*** |
20 | 13,30±0,13 | 15,15±0,15*** | 14,05±0,03*** | 13,05±0,12 |
30 | 18,69±0,13 | 20,03±0,05*** | 19,36±0,08*** | 18,19±0,06** |
40 | 22,77±0,21 | 23,77±0,10*** | 23,57±0,17** | 24,27±0,18*** |
50 | 26,67±0,74 | 29,24±0,16** | 31,30±0,16*** | 30,19±0,24*** |
60 | 28,85±0,61 | 34,35±0,00*** | 39,85±0,43*** | 38,51±0,57*** |
За опытный период | 19,39 | 21,35 | 22,45 | 21,80 |
Согласно данным табл. 44 у цыплят 1-й опытной группы среднесуточный прирост на 10-е сутки был ниже по сравнению с аналогами из контроля на 8,9 %, а на 20, 30, 40, 50 и 60- сутки превышал аналогов из контроля соответственно на 13,9; 7,2; 4,4; 9,6 и 19 % (Р<0,001).
Цыплята 2-й опытной группы по среднесуточному приросту достоверно превосходили аналогов из контроля на 10, 20, 30, 40, 50 и 60-е сутки соответственно на 8,2; 5,6; 3,6; 3,5; 17,4 и 38 %.
У цыплят-бройлеров 3-й опытной группы на 10-е сутки исследования среднесуточный прирост был выше по сравнению с контролем на 8,2 % (Р<0,001), а на 20-е и 30-е сутки ниже соответственно на 1,9 (Р>0,1) и 2,6 % (Р<0,01). На 40, 50 и 60-е сутки у птицы 3-й опытной группы этот показатель был выше по сравнению с аналогами из контроля соответственно на 6,6; 13,2 и 33,5 % (Р<0,001).
За период опыта у цыплят-бройлеров в 1-й опытной группе среднесуточный прирост был выше по сравнению с контролем на 15,5 %, во 2-й на 25,5 % и в 3-й на 19,5 %.
Таким образом, под влиянием ветома 1.1 среднесуточный прирост живой массы у цыплят-бройлеров кросса «Смена-2» повышается. Изменения исследуемого показателя также зависели от схем применения препарата. Максимальный среднесуточный прирост живой массы за опытный период отмечали у цыплят-бройлеров 2-й опытной группы, которым препарат назначали 5-дневными циклами в дозе 75 мг/кг массы один раз в сутки с интервалом 5 дней до конца периода выращивания.
За опытный период цыплята 2-й опытной группы превышали аналогов 1-й и 3-й групп по абсолютной массе соответственно на 7,6 и 4,5 %, среднесуточному приросту – на 4,8 и 2,8 %.
Полученные нами результаты согласуются с данными Л.А. Экпеньонг (1990); Г.А. Ноздрина и соавт. (1992); В.В. Субботина (1995); Б.Ф. Бессарабова и соавт. (1996); О.В. Колабской (1996); А.Б. Ивановой (2002), которые отмечают, что применение биологически активных веществ в ранний постнатальный период жизни способствует стимуляции роста и развития, повышению продуктивности и сохранности молодняка.
Увеличение интенсивности роста цыплят происходит путем реализации генетических возможностей организма, вероятно, за счет интенсификации внутриклеточного метаболизма под влиянием ветома 1.1.
Для изучения влияния ветома 3 на продуктивность птицы препарат вводили 1, 2 и 3 раза в сутки. Установлено, что под влиянием ветома 3 при однократном и двукратном введении происходило повышение прироста живой массы у цыплят - бройлеров (табл. 45).
Таблица 45. Динамика живой массы подопытных цыплят-бройлеров кросса ISA (2000 г.), г
Возраст, сутки | Группа | |||||
1-я опытная | 2-я опытная | контрольная | ||||
М±m | Cv | М±m | Cv | М±m | Cv | |
1 | 36,0±0,25 | 0,2 | 36,0±0,2 | 0,18 | 36,0±0,2 | 0,18 |
7 | 118,0±31,93 | 1,03 | 118,0±39,4 | 3,1 | 117,0±4,5 | 3,1 |
14 | 275,0±51,4 | 5,6 | 269,0±14,25 | 1,5 | 266,0±7,5 | 0,84 |
21 | 571,0±17,8 | 0,9 | 564,5±16,5 | 0,87 | 559,4±40,9 | 2,1 |
28 | 1030,0±36,9 | 1,06 | 1016,0±25,3 | 0,75 | 1016,0±26,7 | 0,78 |
35 | 1455,0±38,2 | 0,79 | 1457,0±44,2 | 0,97 | 1457,0±43,6 | 0,89 |
42 | 1958,0±18,9 | 0,29 | 1958,0±17,0 | 0,26 | 1957,4±7,2 | 0,1 |
Абсолютная масса цыплят 1-й и 2-й опытных групп была выше аналогов в контроле в 7-дневном возрасте соответственно на 0,8 %, в 14-дневном- на 3,4 и 1,1 %, в 21- дневном - на 2,0 и 0,9 %. В 28-дневном возрасте только цыплята 1-й опытной группы по абсолютной массе превышали аналогов в контроле на 1,4 %.
Цыплята 1-й и 2-й опытных групп в период назначения препарата по абсолютной массе превышали аналогов в контроле на 1,8 и 0,5 %.
В период последействия препарата в возрасте 35 и 42 суток у цыплят 1-й и 2-й опытных групп абсолютная масса была на уровне цыплят-аналогов из контроля.
Более высокая интенсивность роста регистрировалась у цыплят, которые получали ветом 3 в дозе 75 мг/кг массы 2 раза в сутки. С удлинением срока введения препарата происходило постепенное уменьшение интенсивности роста цыплят опытных групп. Максимальный прирост живой массы регистрировали у цыплят 1-й и 2-й опытных групп в 14-суточном возрасте.
Для уточнения полученных результатов повторно провели еще одну серию опытов в 2001 г. Ветом 3 назначали в дозе 75 мг/кг массы 2 и 3 раза в сутки через 24 ч в течение месяца. Результаты исследований подтверждают ранее полученные данные по влиянию препарата на интенсивность роста цыплят (табл. 46).
Абсолютная масса цыплят 1-й и 2-й опытных групп была выше аналогов в контроле соответственно в 7- суточном возрасте на 10,1 и 17,5 %, в 14-суточном - на 3,5 и 2,4 %, в 21-суточном - на 1,8 и 1,9 %; в 28- суточном - на 5,2 и 10,1 %.
Таблица 46. Динамика живой массы подопытных цыплят-бройлеров кросса ISA (2001г.), г
Возраст, сутки | Группа | |||||
1-я опытная | 2-я опытная | контрольная | ||||
М±m | Cv | М±m | Cv | М±m | Cv | |
1 | 43,2±0,83 | 8.6 | 43,8±0,88 | 8,99 | 43,2±0,91 | 9,40 |
7 | 127,5±3,64# | 12,8 | 136,0±3,22*** | 10,58 | 115,7±3,48 | 13,46 |
14 | 461,0±4,87* | 4,7 | 456,0±4,15 | 4,07 | 445,2±5,06 | 5,08 |
21 | 762,8±4,55* | 2,7 | 763,0±3,72* | 2,18 | 748,7±5,14 | 3,07 |
28 | 1136,2±24,8# | 9,7 | 1189,5±27,44** | 10,32 | 1079,5±17,69 | 7,33 |
35 | 1661,5±47,8# | 12,9 | 1605,0±31,18 | 8,69 | 1560,0±26,31 | 7,54 |
Цыплята 1-й и 2-й опытных групп в период назначения препарата по абсолютной массе превышали аналогов в контроле на 5,4 и 10,5 %.
На 35-й день средняя живая масса цыплят в опытных группах превышала таковую в контроле на 6,5 и 2,9 % соответственно.
Более высокая интенсивность роста в период назначения препарата регистрировалась у цыплят в 7, 14, 28- суточном возрасте, получавших ветом 3 в дозе 75 мг/кг массы 3 раза в сутки. В этой серии опытов выявленные ранее закономерности в действии препарата сохранялись. С удлинением срока введения препарата также постепенно уменьшалась интенсивность роста цыплят опытных групп. Максимальный прирост живой массы регистрировали у цыплят 1-й и 2-й опытных групп в 7-суточном возрасте.
Сила влияния испытуемого препарата на живую массу птицы также была более выражена в 7-суточном возрасте и составила (23,4±2,69) % (Р<0,001). С возрастом этот показатель снижался и в 14- суточном возрасте составлял (9,3±3,18) % (Р<0,01), в 21- суточном – 10,3±3,15 (Р<0,01), в 28- суточном -15,9±2,95 (Р<0,001) и в 35- суточном – (6,45±3,28) % (Р<0,05).
Изменение абсолютной массы у цыплят кросса «Бройлер-6» при назначении препарата 3 раза в сутки зависело от схемы и продолжительности его применения (табл. 47).
По абсолютной массе цыплята 2-й, 3-й и 4-й опытных групп на 7-й день опыта превышали аналогов в контроле соответственно на 8,2; 13,0; 4,6 %. На 14-й день абсолютная масса цыплят 2-й, 3-й и 4-й опытных групп была выше по сравнению с аналогами в контроле соответственно на 7,3; 14,6; 6,1 %. В 21-суточном возрасте цыплята всех опытных групп по абсолютной массе превышали аналогов в контроле соответственно на 4,2; 21,6; 20,0; 17,5 %. Эта закономерность сохранилась и в возрасте 28 дней. Абсолютная масса у цыплят 1-й, 2-й, 3-й и 4-й опытных групп в этот период была выше аналогов в контроле соответственно на 4,3; 11,7; 13,0; 6,0 %. За опытный период по абсолютной массе цыплята 1-й, 2-й, 3-й и 4-й опытных групп превышали аналогов в контроле соответственно на 2,9; 13,7; 15,4; 9,4 %.
Следовательно, более высокая интенсивность роста регистрировалась у цыплят 3-й опытной группы, которые получали ветом 3 в дозе 75 мг/кг массы 3 раза в сутки через 24 ч в течение месяца.
Таким образом, динамика изменения абсолютной массы цыплят опытных групп зависела от кратности, схем применения и продолжительности введения ветома 3. Более высокая абсолютная масса регистрировалась у цыплят, которым препарат назначали в дозе 75 мг/кг массы 3 раза в сутки через 24 ч в течение месяца. По абсолютной массе цыплята этой опытной группы превышали показатели цыплят опытных групп при 1- и 2-кратном введении препарата за опытный период соответственно на 4,6 и 5,9 %.
Изменение абсолютной массы опытных цыплят зависело и от продолжительности применения препарата. У цыплят 1-й опытной группы, которым скармливали ветом 3 в дозе 75 мг/кг массы 3 раза в сутки 7 и 14 дней подряд, абсолютная масса за опытный период была ниже показателей цыплят, получавших ветом 3 в той же дозе, но в течение месяца, соответственно на 8,3 и 6,6 %.
С удлинением срока последействия препарата происходило постепенное уменьшение интенсивности роста цыплят опытных групп. Цыплята опытных групп по абсолютной массе превышали аналогов в контроле только до 30- суточного возраста. Следовательно, интенсивность роста цыплят опытных групп была выше аналогов в контроле только в период назначения
Таблица 47. Динамика изменения живой массы подопытных цыплят кросс Бройлер 6 (1999 г.), г
Возраст, дней | Группа | |||||||||
1 опытная | 2 опытная | 3 опытная | 4 опытная | контрольная | ||||||
M±m | Cv | M±m | Cv | M±m | Cv | M±m | Cv | M±m | Cv | |
7 | 180,±0,32* | 0,39 | 195,0±0,71*** | 0,81 | 200,8±0,49*** | 0,55 | 189,0±0,71*** | 0,84 | 182,0±0,32 | 0,87 |
14 | 352,0±1,41* | 0,9 | 382,0±0,71 | 0,41 | 408,0±1*** | 0,55 | 378,0±1,14*** | 0,67 | 356,0±0,63 | 0,4 |
21 | 625,1±0,86*** | 0,27 | 730,0±1,61*** | 0,49 | 720,0±1,61 | 0,5 | 705,0±1,58*** | 0,5 | 600,0±0,75 | 0,28 |
28 | 886,0±1,61*** | 0,4 | 949,0±0,71*** | 0,17 | 960,0±1,61*** | 0,38 | 900,0±1,61*** | 0,4 | 849,0±2,21 | 0,58 |
Здесь и далее: # – достоверно при Р<0,1; * – достоверно при Р< 0,05; ** - Р< 0,01; *** - P< 0,001.
препарата. В период его последействия интенсивность роста цыплят опытных групп понижалась и в завершающий период опыта находилась на уровне контрольной группы.
Установленные закономерности в изменении абсолютной массы цыплят наблюдались и при изучении влияния ветома 3 на среднесуточный прирост живой массы (табл. 48).
При назначении препарата 1 и 2 раза в сутки через 24 ч в течение месяца среднесуточный прирост цыплят в 1-й и 2-й опытных группах увеличился по сравнению с аналогами из контроля в 7-дневном возрасте на 1,7 %, в 14-дневном - на 5,7 и 1,8 %, в 21-дневном - на 1,2 и 0,7 %.
Таблица 48. Динамика среднесуточного прироста цыплят-бройлеров кросса ISA (2000 г.), г
Возраст, сутки | Группа | |||||
1-я опытная | 2-я опытная | Контрольная | ||||
М±m | Cv | М±m | Cv | М±m | Cv | |
7 | 11,7±0,5 | 11,0 | 11,7±0,52 | 11,09 | 11,5±0,5 | 11,9 |
14 | 22,4±0,6 | 8,04 | 21,6±0,65 | 8,2 | 21,2±0,62 | 8,0 |
21 | 42,3±1,03 | 6,05 | 42,1±1,2 | 6,1 | 41,8±1,0 | 6,01 |
28 | 65,5±0,92 | 0,52 | 64,5±0,8 | 0,45 | 65,2±0,8 | 0,4 |
35 | 60,7±2,5 | 16,01 | 63,0±2,04 | 16,9 | 63,0±2,02 | 16,02 |
42 | 71,8±1,6 | 6,83 | 71,4±1,5 | 6,8 | 71,4±1,3 | 6,2 |
В 28- суточном возрасте среднесуточный прирост живой массы увеличивался только у цыплят 1-й опытной группы на 0,5 %, во 2-й группе он уменьшился на 1 % по сравнению с аналогами в контроле.
Среднесуточный прирост цыплят опытных групп в 35- и 42- суточном возрасте был на уровне и ниже по сравнению с контрольной группой.
В период назначения препарата среднесуточный прирост у цыплят 1-й опытной группы был выше на 1,7 %, а у цыплят 2-й группы - на уровне аналогов в контроле.
При применении препарата в дозе 75 мг/кг массы 2 и 3 раза в сутки через 24 ч в течение месяца среднесуточный прирост цыплят 1-й и 2-й опытных групп был выше аналогов в контроле в 7- суточном возрасте соответственно на 16,5 и 28,1 % (табл. 49).
Таблица 49. Динамика среднесуточного прироста цыплят-бройлеров кросса ISA (2001г.), г
Возраст, сутки | Группа | |||||
1-я опытная | 2-я опытная | контрольная | ||||
М±m | Cv | М±m | Cv | М±m | Cv | |
7 | 12,04±0,5* | 18,59 | 13,18±0,4*** | 15,59 | 10,34±0,51 | 22,43 |
14 | 47,65±0,5 | 5,25 | 45,72±0,75 | 7,33 | 47,07±0,97 | 9,23 |
21 | 43,11±0,8 | 9,10 | 43,86±0,83 | 8,53 | 43,36±1,13 | 11,71 |
28 | 53,35±3,39 | 28,43 | 60,93±3,9** | 29,0 | 47,25±2,48 | 23,56 |
35 | 71,46±8,25 | 51,66 | 57,92±5,7# | 44,5 | 70,80±4,25 | 26,88 |
Позитивное влияние испытуемого средства на интенсивность роста птицы сохранилось и в последующий период, но характер изменений зависел от кратности введения препарата. Так, в 14-суточном возрасте среднесуточный прирост был выше только у цыплят 1-й опытной группы на 1,2 %. В 21- суточном возрасте молодняк 2-й опытной группы превосходил аналогов из контроля на 1,1 %. В 28- суточном возрасте более интенсивный рост цыплят наблюдали в 1-й и 2-й опытных группах - по сравнению с контролем соответственно на 12,8 и 29,0 %, а в 35- суточном возрасте только в 1-й опытной группе на 0,8 % (табл. 50).
В период введения препарата цыплята 1-й и 2-й опытных групп по среднесуточному приросту превышали аналогичный показатель молодняка в контрольной группе соответственно на 5,4 и 10,5 %.
Наиболее высокие показатели среднесуточного прироста отмечали у цыплят в 1-й и 2-й опытных группах в 14- суточном возрасте: по сравнению с аналогами в контроле на 5,7 и 1,8 % соответственно.
Изменение среднесуточного прироста у цыплят кросса «Бройлер-6» при назначении препарата 3 раза в сутки зависело от схемы и продолжительности его применения (табл. 50).
Среднесуточный прирост у цыплят 2-й, 3-й, и 4-й опытных групп был выше по сравнению с аналогами в контрольной группе соответственно в
7-суточном возрасте на 11,1; 17,0; 6,2 %; в 14-суточном – на 7,4; 19,0; 8,6 %. Среднесуточный прирост цыплят 1-й опытной группы в 7- и 14-дневном возрасте был на уровне цыплят в контрольной группе. В 21-дневном возрасте среднесуточный прирост цыплят 1-й, 2-й, 3-й и 4-й опытных групп был выше аналогов в контроле соответственно на 21,9; 42,4; 27,5; 37,3 %. В 28- суточном возрасте этот показатель во всех опытных группах был на уровне и ниже показателей цыплят-аналогов в контроле.
Максимальный среднесуточный прирост живой массы за опытный период отмечали у цыплят 3-й опытной группы, которым препарат назначали в дозе 75 мг/кг массы 3 раза в сутки через 24 ч в течение месяца.
Установленные ранее закономерности в изменении среднесуточного прироста у цыплят опытных групп наблюдали и при повторном изучении влияния ветома 3 на среднесуточный прирост живой массы. Препарат применяли по схемам, при которых ранее были получены оптимальные результаты.
Таблица 50. Динамика изменения среднесуточного прироста у подопытных цыплят кросс «Бройлер 6» (1999 г.), г
Возраст, дней | Группа | |||||||||
1-я опытная | 2-я опытная | 3-я опытная | 4-я опытная | Контрольная | ||||||
M±m | Cv | M±m | Cv | M±m | Cv | M±m | Cv | M±m | Cv | |
7 | 15,72±0,107# | 1,52 | 17,78±0,36*** | 1,71 | 18,72±0,07*** | 0,88 | 17,0±0,1*** | 1,32 | 16,0±0,1 | 1,4 |
14 | 24,58±0,208 | 1,9 | 26,7±0,126*** | 1,6 | 29,6±0,176*** | 1,33 | 27,0±0,13*** | 1,08 | 24,86±0,144 | 1,29 |
21 | 52,56±0,21*** | 0,9 | 49,7±0,27*** | 1,22 | 44,58±0,233 | 1,17 | 46,7±0,341*** | 1,63 | 34,92±0,092 | 0,59 |
28 | 27,16±0,27*** | 2,28 | 31,26±0,273 | 1,95 | 34,3±0,095 | 0,62 | 27,86±0,36*** | 2,28 | 35,5±0,345 | 2,17 |
Таким образом, под влиянием ветома 3 среднесуточный прирост живой массы у цыплят кросса «Бройлер-6» и ISA повышается. Изменения среднесуточного прироста зависели в большей степени от кратности и схем применения препарата. Оптимальные результаты получены при 2- и 3-кратном применении препарата через 24 ч в течение месяца. В период назначения препарата более интенсивный среднесуточный прирост регистрировали в 7-суточном возрасте. Это, видимо, связано не только с действием препарата, но и с высокой физиологической активностью цыплят в этот период их жизни. Среднесуточный прирост живой массы был более высокий в период назначения препарата. После прекращения назначения ветома 3 интенсивность роста цыплят опытных групп понижалась
Сила влияния ветома 3 на среднесуточный прирост цыплят-бройлеров в 7-суточном возрасте также была наиболее высокой и составила (22,7±2,71) % (Р<0,001). Затем происходило постепенное снижение силы влияния препарата и в 28-суточном возрасте она составила (12,9±3,06) % (Р<0,001). За опытный период этот показатель составил (21,4±2,76) % (Р<0,001).
Установлена корреляция средней силы между схемами введения препарата и среднесуточным приростом цыплят-бройлеров за период эксперимента – r = - 0,48±0,11 (P<0,001).
Динамика изменения относительной скорости роста цыплят-бройлеров также зависела от кратности и схем применения препарата.
При назначении ветома 3 в дозе 75 мг/кг через 24 ч в течение месяца 1 и 2 раза в сутки относительная скорость роста цыплят 1-й и 2-й опытных групп увеличивалась по сравнению с контрольной соответственно в 7-суточном возрасте на 4,8 %, в 14-суточном – на 2,7 и 1,0 %. В 21- и 28-суточном возрасте показатели опытных групп были на уровне контроля (табл. 51).
Таблица 51. Динамика относительной скорости роста цыплят-бройлеров кросса ISA (2000 г.), % (по Броди)
Возраст, сутки | Группа | |||||
1-я опытная | 2-я опытная | Контрольная | ||||
М±m | Cv | М±m | Cv | М±m | Cv | |
7 | 110,0±1,2* | 10,1 | 110,0±1,2* | 10,3 | 105,0±1,5 | 10,02 |
14 | 79,8±0,3# | 9,2 | 78,03±0,4 | 9,4 | 77,03±1,5 | 9,0 |
21 | 70,2±1,2 | 6,4 | 70,8±1,3 | 6,9 | 70,9±1,5 | 7,05 |
28 | 57,19±0,9 | 5,1 | 57,2±1,1 | 5,2 | 58,03±0,8 | 5,05 |
35 | 34,2±2,3 | 16,03 | 35,6±2,7 | 16,06 | 35,6±2,1 | 16,0 |
42 | 29,4±1,6 | 6,9 | 29,29±1,7 | 6,9 | 29,29±1,0 | 6,2 |
В период введения препарата относительная скорость роста цыплят 1-й и 2-й опытных групп была выше показателей в контрольной группе соответственно на 1,6 и 1,1 %.
В период последействия препарата на 42-й день исследований у цыплят опытных групп показатели относительной скорости роста были на уровне контрольной группы.
Таким образом, более высокая относительная скорость роста цыплят 1-й и 2-й опытных групп по сравнению с контролем регистрировалась в 7- и 14-суточном возрасте.
При повторных опытах по изучению влияния ветома 3 на скорость роста цыплят-бройлеров ветом 3 применяли в дозе 75 мг/кг 2 и 3 раза в сутки через 24 ч в течение месяца (табл. 52).
Относительная скорость роста цыплят 1-й и 2-й опытных групп в 7-суточном возрасте была выше аналогов в контроле на 7,6 и 11,8 % соответственно. В 14 и 21-суточном возрасте скорость роста цыплят в контрольной группе была выше, чем в опытных. В возрасте 28 суток этот показатель в 1-й и 2-й опытных группах был выше на 2,9 и 7,2 % соответственно по сравнению с контролем. При повторных опытах по изучению влияния ветома 3 на скорость роста цыплят-бройлеров использовали схемы, при которых были получены оптимальные результаты. Ветом 3 применяли в дозе 75 мг/кг 2 и 3 раза в сутки через 24 ч в течение месяца (табл. 50).
Относительная скорость роста цыплят 1-й и 2-й опытных групп в 7-суточном возрасте была выше аналогов в контроле на 7,6 и 11,8 % соответственно. В 14- и 21-суточном возрасте скорость роста цыплят в контрольной группе была выше, чем в опытных. В возрасте 28 суток этот показатель в 1-й и 2-й опытных группах был выше на 2,9 и 7,2 % соответственно по сравнению с контролем.
Таблица 52. Динамика относительной скорости роста цыплят-бройлеров кросса ISA (2001г.), % (по Броди)
Возраст, сутки | Группа | |||||
1-я опытная | 2-я опытная | Контрольная | ||||
М±m | Cv | М±m | Cv | М±m | Cv | |
7 | 98,03±2,28* | 10,43 | 102,22±2,2** | 9,66 | 90,40±2,84 | 14,08 |
14 | 113,57±1,6 | 6,30 | 108,18±1,82** | 7,53 | 117,52±2,29 | 8,72 |
21 | 49,37±1,07 | 9,72 | 50,40±1,0 | 8,95 | 50,86±1,34 | 11,85 |
28 | 38,83±2,05 | 23,71 | 43,12±2,25* | 23,38 | 35,92±1,60 | 20,01 |
35 | 35,45±3,72 | 46,98 | 29,08±2,86* | 44,00 | 37,24±2,08 | 25,07 |
Влияние испытуемого препарата на скорость роста птицы было неоднозначным и зависело от возрастных особенностей. Наиболее сильное влияние оказывал препарат в 7-суточном возрасте – на (17,2±2,91) % (Р<0,001); в последующий период этот показатель был ниже и составил в 28-суточном возрасте (10,4±3,14) % (Р<0,01), в 35-суточном (6,83±3,27) % (Р<0,05). За период опыта сила влияния ветома 3 на относительную скорость роста цыплят составила (3,72±3,38) % (Р<0,05).
Цыплята 2-й опытной группы, получавшие ветом 3 по 75 мг/кг массы 3 раза в сутки через 24 ч в течение месяца, показали более высокую относительную скорость роста.
Изменение относительной скорости роста цыплят кросса «Бройлер-6» при назначении препарата 3 раза в сутки зависело от схемы и продолжительности его применения (табл. 53).
При применении препарата 3 раза в сутки цыплят зависела от схем назначения. При 3- кратном назначении препарата относительная скорость роста у цыплят 2-й, 3-й и 4-й опытных групп в возрасте 7 суток была достоверно выше аналогов в контроле на 4,8; 7,5; 3,2 %, показатели цыплят 1-й опытной группы были на уровне аналогов в контроле. В возрасте 14 суток по скорости роста цыплята 2-й, 3-й и 4-й опытных групп превышали аналогов в контроле соответственно на 0,1; 1,4 и 1,2 %, а 1-й и 2-й опытных групп были на уровне контроля. В 21-суточном возрасте показатели всех опытных групп по скорости роста превышали аналогов в контроле соответственно на 4,8; 11,5; 4,2; 9,3 %. В 28-суточном возрасте относительная скорость роста цыплят всех опытных групп была на уровне и ниже, чем в контрольной группе. Максимальная скорость роста наблюдалась в возрасте 7 суток у цыплят 3-й опытной группы, которые получали ветом 3 по 75 мг/кг массы 3 раза в сутки через 24 ч в течение месяца.
Таблица 53. Динамика изменения скорости роста подопытных цыплят кросса «Бройлер-6» (по Броди), %
Возраст, дней | Группа | |||||||||
1-я опытная | 2-я опытная | 3-я опытная | 4-я опытная | контрольная | ||||||
M±m | Cv | M±m | Cv | M±m | Cv | M±m | Cv | M±m | Cv | |
7 | 88,0±0,79 | 2,0 | 93,6±0,63*** | 1,52 | 96,6±0,59*** | 1,36 | 91,9±0,28*** | 0,69 | 88,9±0,43 | 1,08 |
14 | 64,7±0,44 | 1,51 | 64,8±0,35 | 1,21 | 68,1±0,36*** | 1,19 | 66,7±0,31*** | 1,04 | 64,7±0,42 | 1,45 |
21 | 68,6±0,35*** | 1,14 | 62,6±0,29*** | 1,04 | 55,3±0,27*** | 1,1 | 60,4±0,41*** | 1,53 | 51,1±0,17 | 0,76 |
28 | 23,3±0,24*** | 2,26 | 26,1±0,26 | 2,18 | 28,6±0,09*** | 0,73 | 24,3±0,30*** | 2,75 | 34,32±0,29 | 1,93 |
Таким образом, ветом 3 оказывает позитивное влияние на продуктивность цыплят кросса «Бройлер-6» и ISA. В реакции организма цыплят на ветом 3 установлены определенные закономерности. Проявление этих закономерностей преимущественно зависело от кратности и схем применения препарата и в меньшей степени - от индивидуальных, возрастных и породных особенностей организма цыплят-бройлеров. Между кратностью применения ветома и интенсивностью роста цыплят-бройлеров просматривается прямая зависимость. Ветом 3 повышал скорость роста цыплят-бройлеров, не изменяя динамику физиологической скорости роста по возрастным периодам. У цыплят опытных и контрольной групп максимальная скорость роста регистрировалась в период назначения препарата до 28-суточного возраста с последующим ее снижением. Оптимальные результаты получены при применении препарата в дозе 75 мг/кг массы 3 раза в сутки через 24 ч в течение месяца. Цыплята этой опытной группы по абсолютной массе, среднесуточному приросту живой массы и относительной скорости роста превышали показатели других опытных групп.
Между продолжительностью введения препарата и интенсивностью роста цыплят наблюдается обратная зависимость. С увеличением продолжительности введения препарата интенсивность роста цыплят понижается. Определенное влияние на ростостимулирующее действие ветома 3 оказывали возраст цыплят и индивидуальные особенности кросса.
Ветом 3 оказывал выраженное действие на интенсивность роста цыплят только в период его назначения. В период последействия происходило понижение интенсивности роста, и в завершающий период опыта показатели интенсивности роста были на уровне и ниже аналогов контрольной группы.
Нами установлено наличие закономерностей в действии препарата с учетом кратности его применения на интенситвность роста. Максимальный среднесуточный прирост живой массы отмечали у цыплят, получавших препарат 1 и 2 раза в сутки в 7- и 14-суточном возрасте – соответственно (11,7±0,52) и (21,6±0,65) г; (11,7±0,5) и (22,4±0,6) г; в контрольной группе (11,5±0,5) и (21,2±0,62) г. При введении препарата 3 раза в сутки в 7- и 28-суточном возрасте - соответственно (13,18±0,4) и (60,93±3,9) г; в контрольной группе (10,34±0,51) и (47,25±2,48) г. Сила влияния ветома 3 на среднесуточный прирост цыплят-бройлеров кросса ISA была наиболее высокой в 7-дневном возрасте ((22,7±2,71) %, Р<0,001). С увеличением периода назначения препарата происходило снижение силы влияния его на прирост живой массы до (12,9±3,06) % (Р<0,001) в 28-суточном возрасте. За опытный период этот показатель составлял (21,4±2,76) % (Р<0,001). Проведенные нами исследования свидетельствуют, что сила влияния препарата на живую массу птицы кросса ISA также более выражена в 7-суточном возрасте ((23,4±2,69) %,Р<0,001). С возрастом этот показатель снижался и в 35-дневном возрасте составлял (6,45±3,28) (Р<0,05).
Относительная скорость роста цыплят-бройлеров была максимальной при скармливании препарата 1 и 2 раза в сутки в 7- и 14- суточном возрасте - соответственно 110,0±1,2 и 78,03±0,4; 110,0±1,2 и 79,8±0,3, в контрольной группе - 105,0±1,5 и 77,03±1,5. При кратности введения препарата 3 раза в сутки в 7- и 28-суточном возрасте - соответственно 102,2±2,2 и 43,1±2,25, в контрольной группе - 90,4±2,84 и 35,92±1,6.
Оптимальные результаты получены при скармливании препарата в дозе 75 мг/кг массы 3 раза в сутки через 24 ч в течение месяца. По абсолютной массе, среднесуточному приросту и относительной скорости роста цыплята этой опытной группы превышали аналогов из других опытных групп. В 7, 14, 21 и 28-суточном возрасте при применении ветома 3 кратностью 1 раз в сутки через 24 ч в течение месяца по абсолютной массе соответственно на 15,2; 69,5; 35,1; 17,0 %, среднесуточному приросту в 7-, 14- и 21-суточном возрасте – на 11,9; 111,5; 4,0 %; относительной скорости роста в 14-дневном возрасте - на 30,1 %; при применении препарата 2 раза в сутки в течение месяца в 7-, 14-, 21- и 28-суточном по абсолютной массе на 15,2; 65,8; 33,6; 13,4 %, среднесуточному приросту - на 11,3; 51,0; 3,8; 0,4 % и относительной скорости роста в 14-дневном возрасте на 26,3 %.
Интенсивность роста цыплят зависела также и от схем применения ветома 3. При применении ветома 3 цыплятам кросса «Бройлер-6» по схеме 3 раза в сутки 7 дней подряд отмечали незначительное повышение интенсивности роста цыплят. Только на 21-й день эксперимента среднесуточный прирост у цыплят этой группы повышался на 21,8 %, скорость роста на 4,8 % относительно аналогов из контроля.
При назначении препарата по схеме 3 раза в сутки 3 дня подряд с 3- дневным перерывом с повтором цикла 5 раз на 7-й, 14-й, 21-й дни исследований среднесуточный прирост цыплят этой группы был выше аналогов из контроля соответственно на 11,1; 7,4; 42,4 %, скорость роста - на 4,8; 0,1; 11,5 %.
При применении препарата по схеме 3 раза в сутки через 24 ч в течение месяца интенсивность роста цыплят была выше аналогов из контроля за весь опытный период. По среднесуточному приросту цыплята этой группы превышали аналогов из контроля в 7, 14, 21-суточном возрасте соответственно на 17,0; 19,0; 27,7 %, по относительной скорости роста - на 7,5; 1,4; 4,2 %.
При скармливании препарата по схеме 3 раза в сутки через 24 ч в течение 14 дней среднесуточный прирост у опытных цыплят был выше аналогов из контроля в 7, 14 и 21-дневном возрасте на 6,2; 8,6 и 37,3 %, относительная скорость роста на 3,2; 1,2; 9,3 % соответственно.
Более высокие показатели интенсивности роста отмечены при скармливании препарата по схеме 3 раза в сутки через 24 ч в течение месяца. По абсолютной массе, среднесуточному приросту и относительной скорости роста цыплята этой опытной группы превышали аналогов из других опытных групп. В 7, 14, 21 и 28-суточном возрасте соответственно при применении препарата: по 75 мг/кг 3 раза в сутки 7 дней подряд по абсолютной массе на 14,5; 15,9; 15,1; 8,3 %; по среднесуточному приросту живой массы на 19,1; 20,4; 4,7 и 26,2 %; по относительной скорости роста в 7, 14 и 28-суточном возрасте - на 8,4; 1,2; 5,3 %; при назначении препарата по 75 мг/кг 3 раза в сутки 3 дня подряд 3 дня перерыв циклом 5 раз в 7, 14 и 28-суточном возрасте по абсолютной массе на 4,4; 6,8; 1,2 %; по среднесуточному приросту живой массы на 5,3; 10,8; 9,7 %; по относительной скорости роста на 2,7; 2,2; 2,5 %; при назначении препарата по 75 мг/кг 3 раза в сутки через 24 ч в течение 14 дней в 7, 14, 21 и 28-суточном возрасте по абсолютной массе на 8,0; 7,9; 2,1 и 6,6 %; по среднесуточному приросту в 7, 14 и 28-суточном возрасте на 10,1; 9,6; 23,1 %; по относительной скорости роста - соответственно на 4,6; 0,2; 4,3 %. В наших исследованиях максимальный абсолютный прирост массы тела цыплят кросса «Бройлер-6» был отмечен в возрасте 21 суток. Полученные нами данные согласуются с исследованиями Ю.В. Конопатова, Е.Е. Макеевой (2000), которые в своих исследованиях также регистрировали максимальный прирост цыплят кросса «Бройлер-6» в 21-28 суточном возрасте.
Определенное влияние на ростостимулирующее действие ветома 3 оказывал возраст цыплят. В первые 14 дней жизни реакция организма цыплят на введение препарата была более высокой.
Ростостимулирующее действие ветома 3 зависело и от индивидуальных особенностей кросса. У цыплят кросса «Бройлер-6» отмечали высокую интенсивность роста в 7 и 21-суточном возрасте и снижение роста на 14 и 28-й день. У цыплят кросса ISA регистрировали невысокую интенсивность роста до 7 и 21-суточного возраста с последующим ее повышением на 14-й и 28-й день. При скармливании препарата в дозе 75 мг/кг массы 3 раза в сутки через 24 ч в течение месяца по среднесуточному приросту цыплята кросса «Бройлер-6» на 7-й и 21-й дни жизни превышали цыплят кросса ISA соответственно на 42,0 и 1,6 %. В 14- и 28-суточном возрасте у цыплята кросса ISA среднесуточный прирост живой массы был выше кросса «Бройлер-6» на 54,4 и 77,6 %.
Полученные нами данные согласуются с результатами исследований В.В. Леонович (1971), С.В. Поповой, М.М. Макаровой (1985) и др., которые в своих экспериментах при скармливании комбинированных культур ацидофильных бактерий отмечали увеличение прироста цыплят на (15-20) %. Л.Г. Архангельская и соавт. (1983), скармливая ацидофилин цыплятам, также отмечали увеличение их приростов на (8-18) %.
Механизм ростостимулирующего действия ветома 3 основан на том, что препарат интенсифицирует внутриклеточный метаболизм и способствует максимальной реализации генетических возможностей организма. Повышает активность ферментов, образование органических кислот, которые усиливают перистальтику и секрецию кишечника и способствуют перевариванию корма. В организме под влиянием ветома 3, по-видимому, активизируется витаминный и азотистый обмен. Продуктивность птицы зависит и от наличия в кишечном тракте высокоадгезивных молочно-кислых и бифидобактерий.
11. Качество продукции при применении пробиотиков
По данным литературных источников, пробиотические препараты оказывают позитивное влияние на качество продукции. В тушах животных, которым в молочном периоде скармливали лактоамиловорин, повышается выход мякоти, возрастает индекс мясности и улучшаются вкусовые качества мяса (Тараканов и соавт., 1999).
Б.В. Тараканов и соавт. (2000) указывают, что включение в комбикорма лактоамиловорина улучшало качество получаемой продукции. В контрольной группе 89 тушек из 100 отвечали требованиям первой и второй категорий, а в опытной группе – 92. В среднем по группам выход тушек первой категории возрастал с 66,9 % в контроле до 69,5 в опыте, а нестандартная продукция составила соответственно 10,7 и 8 %. Химический состав мяса существенно не изменялся.
По данным И. Егорова и соавт. (ВНИТИП, 2003), бифидум - СХЖ обладает ростостимулирующим эффектом. Так, живая масса цыплят-бройлеров на день убоя превышала массу контрольных на 3,6% (Р<0,05). Убойный выход мяса полупотрошеных тушек повысился на 0,9%, а выход тушек первой категории – на 3,3%.
Для изучения влияния ветома 1.1 на качество мясной продукции принципу аналогов сформировали три опытных и контрольную группы из суточных цыплят-бройлеров кросса «Смена-2». Цыплятам опытных групп ветом 1.1 назначали с кормом в дозе 75 мг на 1 кг массы 1 раз в сутки до конца периода выращивания с использованием трех схем. В 1-й опытной группе двукратно – по 10 дней подряд, с интервалом в 20 дней; во 2-й опытной группе – 5-дневными циклами, с интервалом между назначением 5 дней, всего 5 циклов; в 3-й опытной группе – через 24 ч до конца периода выращивания. В контрольной группе препарат не применяли.
Для определения продуктивных качеств проводили анатомическую разделку тушек по Т.В. Поливановой (1967) и сортировку их в соответствии с ГОСТ 25391-82.
Для изучения влияния препарата на качество мяса пользовались методом определения содержания белка по Къельдалю; методом определения жира с использованием экстракционного аппарата Сокслета, определяли количество влаги высушиванием в сушильном шкафу при температуре (105±2) и (150±2) 0С, золы, жирных кислот, аминокислот – по методическим рекомендациям Сибирского научно-исследовательского и проектно-технологического института животноводства (1998).
По достижении цыплятами возраста 60 дней проводили убой всей птицы, тушки сортировали в соответствии с ГОСТ 25391-82 (табл. 54).
Таблица 54. Показатели тушек бройлеров по категориям (1-я серия опытов)
Показатель | Группа | |||||||
контрольная | 1-я опытная | 2-я опытная | 3-я опытная | |||||
голов | % | голов | % | голов | % | голов | % | |
Всего | 38 | 100 | 47 | 100 | 50 | 100 | 45 | 100 |
Из них: первой категории второй категории нестандартные | 29 8 1 | 76,3 21,1 2,6 | 40 7 – | 85,1 14,9 – | 43 7 – | 86 14,0 – | 39 6 – | 86,7 13,3 – |
Цыплята-бройлеры опытных групп превосходили по качеству тушек аналогов из контроля, и большинство тушек птиц опытных групп было отнесено к первой категории. В 1-й опытной группе их количество составляло 85,1 %, во 2-й – 86 %, в 3-й – 86,7 %, в контрольной группе 76,3 %. В опытных группах, в отличие от контроля, не было нестандартных тушек. Следовательно, ветом 1.1 оказывал положительное влияние на качество тушек.
Послеубойная оценка тушки дает возможность определить качество мяса реализуемой птицы, то есть совокупность биологических и органолептических показателей, обусловливающих пригодность его для удовлетворения потребностей человека в питательных веществах. Аромат и консистенция мяса, вкус и прозрачность бульона находились в пределах нормы и существенно не отличались в контрольной и опытных группах. Полученные результаты свидетельствуют, что основные показатели, такие как масса полупотрошеной и потрошеной тушки, у цыплят-бройлеров опытных групп достоверно превосходили аналогов из контроля .
Цыплята 1-й, 2-й и 3-й опытных групп превышали аналогов из контроля по массе полупотрошеной тушки соответственно на 23,5; 28,7 и 23,2 % (Р<0,001), потрошеной - на 23,6; 28,7 и 24 % (Р<0,001), мышечного желудка - на 28,2; 49,2 и 41,7 % (Р<0,001), печени, сердца - на 22,6; 27,8 и 22,3 % (Р<0,01).
Таким образом, цыплята-бройлеры, получавшие в рационах ветом 1.1, лучше развивались и имели более высокие качественные показатели продукции относительно аналогов из контроля. Выраженность этих изменений зависела от схемы применения препарата. Максимальный эффект получен при назначении ветома 1.1 5-дневными циклами с интервалом 5 дней в дозе 75 мг/кг массы один раз в сутки. Цыплята этой опытной группы превышали по исследуемым показателям аналогов из 1-й и 3-й групп по массе полупотрошеной тушки соответственно на 4,2 и 4,4 %, потрошеной - на 4,2 и 3,8 %, мышечного желудка - на 16,4 и 5,3 %, печени, сердца - на 4,3 и 4,6 %.
Следовательно, ветом 1.1 оказывает позитивное влияние на обменные процессы в организме и качественные показатели продукции. Наши данные согласуются с исследованиями Б.В. Тараканова и соавт. (2000), И. Егорова и соавт. (2003), которые сообщают, что включение в комбикорма цыплятам пробиотиков улучшало качество получаемой продукции и повышало выход тушек первой категории.
Пищевая ценность мяса определяется содержанием в нем белка, незаменимых аминокислот, ненасыщенных жирных кислот, микро- и макроэлементов, влаги.
Химический состав мяса подопытных цыплят-бройлеров под влиянием ветома 1.1 также изменялся (табл.55).
Таблица 55. Динамика химического состава мышечной ткани у подопытных цыплят-бройлеров (1-я серия опытов)
Показатель | Группа | |||
контрольная | 1-я опытная | 2-я опытная | 3-я опытная | |
Вода, % | 71,97±0,73 | 71,20±0,99 | 70,59±0,78 | 72,44±0,62 |
Жир, % | 8,59±0,90 | 9,08±0,93 | 9,75±0,86 | 7,49±0,63 |
Белок, % | 18,66±0,17 | 18,89±0,14 | 18,843±0,10 | 19,10±0,14 |
Зола, % | 0,76±0,03 | 0,81±0,03 | 0,81±0,06 | 0,95±0,05* |
Кальций, г/кг | 0,05±0,01 | 0,03±0,01 | 0,04±0,00 | 0,05±0,00 |
Марганец, мг/кг | 0,23±0,01 | 0,18±0,01* | 0,19±0,02 | 0,19±0,03 |
Медь, мг/кг | 0,07±0,01 | 0,08±0,01 | 0,06±0,00 | 0,09±0,00 |
У цыплят-бройлеров 1-й и 2-й опытных групп содержание воды в мышечной ткани было ниже аналогов из контроля соответственно на 1 и 2 %, а в 3-й группе выше на 0,7 % (разница недостоверна).
Количество жира в мышечной ткани у цыплят 1-й и 2-й опытных групп по сравнению с контролем было выше соответственно на 5,7 и 13,5 %, а в 3-й группе установлено понижение исследуемого показателя на 13 % (разница недостоверна).
Содержание белка в мышечной ткани цыплят-бройлеров 1-й, 2-й и 3-й опытных групп по сравнению с аналогами из контроля было выше соответственно на 1,2; 1 и 2,4 % (разница недостоверна).
У цыплят-бройлеров 1-й, 2-й и 3-й опытных групп содержание золы в мышечной ткани было выше аналогов из контроля соответственно на 6,6; 6,6 (Р>0,1) и 25 % (Р<0,05).
Кальция в мышечной ткани цыплят-бройлеров опытных групп по сравнению с аналогами из контроля было ниже в 1-й на 40 % и 2-й на 20 % (Р>0,1), а в 3-й группе было на одном уровне с контролем.
Марганца у цыплят 1-й, 2-й и 3-й опытных групп по сравнению с контролем было меньше на 21,7 (Р<0,05); 17,4 и 17,4 % (разница недостоверна).
Меди в мышечной ткани в 1-й и 3-й опытных группах было больше по сравнению с аналогами из контроля соответственно на 14,3 и 28,6 %, а в 3-й ниже на 14,3 % (разница недостоверна).
Насыщенные жирные кислоты организм использует как энергетический материал, но их избыток в пище часто приводит к нарушению обмена жиров, повышению уровня холестерина в крови.
Влияние ветома 1.1 на содержание жирных кислот в мышцах подопытных цыплят-бройлеров отражено в табл. 56.
Содержание в мышечной ткани лауриновой кислоты у подопытных цыплят-бройлеров 1-й и 2-й групп ниже на 8,3 % по сравнению с контролем, а в 3-й выше на 58,3 % (разница недостоверна).
Содержание миристиновой кислоты в мышечной ткани бройлеров 1-й и 2-й опытных групп было выше аналогов из контроля соответственно на 1,7 и 0,8 %, а в 3-й группе этот показатель был достоверно ниже по сравнению с контролем на 2,6 % (Р<0,1).
В 1-й и 2-й группах количество стеариновой кислоты было выше аналогов из контроля соответственно на 2,2 и 7,4 %, а в 3-й этот показатель ниже по сравнению с контролем на 8,8 % (разница недостоверна).
Таблица 56. Динамика жирных кислот в мышечной ткани у подопытных цыплят-бройлеров, % (1-я серия опытов)
Показатель | Группа | |||
контрольная | 1-я опытная | 2-я опытная | 3-я опытная | |
Лауриновая | 0,12±0,06 | 0,11±0,05 | 0,11±0,03 | 0,19±0,05 |
Миристиновая | 1,18±0,00 | 1,20±0,01 | 1,19±0,03 | 1,15±0,01# |
Стеариновая | 8,15±0,33 | 8,33±0,29 | 8,75±0,46 | 7,84±0,21 |
Линолевая | 12,66±0,70 | 13,70±0,67 | 14,48±0,93 | 12,74±0,28 |
Линоленовая | 0,72±0,10 | 0,71±0,08 | 0,57±0,13 | 0,83±0,08 |
Арахиновая | 0,28±0,05 | 0,27±0,04 | 0,20±0,07 | 0,35±0,04 |
Содержание линолевой кислоты в мышечной ткани бройлеров 1-й, 2-й и 3-й опытных групп было выше аналогов из контроля соответственно на 2,2; 14,4 и 0,6 % (разница недостоверна).
В 1-й и 2-й опытных группах линоленовой кислоты было меньше аналогов из контроля соответственно на 1,4 и 20,8 %, а в 3-й группе этот показатель выше по сравнению с контролем на 15,3 % (разница недостоверна).
Арахиновой кислоты у цыплят 1-й и 2-й групп было ниже аналогов из контроля соответственно на 3,6 и 28,6 %, а в 3-й группе выше на 25 % (разница во всех случаях недостоверна).
Белки – наиболее ценные компоненты мяса птицы. Качество белков определяется их аминокислотным составом.
Содержание некоторых аминокислот в мышечной ткани подопытных цыплят представлено в табл. 57.
Изолейцина в мышечной ткани цыплят 1-й и 2-й опытных групп по сравнению с контролем выше на 3 %, а в 3-й группе ниже на 7,4 % (разница недостоверна).
Глицина у цыплят 1-й и 2-й опытных групп выше аналогов из контроля соответственно на 2 и 12 %, а 3-й группы ниже на 6 % (разница недостоверна).
Аланина у цыплят 1-й и 2-й групп по сравнению с контролем больше соответственно на 4,4 и 11,8 %, а 3-й группы ниже на 5,9 % (разница недостоверна).
Таблица 57. Динамика аминокислот в мышечной ткани у подопытных цыплят-бройлеров под влиянием ветома 1.1, % (1-я серия опытов)
Показатель | Группа | |||
контрольная | 1-я опытная | 2-я опытная | 3-я опытная | |
Изолейцин | 0,68±0,02 | 0,70±0,03 | 0,70±0,07 | 0,63±0,03 |
Глицин | 0,51±0,03 | 0,52±0,04 | 0,57±0,04 | 0,48±0,02 |
Аланин | 0,68±0,04 | 0,71±0,05 | 0,76±0,06 | 0,64±0,03 |
Метионин | 0,42±0,02 | 0,43±0,02 | 0,45±0,03 | 0,34±0,07 |
Лизин | 1,46±0,10 | 1,24±0,16 | 1,64±0,14 | 1,35±0,08 |
Метионина в мышечной ткани цыплят 1-й и 2-й групп больше аналогов из контроля соответственно на 2,4 и 7,1 %, а 3-й группы ниже на 19 % (разница недостоверна).
Лизина в 1-й и 3-й группах меньше, чем у аналогов из контроля, соответственно на 15,1 и 7,5 %, а 2-й группы выше на 12,3 % (разница недостоверна).
Таким образом, цыплята-бройлеры, получавшие в рационах ветом 1.1, лучше развивались и имели более высокие качественные показатели продукции относительно аналогов из контроля. Выраженность этих изменений зависела от схемы применения препарата. Максимальные результаты получены при назначении ветома 1.1 5-дневными циклами с интервалом 5 дней в дозе 75 мг/кг массы один раз в сутки. Так, цыплята этой опытной группы превышали аналогов из 1-й и 2-й группы по массе полупотрошеной тушки соответственно на 4,2 и 4,4 %, потрошеной - на 4,2 и 3,8 %, мышечного желудка - на 16,4 и 10,5 %, печени, сердца - на 4,3 и 4,6 %.
В мышечной ткани цыплят-бройлеров опытных групп увеличивалось содержание белка, жира, золы, аминокислот, жирных кислот, а содержание воды понижалось. Следовательно, включение в рацион цыплят ветома 1.1 по предлагаемым схемам способствует повышению биологической полноценности мышечной ткани.
Обнаружено определенное действие ветома 1.1, по-видимому, на углеводный обмен (снижение содержания воды в тканях), что связано с улучшением качества мяса. Следовательно, включение в рацион цыплятам-бройлерам ветома 1.1 по предлагаемым схемам способствует повышению питательной ценности мышечной ткани. Подобные результаты получены А.Я. Шурыгиным и соавт. (1996) при изучении влияния препарата лактовит на биохимический состав мышечной ткани цыплят-бройлеров, а Б.В. Тараканов и соавт. (2000) указывают, что включение в комбикорма цыплятам-бройлерам лактоамиловорина существенно не меняло химический состав мяса.
12. Терапевтическая эффективность ветома 1.1 при колибактериозе у цыплят-бройлеров
Несмотря на усилия ветеринарной службы по проведению массовой вакцинации животных против кишечных инфекций, усовершенствованию схем применения известных и поиска новых антибиотиков, заболеваемость и падеж молодняка, вызванные болезнями желудочно-кишечного тракта, остаются высокими (Малик и соавт., 2001).
Многочисленные литературные данные свидетельствуют о том, что диарею у новорожденных не всегда вызывают патогенные штаммы эшерихий, сальмонелл и других известных возбудителей пищевых токсикоинфекций. Во многих случаях болезнь ассоциирована с непатогенными микроорганизмами либо возбудителя не выявляют. Доказано, что антибиотики нарушают кишечный микробиоценоз, и после их применения очень часто развивается диарея (Микельсаар, 1990; Карпуть, 1996; Хапугин и соавт., 1999).
Сдвиги в количественном и качественном составе условно-патогенной и нормальной кишечной микрофлоры, обозначаемые как дисбактериоз, – один из факторов развития диарейного синдрома. Наличие связи между соматическими болезнями матери и потомства, кишечным дисбактериозом и повышением вирулентных свойств у условно-патогенных микроорганизмов подтверждено клиническими и экспериментальными исследованиями (Nurmi et al., 1973; Uoid et al., 1977; Антипов, 1981; Wren, 1987; Мурашова и соавт., 1999; Панин и соавт., 2000).
Профилактика желудочно-кишечных болезней приобретает социальную значимость, поскольку параллельно с увеличением потребления говядины, свинины и мяса птицы возрастает контаминация возбудителями пищевых токсикоинфекций человека, а именно сальмонеллами, иерсиниями, эшерихиями и другими микроорганизмами.
Это обстоятельство потребовало пересмотра сложившихся методологических подходов к профилактике и лечению желудочно-кишечных болезней и необходимости разработки нового поколения экологически безопасных препаратов, направленных на коррекцию кишечного биоценоза животных и повышение колонизационной резистентности слизистой кишечника к контаминации условно-патогенной микрофлорой.
Как указывают исследователи многих стран, в профилактике и лечении желудочно-кишечных болезней молодняка велико значение заместительной терапии, направленной на восстановление кишечного биоценоза путем регуляторного введения живых бактерий – представителей нормальной кишечной микрофлоры (Fox, 1988; Fuller, 1989; Bariram et al., 1994; Лагуткин, 1995; Gallaher et al., 1996; Воробьев и соавт., 1999; Мурашова и соавт., 1999; Коршунов и соавт., 1995,2000; Ноздрин и соавт., 2001). Препараты, в состав которых они входят, называют пробиотиками (Gilliland et al., 1977; Антипов, 1991; Придыбайло, 1991; Krause et al., 1995).
В числе фармакологических средств, применяемых с лечебно-профилактической целью при бактериальных инфекциях, необходимо шире использовать пробиотики. Это подтверждают данные H.P. Barirama et al. (1994), Н.И. Лагуткина (1995), D.D. Gallaher et al. (1996), А.А. Воробьева и соавт. (1999), А.О. Мурашовой и соавт. (1999), В.М. Коршунова и соавт. (2000), Г.А. Ноздрина и соавт. (2001).
Многокомпонентный состав и разностороннее фармакологическое действие позволяют применять пробиотики с высоким эффектом для профилактики и лечения желудочно-кишечных болезней и дисбактериозов, нарушений обмена веществ (анемии, гиповитаминозы и др.), регуляции постстрессовых состояний, особенно в период технологически обязательных мероприятий, коррегирования антимикробной терапии, предупреждения рецидивов болезней.
Новым направлением в применении пробиотиков является разработка препаратов, основу которых составляют бациллы – бактерии рода Bacillus. Привлекательность этих микроорганизмов объясняется исследователями их безвредностью для организма животного, даже в концентрациях, значительно превышающих те, что рекомендуются для применения, за исключением B. cereus и B. anthracis. Микроорганизмы, содержащиеся в пробиотических препаратах, способны повышать неспецифическую резистентность организма, подавлять развитие многих патогенных и условно-патогенных микроорганизмов, обладают противоаллергенным и антитоксическим действием, имеют ферментные системы, способные регулировать и стимулировать пищеварение (Гончарова, 1986; Лянная и соавт., 1986; Гончарова и соавт., 1987; Шендеров и соавт., 1997; Veld et al., 1998).
Т.А. Кашперова и соавт. (2000) при изучении эффективности субалина в промышленном производстве цыплят-бройлеров установили, что пробиотик обладает лечебно-профилактическим действием, антистрессовыми качествами, приводит к нормализации кишечной микрофлоры и улучшению обменных процессов у птицы, повышает сохранность молодняка.
R. Miles et al. (1981) установили, что добавление в рационы кур ацидофильной палочки положительно влияет на яйценоскость, качество яиц и микрофлору пищеварительного тракта.
В.Ф. Оркин и соавт. (1986), применяя бифидумбактерин для нормализации кишечной микрофлоры, установили, что пероральное введение бифидумбактерина с профилактической целью в течение 4 дней подряд через каждые 24 ч снижает заболеваемость цыплят энтеритом в 3 раза. Использование пробиотика для лечения энтерита у цыплят однократно в сутки в течение 8 дней уменьшает падеж более чем в 2 раза по сравнению с контролем.
Приведенные данные свидетельствуют о том, что создание пробиотиков и их широкое применение являются сегодня стратегическим направлением в профилактике и борьбе со многими инфекционными и неинфекционными заболеваниями.
Ветом 1.1 – препарат сравнительно новой группы пробиотиков, действие которого в отношении птиц изучено еще не достаточно.
Исследования по определению терапевтической эффективности проводили на 30-дневных цыплятах-бройлерах кросса «Смена-2», больных колибактериозом. Колибактериоз (колисептицемия, колиинфекция, колиэнтерит, колиперитонит, эшерихиоз) – инфекционное заболевание птиц, вызываемое патогенной кишечной палочкой, относящейся к различным серологическим – антигенным вариантам (01, 02, 078, 0111 и др.). Колибактериозом болеют сельскохозяйственные птицы всех возрастов, наиболее восприимчив молодняк кур 1-120-дневного возраста, у которого болезнь протекает остро и подостро в септической и токсико-септической форме (Радчук, 1990).
Диагноз был установлен на основании эпизоотологических данных, анализа клинических признаков болезни, патолого-анатомических изменений и результатов бактериологического исследования. По принципу аналогов были сформированы две опытных и одна контрольная группы по 18 цыплят в каждой. При подборе учитывали: возраст, живую массу, выраженность и стадию заболевания.
Цыплят-бройлеров 1-й опытной группы лечили ветомом 1.1 в дозе 100 мг/кг массы 2 раза в сутки до выздоровления, молодняку 2-й опытной группы ветом 1.1 назначали 3 раза в сутки в дозе 100 мг/кг массы до выздоровления; в обоих случаях препарат давали с кормом. Птицу контрольной группы лечили неомицина сульфатом (традиционный метод лечения, применяемый в хозяйстве).
При колибактериозе исследования крови проводили до лечения, через 5 и 15 суток после выздоровления. Кровь у цыплят брали из крыловой вены, стабилизировали 1 %-м раствором гепарина на дистиллированной воде (2 капли на 5 мл крови).
У больных цыплят отмечали общую слабость, отсутствие аппетита, жажду, снижение подвижности, замедленную реакцию на внешние раздражители, слезотечение, затрудненное дыхание, понос, повышение температуры тела на (1-2) 0С.
При вскрытии трупов цыплят зафиксированы следующие изменения: подкожная клетчатка в области подгрудка содержит инфильтрат розово-желтого цвета, студенистой консистенции; сердце увеличено, сердечная сорочка тусклая с пленками фибрина, на эндокарде кровоизлияния; легкие отечные, ярко-красные; в брюшной полости небольшое количество кровянистой жидкости; грудные и брюшные воздухоносные мешки местами покрыты пленками фибрина серо-белого цвета; сосуды кишечника и брыжейки кровенаполнены; слизистая оболочка тонкого и толстого отделов кишечника почти на всем протяжении набухшая, гиперемирована, пропитана серозным экссудатом; печень увеличена, капсула шероховатая с налетом фибрина; селезенка кровенаполнена, незначительно увеличена; почки увеличены, темно-вишневого цвета, кровенаполнены.
Успешная терапия и профилактика инфекционных болезней во многом зависят от правильного выбора как самого препарата, так и метода его применения. При этом следует помнить, что многие препараты, кроме специфического действия на патогенный агент, оказывают влияние и на организм птиц (на витаминный баланс, иммунобиологическую реактивность и т.д.). Это необходимо учитывать при их назначении.
Под влиянием ветома 1.1 у подопытных цыплят-бройлеров 1-й и 2-й групп отмечали улучшение общего состояния, прекращение слезотечения на (2-3)-й день, повышение аппетита, снижение температуры тела, нормализацию дыхания и акта дефекации – на 4-й день. Каловые массы приобретали естественный вид и консистенцию соответственно на 4-й и 5-й день, а у цыплят контрольной группы - на (4-5)-й; 6-й и (7-8)-й день после начала лечения соответственно. Выздоровление наступало у цыплят 1-й и 2-й групп в среднем на 5-й и 6-7-й день, а у цыплят контрольной группы на 8-9-й день после начала лечения.
За опытный период в 1-й группе пали 2 цыпленка, во второй – 3, а в контрольной – 5 (табл. 58).
Таблица 58. Показатели эффективности терапии при колибактериозе у подопытных цыплят-бройлеров
|
Группа |
Количество цыплят |
Терапевтическая эффективность, % |
|
|
на начало опыта |
на конец опыта |
||
|
Контрольная |
18 |
13 |
72,2 |
|
1-я опытная |
18 |
16 |
88,8 |
|
2-я опытная |
18 |
15 |
83,3 |
Результаты нашего опыта показали, что использование ветома 1.1 для лечения цыплят-бройлеров 1-й и 2-й опытных групп, больных колибактериозом, позволило сократить продолжительность лечения на 2-4 дня, повысить терапевтическую эффективность по сравнению с контролем соответственно на 23 и 15,4 %.
Максимальный эффект получен при применении препарата в дозе 100 мг/кг массы 2 раза в сутки до выздоровления, которое наступало у цыплят-бройлеров 1-й опытной группы раньше на 1-2 дня. Терапевтическая эффективность также была выше на 5,6 % по сравнению с аналогами из 2-й группы.
У 30-суточных цыплят при колибактериозе отмечали увеличение в крови количества лейкоцитов, общего белка, b-, g-глобулинов, эозинофилов, лимфоцитов и снижение количества эритроцитов, гемоглобина и гематокрита.
Через 5 суток после выздоровления у 40-суточных цыплят 1-й и 2-й опытных групп содержание лейкоцитов в крови было ниже исходных данных соответственно на 42,8 и 51,9 %, эритроцитов выше на 33,7 и 24,2 %, концентрация гемоглобина возросла на 17,9 и 6,9 %, уровень гематокрита - на 11,6 и 10,9 %. У цыплят контрольной группы содержание лейкоцитов в крови было ниже исходных данных на 83 %, эритроцитов выше на 21,7 %, концентрация гемоглобина возросла на 10,2 %, а уровень гематокрита снизился на 20,9 %.
Таблица 59. Динамика морфологических показателей крови цыплят-бройлеров при колибактериозе
|
Группа |
До лечения |
Через 5 суток после выздоровления |
Через 15 суток после выздоровления |
|
Лейкоциты, 109/л |
|||
|
Контрольная |
34,94±0,11 |
19,08±0,09 |
16,28±0,16 |
|
1-я опытная |
34,86±0,26 |
24,42±0,28*** |
21,74±0,35*** |
|
2-я опытная |
34,46±0,46 |
22,68±0,23*** |
22,10±0,70*** |
|
Эритроциты, 1012/л |
|||
|
Контрольная |
1,66±0,14 |
2,02±0,23 |
1,52±0,07 |
|
1-я опытная |
1,78±0,09 |
2,38±0,19 |
2,18±0,11*** |
|
2-я опытная |
1,90±0,11 |
2,36±0,13 |
2,06±0,14** |
|
Гемоглобин, г/л |
|||
|
Контрольная |
70,52±3,99 |
77,70±3,56 |
66,88±3,28 |
|
1-я опытная |
71,44±3,40 |
84,22±2,42 |
82,06±2,66** |
|
2-я опытная |
79,24±1,72# |
84,72±2,07 |
79,14±3,27* |
|
Гематокрит, % |
|||
|
Контрольная |
20,8±1,59 |
17,2±1,20 |
20,2±1,24 |
|
1-я опытная |
22,4±1,94 |
25,0±0,71*** |
26,2±1,32* |
|
2-я опытная |
20,2±2,15 |
22,4±1,57*** |
24,6±1,81# |
По сравнению с аналогами из контроля у птицы 1-й и 2-й опытных групп содержание лейкоцитов в крови было выше соответственно на 27,9 и 18,9 % (P<0,001), эритроцитов – на 17,8 и 16,8 % (Р>0,1), гемоглобина - на 8,3 и 9,0 % (Р>0,1) и уровень гематокрита - на 45,3 и 30,2 % (P<0,001).
Через 15 суток после выздоровления у 50-суточных цыплят-бройлеров 1-й и 2-й опытных групп по сравнению с аналогами из контроля содержание лейкоцитов в крови было выше соответственно на 33,5 и 35,7 %, эритроцитов - на 43,4 и 34,5 % (P<0,001), гемоглобина - на 22,6 (P<0,001) и 18,3 % (P<0,05), уровень гематокрита - на 29,7 (P<0 ,05) и 21,7 % (P<0,1) (табл. 59).
Увеличение количества лейкоцитов, эритроцитов, гемоглобина и гематокритной величины в крови цыплят-бройлеров опытных групп в ходе эксперимента находилось в пределах физиологических норм.
Влияние ветома 1.1 на динамику общего белка и белковых фракций в сыворотке крови подопытной птицы при колибактериозе отражено в табл. 60.
Через 5 суток после выздоровления у 40-суточных цыплят контрольной и 2-й опытной групп количество общего белка в крови было ниже исходных данных соответственно на 2 и 1,1 %, а у птицы 1-й опытной группы оставалось на прежнем уровне. Содержание альбуминов в крови цыплят контрольной, 1-й и 2-й опытных групп относительно исходных данных снижалось соответственно на 12; 6,9 и 10,8 %, a-глобулинов увеличивалось у птицы контрольной группы на 13,4 %, а в 1-й и 2-й снижалось соответственно на 21,2 и 6,4 %. Содержание b-глобулинов в крови цыплят контрольной, 1-й и 2-й групп снижалось соответственно на 51; 8,9 и 12 %, а g-глобулинов увеличивалось на 25,9; 43,2 и 32,6 %. По сравнению с аналогами из контроля в крови подопытных цыплят 1-й и 2-й групп количество общего белка было выше соответственно на 2 и 0,9 % (P>0,1), альбуминов - на 7,7 и 5,7 % (P>0,1), b-глобулинов - на 43 (P<0,001) и 35,2 % (Р<0,05), g-глобулинов - на 11,5 и 7 % (P>0,1). Количество a-глобулинов в крови у цыплят 1-й и 2-й опытных групп было ниже аналогов из контроля соответственно на 42 (Р<0,1) и 28,3 % (P>0,1).
Таблица 60. Динамика общего белка и белковых фракций в сыворотке крови цыплят-бройлеров при колибактериозе
|
Группа |
До лечения |
Через 5 суток после выздоровления |
Через 15 суток после выздоровления |
|
Общий белок, г/л |
|||
|
Контрольная |
45,1±0,16 |
44,2±0,21 |
45,1±0,16 |
|
1-я опытная |
45,1±0,16 |
45,1±0,09 |
45,5±0,11 |
|
2-я опытная |
45,1±0,16 |
44,6±0,09 |
45,5±0,04 |
|
Альбумины, % |
|||
|
Контрольная |
34,08±11,41 |
30,41±10,92 |
41,39±1,78 |
|
1-я опытная |
35,01±12,79 |
32,75±1,76 |
34,88±1,32# |
|
2-я опытная |
35,61±11,36 |
32,14±2,93 |
35,3±1,21# |
|
a-глобулины, % |
|||
|
Контрольная |
29,30±14,70 |
33,23±2,69 |
24,28±3,71 |
|
1-я опытная |
28,28±12,02 |
23,33±1,75# |
21,58±1,80 |
|
2-я опытная |
27,55±16,05 |
25,90±1,65 |
22,59±1,22 |
|
b-глобулины, % |
|||
|
Контрольная |
16,21±4,59 |
10,72±0,67 |
10,03±1,07 |
|
1-я опытная |
16,70±4,74 |
15,33±0,32*** |
14,04±1,16 |
|
2-я опытная |
16,24±10,18 |
14,49±0,52* |
12,26±0,92 |
|
g-глобулины, % |
|||
|
Контрольная |
20,36±5,30 |
25,64±1,62 |
24,29±1,67 |
|
1-я опытная |
19,97±5,92 |
28,59±0,68 |
29,50±0,75# |
|
2-я опытная |
20,72±8,57 |
27,47±0,24 |
29,85±1,08 |
Через 15 суток после выздоровления у 50-суточных цыплят-бройлеров 1-й и 2-й опытных групп по сравнению с аналогами из контроля количество общего белка в крови было выше на 0,9 % (P>0,1). Альбуминов и a-глобулинов в крови цыплят 1-й и 2-й групп было меньше, чем у аналогов из контроля, соответственно на 18,7 и 17,3 % (P<0,1) и на 12,5 и 7,5 % (Р>0,1). Содержание b- и g-глобулинов в крови цыплят 1-й и 2-й групп по сравнению с контролем было выше соответственно на 40 и 22 % (P>0,1) и 21,4 % (Р<0,1) и 22,9 % (Р>0,1).
У 30-суточных цыплят при колибактериозе отмечали снижение в крови бактерицидной активности, количества Т-лимфоцитов и повышение количества В-лимфоцитов (табл. 61, 63).
Бактерицидная активность сыворотки крови цыплят опытных групп на протяжении всего опыта с различной степенью достоверности была выше, чем у контрольной группы (табл. 61).
Таблица 61. Динамика бактерицидной активности сыворотки крови подопытных цыплят при колибактериозе, %
|
Группа |
До лечения |
Через 5 суток после лечения |
Через 15 суток после лечения |
|
Контрольная |
49,85±0,61 |
47,99±0,47 |
49,19±0,35 |
|
1-я опытная |
49,89±0,65 |
51,49±1,47* |
53,41±0,61*** |
|
2-я опытная |
49,85±0,61 |
49,80±0,32# |
51,59±0,53** |
Через 5 суток после выздоровления у 40-суточных цыплят 1-й группы уровень бактерицидной активности сыворотки крови (БАСК) по сравнению с исходными данными увеличивался на 3,2 %, а во 2-й и контрольной группах снижался соответственно на 0,1 и 3,9 %. По сравнению с аналогами из контроля у птицы 1-й и 2-й групп исследуемый показатель был выше соответственно на 7,3 (P<0,05) и 3,8 % (P<0,1).
Через 15 суток после выздоровления у 50-суточных цыплят-бройлеров 1-й и 2-й групп уровень БАСК превышал контроль соответственно на 8,6 (Р<0,001) и 4,9 % (P<0,01) (рис.13 ).
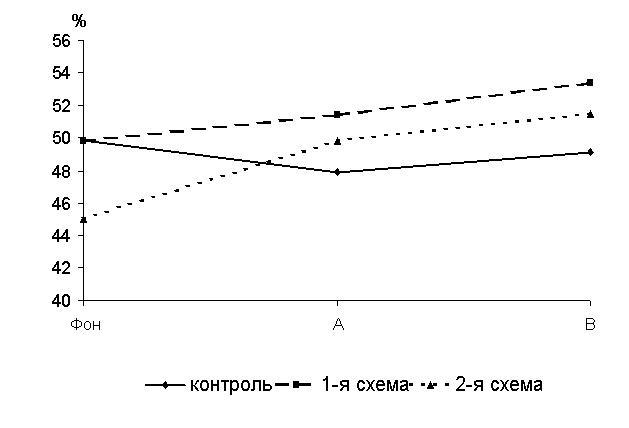 Рис.13 Динамика бактерицидной активности сыворотки крови цыплят, больных колибактериозом, при применении ветома 1.1, %: А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Рис.13 Динамика бактерицидной активности сыворотки крови цыплят, больных колибактериозом, при применении ветома 1.1, %: А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Лизоцимная активность сыворотки крови цыплят-бройлеров опытных групп также на протяжении всего опыта с различной степенью достоверности была выше, чем у птиц контрольной группы (табл. 62).
Через 5 суток после выздоровления у 40-суточных цыплят 1-й, 2-й опытных и контрольной групп уровень лизоцимной активности сыворотки крови (ЛАСК) по сравнению с исходными данными увеличивался соответственно на 23,6; 11 и 11, 2 %. По сравнению с аналогами из контроля у птицы 1-й и 2-й опытных групп исследуемый показатель был выше на 14 (P<0,05) и 5,8 % (рис.14).
Через 15 суток после выздоровления у 50-суточных цыплят-бройлеров 1-й и 2-й опытных групп по сравнению с аналогами из контроля уровень ЛАСК превышал соответственно на 23 (Р<0,01) и 13,5% (P<0,05).
Таблица 62. Динамика лизоцимной активности сыворотки крови подопытных цыплят при колибактериозе, %
|
Группа |
До лечения |
Через 5 суток после выздоровления |
Через 15 суток после выздоровления |
|
Контрольная |
25,77±1,61 |
28,67±1,51 |
31,28±1,65 |
|
1-я опытная |
26,44±1,56 |
32,69±0,99* |
38,48±1,10** |
|
2-я опытная |
27,32±0,98 |
30,33±0,89 |
35,49±0,89* |
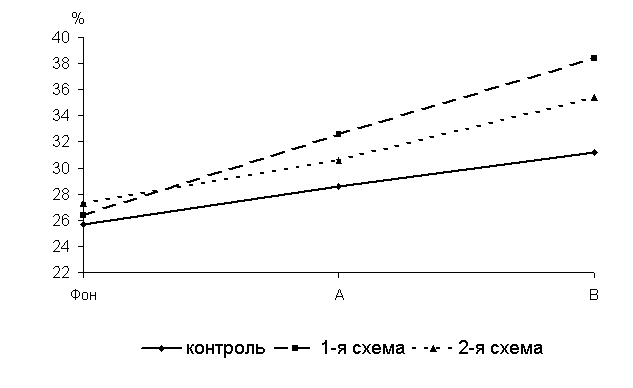
Рис.14 Динамика лизоцимной активности сыворотки крови цыплят, больных колибактериозом, при применении ветома 1.1, % : А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Влияние ветома 1.1 на динамику В-лимфоцитов в крови подопытной птицы отражено в табл. 63.
Таблица 63. Количество В-лимфоцитов в крови подопытных цыплят при колибактериозе, 109/л
|
Группа |
До лечения |
Через 5 суток после выздоровления |
Через 15 суток после выздоровления |
|
Контрольная |
3,6±0,97 |
2,2±0,22 |
3,4±1,03 |
|
1-я опытная |
3,4±0,84 |
3,2±0,22** |
4,8±0,84* |
|
2-я опытная |
3,8±0,55 |
3,0±0,00** |
4,6±0,27 |
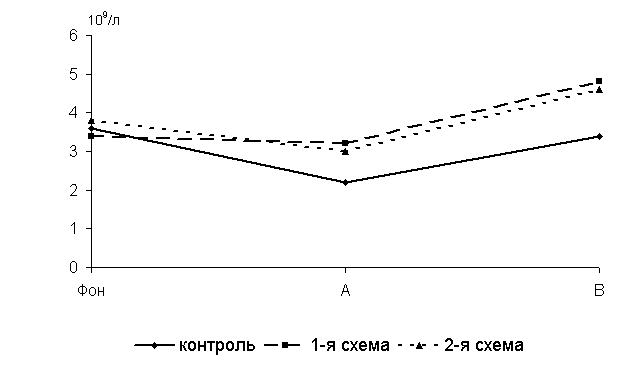 Рис.15 Динамика количества В-лимфоцитов у цыплят, больных колибактериозом, при применении ветома 1.1, 109/л: А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Рис.15 Динамика количества В-лимфоцитов у цыплят, больных колибактериозом, при применении ветома 1.1, 109/л: А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Через 5 суток после выздоровления у 40-суточных цыплят 1-й, 2-й опытных и контрольной групп количество В-лимфоцитов в крови по сравнению с исходными данными уменьшалось соответственно на 6,3; 26,7 и 63,6%. По сравнению с аналогами из контроля у птицы 1-й и 2-й групп исследуемый показатель был выше соответственно на 45,5 и 36,3 % (P<0,01) (рис.15).
Через 15 суток после выздоровления у 50-суточных цыплят-бройлеров 1-й и 2-й групп по сравнению с аналогами из контроля исследуемый показатель был выше на 41,2 (P<0,05) и 35,3 %.
Динамика Т-лимфоцитов в крови подопытных цыплят при колибактериозе отражена в табл. 64.
Таблица 64. Количество Т-лимфоцитов в крови подопытных цыплят при колибактериозе, 109/л
|
Группа |
До лечения |
Через 5 суток после выздоровления |
Через 15 суток после выздоровления |
|
Контрольная |
8,2±1,78 |
11,4±0,91 |
9,0±0,79 |
|
1-я опытная |
9,8±2,16 |
15,6±0,45** |
12,4±0,27** |
|
2-я опытная |
9,8±1,43 |
14,2±0,22* |
11,6±0,27** |
Через 5 суток после выздоровления у 40-суточных цыплят 1-й, 2-й опытных и контрольной групп количество Т-лимфоцитов в крови по сравнению с исходными данными увеличивалось соответственно на 59; 44,9 и 39 % (рис.16).
По сравнению с аналогами из контроля у птицы 1-й и 2-й групп исследуемый показатель был выше на 36,8 (P<0,01) и 24,6 % (P<0,05).
Через 15 суток после выздоровления у 50-суточных цыплят 1-й и 2-й групп по сравнению с аналогами из контроля исследуемый показатель был выше соответственно на 37,7 и 28,8 % (P<0,01). У цыплят-бройлеров при колибактериозе под влиянием ветома 1.1 происходит значительное увеличение биосинтеза в организме Т-лимфоцитов, что свидетельствует о выраженной стимуляции клеточных факторов иммунитета.
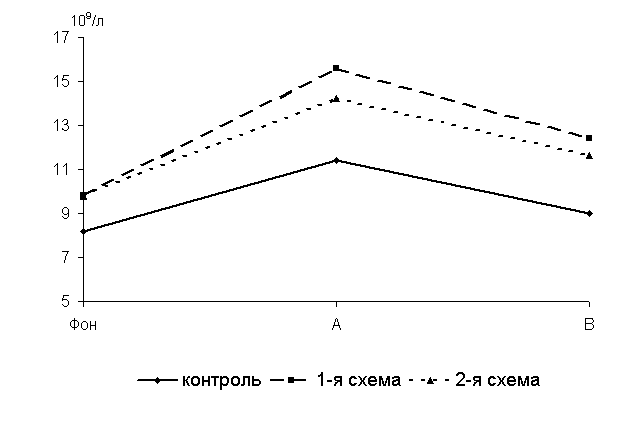 Рис.16. Динамика количества Т-лимфоцитов у цыплят, больных колибактериозом, при применении ветома 1.1, 109/л: А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Рис.16. Динамика количества Т-лимфоцитов у цыплят, больных колибактериозом, при применении ветома 1.1, 109/л: А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Влияние ветома 1.1 на динамику видового состава лейкоцитов в крови цыплят, больных колибактериозом, отражено в табл. 65.
Через 5 суток после выздоровления у 40-суточных цыплят опытных групп по сравнению с исходными данными количество базофилов в крови оставалось на прежнем уровне, а в контрольной уменьшалось на 9%. Количество псевдоэозинофилов, моноцитов в крови цыплят 1-й, 2-й опытных и контрольной групп было выше соответственно на 3,4; 1,7 и 2,6; 25; 45,5 и 16,6 %, а число эозинофилов, лимфоцитов уменьшилось на 9,1; 8,8; и 2,6; 1,3; 1,3 и 0,9 %.
Таблица 65. Динамика лейкограммы подопытных цыплят при колибактериозе, %
|
Время исследования |
Группа |
Виды лейкоцитов |
||||
|
Б |
Э |
П |
Л |
М |
||
|
Фоновые показатели |
Контрольная |
2,4±0,27 |
7,8±0,22 |
23,4±0,27 |
64,0±1,27 |
2,4±0,27 |
|
1-я группа |
2,4±0,45 |
7,2±0,22 |
23,6±0,45 |
64,4±1,04 |
2,4±0,27 |
|
|
2-я группа |
2,4±0,27 |
7,4±0,27 |
23,8±0,42 |
64,2±0,96 |
2,2±0,22 |
|
|
Через 5 суток после выздоровления |
Контрольная |
2,2±0,22 |
7,6±0,27 |
24,0±1,12 |
63,4±0,27 |
2,8±0,22 |
|
1-я группа |
2,4±0,27 |
6,6±0,27 |
24,4±0,67 |
63,6±0,27 |
3,0±0,00 |
|
|
2-я группа |
2,4±0,45 |
6,8±0,22 |
24,2±0,74 |
63,4±0,27 |
3,2±0,22 |
|
|
Через 15 суток после выздоровления |
Контрольная |
2,2±0,22 |
7,4±0,91 |
24,2±0,22 |
64,0±0,00 |
2,2 ±0,22 |
|
1-я группа |
2,4±0,27 |
5,6±0,45 |
24,6±0,27 |
64,4±0,27 |
3,0±0,00** |
|
|
2-я группа |
2,4±0,27 |
5,8±0,45 |
24,4±0,27 |
64,4±0,45 |
3,0±0,00** |
|
** Р<0,01.
По сравнению с аналогами из контроля у цыплят-бройлеров 1-й опытной группы количество базофилов, псевдоэозинофилов, лимфоцитов и моноцитов в крови было выше аналогов из контроля соответственно на 9, 1,7, 0,3 и 7%, а число эозинофилов уменьшилось на 15 % (P>0,1).
У цыплят 2-й группы число базофилов, псевдоэозинофилов, моноцитов также было выше аналогов из контроля соответственно на 9, 0,8, и 14 %, количество лимфоцитов было одинаковым, а число эозинофилов уменьшилось на 12 % (P>0,1).
Через 15 суток после выздоровления количество базофилов в крови цыплят 1-й и 2-й групп превышало аналогов из контроля на 9 %, а число псевдоэозинофилов, лимфоцитов и моноцитов возрастало соответственно на 1,7 и 0,8; 0,6 и 0,6 % (P>0,1) и 36 и 36 % (P<0,01), количество эозинофилов уменьшилось на 32 и 28 % (P>0,1).
Анализ лейкограммы показал: применение ветома 1.1 при колибактериозе цыплят-бройлеров вызывало умеренное повышение числа лимфоцитов, моноцитов, псевдоэозинофилов, что свидетельствует о стимулировании препаратом реакций клеточного иммунитета.
Относительно влияния пробиотиков на гематологические показатели молодняка сельскохозяйственных животных при терапии желудочно-кишечных патологий данные в научной литературе разноречивы. Так, В.И. Мозжерин и соавт. (2000) существенных изменений морфобиохимических показателей крови телят при использовании бактиспорина не выявили. Нами установлено, что ветом 1.1 оказывал положительное влияние на гематологические показатели цыплят-бройлеров, больных колибактериозом. Выраженные изменения исследуемых показателей отмечали при применении препарата по оптимальной схеме на 40-е сутки исследования. Так, в крови подопытных цыплят-бройлеров достоверно увеличивалось количество лейкоцитов, эритроцитов, гемоглобина, Т- и В-лимфоцитов и гематокритной величины соответственно на 27,9; 17,8; 8,3; 36,8 и 45,4 и 45,3 %; нормализовалась лейкоцитарная формула крови, увеличивалось количество лимфоцитов, псевдоэзинофилов, моноцитов и снижалось число эозинофилов соответственно на 0,3, 1,7, 7 и 15 %; в сыворотке крови возрастали бактерицидная и лизоцимная активность, содержание общего белка, альбуминов, b- и g- глобулинов соответственно на 2; 7,7; 43 и 11,5 % по сравнению с аналогами из контроля.
Наши данные соответствуют результатам, полученным В.П. Иноземцевым и соавт. (1998), которые изучали терапевтическую эффективность ветома 1.1 у телят с синдромом диареи. Г.А. Ноздрин и соавт. (2001) наблюдали у подопытных ягнят при гастроэнтеритах увеличение количества гемоглобина на 5 %, эритроцитов - на 20,5 %, лейкоцитов на 21,1 % по сравнению с контролем при применении препарата ноздрин.
Установлено, что препарат оказывает позитивное влияние на интенсивность роста подопытных цыплят-бройлеров после выздоровления.
Средняя масса цыплят, больных колибактериозом, до лечения равнялась 431 г, а согласно нормативам по кроссу «Смена», она должна составлять в 4-недельном возрасте 730 г (табл. 66).
После выздоровления масса цыплят во всех группах постепенно увеличивалась, но имелись некоторые различия в интенсивности роста. У цыплят-бройлеров 1-й и 2-й опытных групп в 40-суточном возрасте, через 5 суток после выздоровления, прирост живой массы относительно исходных данных составлял 49 и 46,5 %, а у аналогов из контрольной – 31,6 %. Следовательно, при применении препарата прирост массы тела был выше аналогов из контроля в среднем на 12,7 % (табл. 66).
Таблица 66. Динамика абсолютной массы тела подопытных цыплят после выздоровления, г
|
Группа |
До лечения |
Через 5 суток после выздоровления |
Через 15 суток после выздоровления |
|
Контрольная |
430,0±20,24 |
565,7±13,78 |
811,4±14,87 |
|
1-я опытная |
435,7±19,86 |
649,3±16,13** |
1000,0±10,00*** |
|
2-я опытная |
427,1±19,11 |
625,7±18,11* |
965,7±13,07*** |
В 40-суточном возрасте, через 5 суток после выздоровления, цыплята 1-й и 2-й групп по абсолютной массе превышали аналогов из контроля соответственно на 14,7 (Р<0,01) и 10,6 % (Р<0,05).
В 50-суточном возрасте, через 15 суток после выздоровления, цыплята-бройлеры 1-й и 2-й групп по абсолютной массе превышали аналогов из контроля соответственно на 23 и 19% (Р<0,001).
Аналогичные нашим результаты при пробиотикотерапии желудочно-кишечных заболеваний поросят, ягнят, телят, цыплят получены В.В. Субботиным и соавт. (1991), П.И. Ждановым (1994), А.Н. Паниным и соавт. (1996), В.И. Мозжериным и соавт. (2000), О.Ю. Леденевой и соавт. (2001), Н.И. Маликом и соавт. (2001).
Из литературных источников известно, что бифидобактерии способствуют более полному гидролизу как растительных, так и животных белков. Это приводит к нескольким положительным эффектам. Во-первых, повышается усвояемость кормов. Во вторых, снижается вероятность развития кормовой непереносимости и связанных с ней кожных заболеваний из-за накопления в толстом отделе кишечника частично не переваренных белков, поскольку бифидобактерии проявляют в отношении их протеолитическую активность. Кроме того, в результате более полного гидролиза, а также превращений продуктов метаболизма увеличивается обеспеченность организма незаменимыми аминокислотами.
Следовательно, можно предполагать, что ветом 1.1 обладает подобным действием и оказывает позитивное влияние на обменные процессы в организме, а также способствует купированию воспалительного процесса, восстановлению нормальной функции желудочно-кишечного тракта и улучшению усвоения кормов за счет стимулирующего влияния на макроорганизм.
Экономическую эффективность применения ветома 1.1 устанавливали путем определения ущерба от падежа, снижения продуктивности, затрат на проведение ветеринарных мероприятий.
За период опыта ущерб от падежа составил в 1-й и 2-й опытных группах соответственно 67,3 и 100,95 руб., а в контрольной – 168,25 руб.
Ущерб от снижения продуктивности цыплят 1-й и 2-й групп составил соответственно 671,90 и 656,96 руб.
Затраты на проведение ветеринарных мероприятий составили в 1-й и 2-й группах соответственно 702,70 и 704,67 руб.
Экономическая эффективность на 1 руб. затрат в 1-й и 2-й группах составила 19,25 и 13,23 руб.
Таким образом, ветом 1.1 оказывает выраженное терапевтическое действие при колибактериозе. У цыплят 1-й и 2-й опытной группы по сравнению с аналогами из контроля сохранность была выше соответственно на 23 и 6,7 %, терапевтическая эффективность - на 4,5 и 1,5 дня, интенсивность роста выше на 12,7 и 3,6 %. После выздоровления в крови цыплят-бройлеров опытных групп регистрируется более высокое содержание эритроцитов, гемоглобина, общего белка, b- и g-глобулинов, В- и Т-лимфоцитов, псевдоэзинофилов, моноцитов и уровня гематокрита, БАСК, ЛАСК. Обобщая полученные данные, можно сделать вывод, что ветом 1.1 оказывает стимулирующее влияние на лимфоцитопоэз и, следовательно, на гуморальный и тканевый иммунитет, так как происходит одновременное повышение количества В- и Т-лимфоцитов, возрастает бактерицидная и лизоцимная активность сыворотки крови. В результате позитивных изменений, происходящих в организме под влиянием ветома 1.1, происходит повышение неспецифической резистентности организма цыплят-бройлеров при колибактериозе в пределах физиологических возможностей. Выраженность этих изменений зависит от терапевтических схем применения препарата. Максимальный эффект достигнут при применении пробиотика в дозе 100 мг/кг массы 2 раза в сутки до выздоровления. Применение ветома 1.1 при колибактериозе цыплят-бройлеров экономически оправдано.
13. Заключение
По результатам наших исследований можно предположить, что механизм действия испытуемого препарата весьма многообразен и включает увеличение количества бифидо- и молочно-кислых бактерий в кишечнике, стимулирование клеточных и гуморальных факторов иммунитета и повышение неспецифической резистентности в организме животных. Бактериальные клетки, содержащиеся в пробиотике, возможно, активно продуцируют ферменты, аминокислоты, антибиотические вещества и другие физиологически активные субстраты, конкурируют за питательные вещества и места адгезии, препятствуют развитию патогенных бактерий.
Таким образом, ветом 3 повышает уровень неспецифической резистентности организма и сохранность цыплят-бройлеров, способствует ускорению их роста и развития и не оказывает побочного действия.
Итак, с учётом полученных нами данных можно сделать вывод о том, что в условиях промышленного производства применение ветома 3, как и других пробиотиков, способствует нормализации процессов обмена веществ, повышению резистентности организма и этим обеспечивает повышение продуктивности и сохранности поголовья птицы.
Ветом 1.1 за счет интенсификации тканевого дыхания, внутриклеточного метаболизма, изменения микробного метаболизма обладает ростостимулирующим эффектом, благотворно влияет на жизнеспособность цыплят, нормализует микрофлору желудочно-кишечного тракта, предотвращая тем самым распространение в организме патогенных бактерий. По-видимому, это связано с тем, что препарат повышает уровень неспецифической защиты и благотворно влияет на устойчивость птицы к кишечным инфекциям.
Для профилактики заболеваний, повышения продуктивности и сохранности цыплят-бройлеров предлагаем применять ветом 3 с суточного возраста в дозе 75 мг/кг массы 3 раза в сутки через 24 ч в течение месяца.
14. Справочник терминов
1. Механизм движения клетки
Вращение мотора вызывает пассивное вращение филамента. Более массивная клетка начинает вращаться примерно со скоростью 1/3 от скорости жгутика и в обратном направлении, а также приобретает поступательное движение.
Подавляющее большинство наделённых жгутиком бактерий имеют палочковидную форму. Из гидродинамических расчётов следует, что для наиболее эффективного движения отношение длины клетки к ширине должно составлять 3,7. Движение кокков крайне неэффективно, поэтому они чаще всего неподвижны.
У ряда бактерий мотор и жгутик могут вращаться только в одном направлении, переориентация происходит при остановке за счёт броуновского движения. Бактерии-перитрихи собирают при движении все свои жгутики (каждый из которых вращается против часовой стрелки) в один пучок. Для совершения кувырка они либо меняют направление вращения, либо изменяют его скорость, из-за чего пучок распадается. При полярном расположении жгутиков один из них может служить и толкающим, и тянущим приспособлением в зависимости от направления вращения.
Скорости движения бактерий варьируют от 20 мкм/с у некоторых Bacillus до 200 мкм/с у Vibrio.
2. Цитохром (гемопротеин) — это маленький глобулярный белок (в первом приближении его структура может быть представлена в виде шара или вытянутого эллипсоида), который содержит ковалентно связанный гем3, расположенный во внутреннем кармане, образованном аминокислотными остатками.
Цитохромы присутствуют во всех клетках организмов. В клетках эукариот они локализованы в митохондриальных мембранах. Известно около 30 видов цитохромов. Все они содержат гем в качестве простетической группы и различаются структурами боковых и полипептидных цепей.
В зависимости от типа гема выделяют 8 классов цитохромов. В зависимости от спектров поглощения, цитохромы делят на группы a, b, c.
3. Гем (от др. -греч. ίμα - кровь), небелковая часть (т. н. простетическая группа) гемоглобина - его красящее вещество.
4. Бактерии сульфатвосстанавливающие (сульфатредуцирующие) - группа строго анаэробных микроорганизмов, восстанавливающих сульфаты до сероводорода. Б. с. используют в качестве источника энергии окисление орг. веществ или молекулярного водорода. В последнем случае они частично пользуются автотрофной системой питания. Широко распространены в природе (в солоноватоводных водоемах, в подземных водах, в м-ниях нефти, серы, сульфидных руд и пр.), участвуя прямо или косвенно в образовании сероводорода, самородной серы, пирита, сернистых соединений нефти и др. Процесс восстановления сульфатов в биосфере в подавляющем большинстве случаев связан с деятельностью Б. с. Являются активным агентом фракционирования изотопов серы в природе. Синонимы: бактерии десульфатизирующие, бактерии десульфирующие (десульфурирующие). Последние два синонима неточны, так как специфика процесса, осуществляемого Б. с., состоит не в удалении серы (десульфуризации), а в восстановлении сульфатов (десульфатизации).
5. Бациллы (аэробные спорообразующие бактерии) - свободноживущие, одноклеточные, нефотосинтезирующие, палочковидные клетки, образующие типичные эндоспоры.
6. К гетеротрофным организмам (гетееротрофы) относят организмы использующие для своего питания готовые органические соединения, для которых источником углерода служит окисление сложных органических соединений - углеводородов жиров, белков: к фотоавтотрофам - организмы, осуществляющие фотохимические реакции; к хемоавтотрофам - организмы, для которых источником энергии являются реакции окисления неорганических веществ.
7. Г+Ц – гуанин =цитозин.
8. Группа антибиотиков полипептидной природы (ацилциклопептиды), образуемых некоторыми штаммами бацилл (главным образом Bacillus polymyxa). Молекулы большинства П. содержат остатки треонина, лейцина, диаминомасляной и 6-метилоктановой кислот. П. активны лишь в отношении грамотрицательных бактерий — синегнойной палочки, возбудителя дизентерии, кишечной палочки, сальмонелл, клебсиелл. Механизм антимикробного действия П. связан с повреждением мембраны бактериальной клетки.
9. Гликоген — полисахарид, образованный остатками глюкозы; основной запасной углевод человека и животных. Гликоген (также иногда называемый животным крахмалом, несмотря на неточность этого термина) является основной формой хранения глюкозы в животных клетках. Откладывается в виде гранул в цитоплазме во многих типах клеток (главным образом печени и мышц).
10. Волютин, внутриклеточные включения у микроорганизмов; временный резерв запасных питательных веществ, аналогичный жировым включениям и гранулам гликогена у животных. В. локализован в цитоплазме (у бактерий и актиномицетов) или в вакуолях (у грибов и водорослей).
11. Микроорганизмы, способные вызвать инфекционный процесс у восприимчивого к болезни вида растительноядного насекомого. Наиболее действенными из них являются бактерии, вирусы и грибы.
12. Таксоно́мия (гр. расположение по порядку + закон) — иерархически выстроенная система целей и результатов от простой к сложной системе. Математически таксономией является древообразная структура классификаций определенного набора объектов. Вверху этой структуры — объединяющая единая классификация — корневой таксон — которая относится ко всем объектам данной таксономии. Таксоны, находящиеся ниже корневого, являются более специфическими классификациями, которые относятся к поднаборам общего набора классифицируемых объектов. Например, в классификации организмов Карла Линнея корневым таксоном является организм. Ниже в этой таксономии находятся тип, класс, отряд, семейство, род и вид.
13. Спорангий — орган, производящий споры у растений, бактерий и грибов.
14. Психрофильные микроорганизмы
(от греч. psychrós - холодный и philéo - люблю), криофильные микроорганизмы, бактерии, дрожжи, микроскопические грибы и водоросли, способные расти при низких температурах (от + 5 до -6 °С). При более высоких температурах размножаются быстрее. В отличие от мезофильных микробов, совсем не растут при (27-37) °С. П. м. обитают в водах Арктики и Антарктики, на поверхности снега и ледников в горах. Некоторые П. м. образуют оранжевые или красные пигменты; развиваясь на поверхности снега, они окрашивают его в красный цвет ("красный снег"). Размножаясь на мясе, фруктах и других пищевых продуктах, сохраняемых в холодильниках, П. м. вызывают порчу продуктов.
15. Филогенетика или филогенетическая систематика - область биологической систематики, которая занимается идентификацией и прояснением эволюционных взаимоотношений среди разных видов жизни на Земле, как современных, так и вымерших. Эволюционная теория утверждает, что сходство среди индивидуумов или видов часто указывает на общее происхождение или общего предка. Потому взаимоотношения, установленные филогенетической систематикой, часто описывают эволюционную историю видов и его филогенез, исторические взаимоотношения среди ветвями организмов или их частей, например их генов. Филогенетическая таксономия, являющаяся ответвлением, но не логическим продолжением, филогенетической систематики, занимается классификацией групп организмов согласно степени их эволюционных отношений.
16. Глико́лиз (фосфотриозный путь, или шунт Эмбдена — Мейерхофа) - ферментативный процесс последовательного расщепления глюкозы в клетках, сопровождающийся синтезом АТФ. Гликолиз при аэробных условиях ведёт к образованию пировиноградной кислоты (пирувата), гликолиз в анаэробных условиях ведёт к образованию молочной кислоты (лактата). Гликолиз является основным путём катаболизма глюкозы в организме животных.
17. Путь Энтнера-Дудорова, или КДФГ-путь (назван по характерному образующемуся продукту - 2-кето-3-дезокси-6-фосфоглюконату), — сравнительно редкий тип метаболизма, наблюдаемый у ряда бактерий (Pseudomonas aeruginosa, Alcaligenes eutrophus); у высших организмов он отсутствует (рис. 4-10). Этот путь - основной для расщепления гексоз у бактерий с дефицитом фосфофруктокиназы {например, у бактерий рода Pseudomonas). В результате расшепления 2-кето-3-дезокси-6-фосфоглюконовой кислоты образуются 3-фосфоглицериновый альдегид и пируват. Бактерии, расщепляющие глюкоз) подобным образом, лишены ферментов, катализирующих образование молочной, муравьиной и прочих органических кислот.
 18. Аммонификация
18. Аммонификация (от аммоний и лат. facio - делаю), процесс разложения содержащих азот органических веществ с выделением аммиака. А. имеет большое значение в круговороте азота в природе и питании растений. В процессе А. трудно-усвояемый азот органических соединений почвы (гумуса, органических удобрений, растительных остатков, отмерших тел животных и микроорганизмов) переходит в доступную для растений форму. А. белков осуществляется широко распространёнными в почве гнилостными бактериями, а также некоторыми актиномицетами и грибами. Выделяющийся при А. аммиак частично используется самими микроорганизмами, а большая часть его нейтрализуется в почве органическими и неорганическими кислотами с образованием аммонийных солей. Остатки молодых растений аммонифицируются быстрее, чем старых, одревесневших. А. происходит как при свободном доступе воздуха, так и при его недостатке; в анаэробных условиях А. приводит к образованию вредных для растений восстановленных промежуточных продуктов.
19. Протеолитические ферменты,
протеазы, пептид - гидролазы, ферменты класса гидролаз;содержатся во всех живых организмах; катализируют гидролиз пептидных связей в клеточных белках и белках пищи. П. ф. делят на пептидазы (экзопептидазы) и протеиназы (эндопептидазы). Пептидазы гидролизуют преимущественно внешние пептидпые связи в белках и пептидах, протеиназы - внутренние. В зависимости от особенностей строения активного центра П. ф. подразделяют на сериновые, тиоловые (цистеиновые), кислые протеиназы и металлоферменты, содержащие в активном центре атом металла (чаще Zn). К металлоферментам относится большинство известных пептидаз. Протеиназы различают также по субстратной специфичности, т. е. способности гидролизовать связи между определёнными аминокислотными остатками. Установлена последовательность аминокислот в молекулах ряда П. ф., а с помощью рентгеноструктурного алализа - и полная пространственная структура нескольких важнейших протеиназ - пепсина, трипсина, химотрипсина. П. ф. поджелудочной железы синтезируются в форме неактивных предшественников - проферментов и поэтому не разрушают белков ткани, в которой образовались. Препараты П. ф. применяют в лабораториях (для установления строения белков и пептидов), в пищевой (например, для мягчения мяса, в сыроварении) и лёгкой (удаление шерсти со шкур и мягчение кож) промышленности, в медицине (для рассасывания тромбов, удаления катаракт и др.).
20. Хемота́ксис - двигательная реакция микроорганизмов на химический раздражитель.
21. Энтероциты - эпителиальные клетки тонкого кишечника. Поверхность энтероцитов, обращенная в просвет кишечника, значительно увеличена за счет пальцевидных выростов (микроворсинок). Микроворсинки покрыты гликокаликсом , состоящим из сети мукополисахаридов, внутри которой располагаются ферменты энтероцитов. У основания слоя гликокаликса располагаются также ферменты, связанные с мембраной энтероцитов, которые высвобождаются только при разрушении мембраны эпителиальной клетки. Адсорбированные ферменты гидролитически расщепляют макромолекулярные вещества до олигомеров, а ферменты, связанные с мембраной - до мономеров. В мембране энтероцитов в непосредственной близости от связанных ферментов встроены системы активного транспорта , отвечающие за всасывание.
22. Гексокина́за (АТФ-зависимая D-гексоза-6-фосфотрансфераза) (К. Ф. 2.7.1.1) - цитоплазматический фермент класса трансфераз, подкласса фосфотрансфераз, первый фермент пути гликолиза.
Гексокиназа производит фосфорилирование шестиуглеродных сахаров (гексоз) с использованием энергии АТФ:
D-гексоза + АТФ → D-гексозо-6-фосфат + АДФ.
Субстратом фосфорилирования могут быть такие гексозы как D-глюкоза, D-манноза, D-фруктоза, сорбитол и D-гликозамин.
Наибольшее значение имеет реакция фосфорилирования D-глюкозы, реакция соответственно имеет вид:
D-глюкоза + АТФ → D-глюкозо-6-фосфат + АДФ.
Гексокиназа найдена у бактерий, растений и у всех животных, включая человека. У млекопитающих известно четыре изофермента, или изотипа, гексокиназы (I-IV). IV тип также называется глюкокиназой. Этот изотип гексокиназы встречается преимущественно в гепатоцитах.
На активность гексокиназы в клетках животных действуют ряд факторов. Гексокиназы I-III ингибируются продуктом реакции глюкозо-6-фосфатом. Инсулин, адреналин, тиреоидные гормоны повышают гексокиназную активность в клетках, в то время как глюкокортикоиды, соматотропин её снижают.
23. Еще одно название неспецифического иммунитета: "конституционный". Назван он так потому, что создается анатомическими, физиологическими, клеточными и молекулярными факторами, которые являются естественными составляющими организма, то есть его конституцией. Эти факторы не возникают в организме заново при встрече с патогеном, то есть они не индуцируются.
24. Комплементом называют сложный комплекс белков, действующий совместно для удаления внеклеточных форм патогена; система активируется спонтанно определенными патогенами или комплексом антиген:антитело. Активированные белки либо непосредственно разрушают патоген (киллерное действие), либо обеспечивают лучшее их поглощение фагоцитами (опсонизирующее действие ); либо выполняют функцию хемотаксических факторов, привлекая в зону проникновения патогена клетки воспаления.
Комплекс белков комплемента формирует каскадные системы, обнаруженные в плазме крови. Для этих систем характерно формирование быстрого, многократно усиленного ответа на первичный сигнал за счет каскадного процесса. В этом случае продукт одной реакции служит катализатором последующей, что в конечном итоге приводит к лизису клетки или микроорганизма.
Существует два главных пути (механизма) активации комплемента - классический и альтернативный.
Классический путь активации комплемента инициируется взаимодействием компонента комплемента С1q с иммунными комплексами (антителами, связанными с поверхностными антигенами бактериальной клетки); в результате последующего развития каскада реакций образуются белки с цитолитической (киллерной) активностью, опсонины, хемоаттрактанты. Такой механизм соединяет приобретенный иммунитет (антитела) с врожденным иммунитетом (комплемент).
Альтернативный путь активации комплемента инициируется взаимодействием компонента комплемента С3b с поверхностью бактериальной клетки; активация происходит без участия антител. Данный путь активации комплемента относится к факторам врожденного иммунитета.
В целом система комплемента относится к основным системам врожденного иммунитета , функция которых состоит в том, чтобы отличить "свое" от "не своего". Эта дифференциация в системе комплемента осуществляется благодаря присутствию на собственных клетках организма регуляторных молекул, подавляющих активацию комплемента.
25. Пропердин, или фактор P, - глобулярный белок, обнаруженный в сыворотке крови высших животных. Представляет собой несколько растворённых в кровотоке проферментов, относящихся к системе комплемента, которая обеспечивает врождённый иммунитет.
26. Интерфероны - общее название, под которым в настоящее время объединяют ряд белков со сходными свойствами, выделяемые клетками организма в ответ на вторжение вируса. Благодаря интерферонам клетки становятся невосприимчивыми по отношению к вирусу.
27. Лимфокин (lymphokin) - Лимфокины – биологически активные вещества, гликопротеины с молекулярной массой 10-200 кД, синтезируемые и выделяемые лимфоцитами под действием антигена или неспецифического активатора (лектин и т.п.); обеспечивают кооперацию, координацию и регуляцию функций, обеспечивающих иммунный ответ клеток. К лимфокинам относятся интерфероны, интерлейкины, лимфотоксины, факторы некроза опухолей и др.
28. Онтогене́з (от греч. οντογένεση: ον - бытие и γέννηση - происхождение, рождение) - индивидуальное развитие организма от оплодотворения до смерти.
У многоклеточных животных в составе онтогенеза принято различать фазы эмбрионального (под покровом яйцевых оболочек) и постэмбрионального (за пределами яйца) развития, а у живородящих животных пренатальный (до рождения) и постнатальный (после рождения) онтогенез.
У многоклеточных растений к эмбриональному развитию относят процессы, происходящие в зародышевом мешке семенных растений.
Термин «онтогенез» впервые был введен Э. Геккелем в 1866 году. В ходе онтогенеза происходит процесс реализации генетической информации, полученной от родителей.
29. Пепсиноге́н - профермент, зимоген пепсина. Молекулярная масса пепсиногена около 40400.
Пепсиноген - функционально неактивная проформа пепсина, отличающаяся от пепсина наличием 44 дополнительных аминокислот.
Пепсиноген продуцируется главными клетками фундальных желёз желудка и активируется соляной кислотой, которую выделяют париетальные клетки желудка. Уровень секреции пепсиногенов в просвет желудка определяется массой главных клеток желудка и контролируется гормоном гастрином. Главные клетки слизистой оболочки желудка также являются своеобразным хранилищем, где пепсиногены накапливаются до начала процесса пищеварения.








