На правах рукописи
ИВАНОВА АНЖЕЛА БОРИСОВНА
ФАРМАКОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА
ПРОБИОТИКОВ НА ОСНОВЕ BACILLUS SUBTILIS И ЭФФЕКТИВНОСТЬ ИХ ПРИМЕНЕНИЯ
В ПТИЦЕВОДСТВЕ
16.00.04 – ветеринарная фармакология с токсикологией
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора ветеринарных наук
Санкт-Петербург – 2008
Работа выполнена на кафедре фармакологии и общей патологии Института ветеринарной медицины ФГОУ ВПО «Новосибирский государственный аграрный университет»
Научный консультант - доктор ветеринарных наук,
профессор Ноздрин
Григорий Антонович
Официальные оппоненты: доктор ветеринарных наук
Соколова Лидия Николаевна
доктор ветеринарных наук,
профессор Преображенский
Сергей Николаевич
доктор биологических наук,
профессор Великанов
Валериан Иванович
Ведущая организация: ФГОУ ВПО «Алтайский государственный аграрный университет»
Защита состоится ____________ 2008 г. в _ часов на заседании диссертационного совета Д 220.059.03 при ФГОУ ВПО «Санкт-Петербургская государственная академия ветеринарной медицины» по адресу: 196084, Санкт-Петербург, Черниговская, 5.
С диссертацией можно ознакомиться в библиотеке ФГОУ ВПО «Санкт-Петербургская государственная академия ветеринарной медицины»
Автореферат разослан ________________ 2008 г.
Ученый секретарь
диссертационного совета
доктор биологических наук Л.М. Белова
1. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Перевод птицеводства на промышленные технологии содержания и кормления, ограничение контактов птицы с почвой, растениями и другими естественными факторами, а также широкая химизация отрасли и нерациональное применение антимикробных средств способствуют нарушению микробных экологических систем в пищеварительном тракте и возникновению дисбактериозов (Панин А.Н. и др., 2000).
Основной проблемой последних лет является увеличение числа резистентных к антибиотикам возбудителей инфекций и снижение эффективности ряда антибиотиков. Распространение бактерий, устойчивых к антибиотикам, влечет за собой массовую аллергизацию больных и развитие дисбактериозов, частота которых быстро растет (Сидоров И.В., 1976; Соколов В.Д., Андреева Н.Л., 1996; Хаитов Р.М., Пинегин Б.В., 1997, 2000; Митрохин С.Д., 2004; Панин А.Н., Малик Н.И., 2007).
В последние годы появились новые подходы к лечению дисбактериозов, связанные с восстановлением естественной экологии организма, основанные на использовании активных биологических продуктов. Одним из аспектов такого подхода является нормализация измененного микробного пейзажа организма при помощи бактерийных препаратов (Мирошник О.А., 1997; Бондаренко В.М. и др., 1998; Янковский Д.С. и др., 2004; Тараканов Б.В., 2007; Герасименко В.В., 2008;). Важным арсеналом препаратов этой группы являются пробиотики.
Основой пробиотиков служат либо микроорганизмы, представляющие нормальную микрофлору, либо не характерные для нормофлоры сапрофиты, способные вытеснять патогенные микроорганизмы из просвета кишечника. Пробиотические штаммы микроорганизмов являются неадгезивными транзиторными представителями микрофлоры кишечника. Пробиотики обладают высокой ферментативной активностью, регулируют и стимулируют пищеварение, а также оказывают противоаллергенное, антитоксическое действие и повышают неспецифическую резистентность макроорганизма (Oggioni M.R. et al., 2003; Ouwehand A.C. et al., 2003; Лебедева И.А., 2007; Ноздрин Г.А., Соколов В.Д., Андреева Н.Л. и др., 2008). Антагонизм в отношении широкого круга патогенных и условно-патогенных микроорганизмов и самостоятельная элиминация из желудочно-кишечного тракта делают конструирование лечебно-профилактических препаратов из пробиотических бацилл особенно перспективным (Сорокулова И.Б., 1998; Калмыкова А.И., 2001, 2006; Лебедева И.А., 2007).
В последнее время успешно применяют пробиотики на основе Bac. subtilis для коррекции микробиценоза, стимуляции интенсивности роста и увеличения продуктивности цыплят-бройлеров, поскольку их действие адекватно сложившимся в процессе эволюции механизмам защиты макроорганизма от патогенных воздействий внешней среды (Смирнов В.В., 1997; Шевченко А.И., 2003; Иванова А.Б., 2007; Ноздрин Г.А., Ноздрин А. Г., 2007; Ноздрин Г.А. и др., 2008).
Таким образом, разработка, изучение и использование на птице различных кроссов пробиотических препаратов на основе спорообразующих микроорганизмов рода Bac. subtilis является актуальной задачей, что и определило направление наших исследований.
Цель исследований. Целью данной работы являлось исследование фармакотоксикологического действия новых пробиотических препаратов и выявление закономерностей в их воздействии на физиолого-биохимический статус организма, продуктивность и качество продукции у кур различных кроссов.
Задачи исследований:
1. Определить острую, хроническую токсичность и эмбриотоксическое действие ветома 3.
2. Определить оптимальные дозы и схемы применения ветома 3; 3.1. и ветоцила и их эффективность в сравнении с бифитрилаком и наринэ.
3. Выявить закономерности в действии пробиотиков на морфобиохимические показатели крови и состояние неспецифической резистентности организма кур мясного и яичного направления.
4. Определить закономерности и особенности действия пробиотиков на количественный и качественный состав микрофлоры кишечника у птицы разных кроссов.
5. Выяснить закономерности в действии пробиотиков в зависимости от кратности и продолжительности их применения на продуктивность, яйценоскость, качество продукции и сохранность птицы.
6. Провести производственную апробацию пробиотических препаратов ветома 3 и ветоцила.
Научная новизна и теоретическая значимость. Впервые изучены новые пробиотические препараты на основе Bac. subtilis ветом 3 и ветоцил и определены токсикологические свойства ветома 3 на лабораторных животных. Установлено, что препарат относится к группе малотоксичных и не обладает нефротоксическим, гепатотоксическим, нейротоксическим, аллергенным и эмбриотоксическим действием. Впервые экспериментально и в условиях промышленного производства определены фармакологические свойства и установлены особенности и закономерности в действии изучаемых пробиотиков на цыплятах-бройлерах 4 кроссов (ИСА, Бройлер, GV и Смена) и курах яичного направления 3 кроссов (Ломанн, Шавер, Родонит). Проведена сравнительная комплексная оценка влияния различных схем применения пробиотиков на основе Bac. subtilis (ветома 3, ветоцила), бифитрилака и наринэ в разные физиологические периоды жизни птицы различных кроссов на морфологические, биохимические и иммунологические показатели крови, микробиоценоз и продуктивность.
На основании результатов исследований дано новое определение пробиотиков (свидетельство №73200800044 от 28.05.2008 г. ФГУП «ВНИЦ») и разработана классификация по направленности действия (свидетельство №73200800043 от 28.05.2008 г. ФГУП «ВНИЦ»). По результатам собственных исследований и на основании анализа литературных источников разработана научная концепция применения пробиотиков в промышленном птицеводстве, предусматривающая регламентированное использование пробиотиков с учетом физиологических особенностей организма и критических периодов жизни птицы, для получения экологически чистой и высококачественной продукции. Разработана научная основа оптимизации микробиоценозов желудочно-кишечного тракта и среды обитания птицы. Результаты исследований позволяют дополнить и систематизировать научную теорию превентивного применения пробиотиков в птицеводстве.
Практическая значимость и внедрение результатов исследований. Результаты производственных исследований свидетельствуют о перспективах широкого практического использования пробиотиков на основе Bac. subtilis в птицеводстве для повышения продуктивности, сохранности птицы и качества получаемой продукции. В условиях промышленного производства доказана возможность замены антибиотиков пробиотиками. На основании результатов исследований подготовлены и утверждены на заседании подсекции «Инфекционная патология животных в регионе Сибири и Дальнего Востока» отделения ветеринарной медицины Россельхозакадемии (протокол №2 от 27.02.04 г.) рекомендации «Оптимизация микробиоценозов среды обитания животных путем направленного изменения микробных экосистем с использованием пробиотиков». В условиях производства на большом количестве птицы апробирована научная концепция применения ветома 3 и ветоцила.
Апробация работы. Материалы диссертационной работы доложены на заседаниях ученого совета ИВМ НГАУ (1999-2008), международных, региональных научно-практических конференциях «Актуальные вопросы ветеринарии» (Новосибирск, 1999-2008); «Селекция, ветеринарная генетика и экология» (Новосибирск, 2001, 2003); Сибирском международном ветеринарном конгрессе (Новосибирск, 2005); конференциях «Современные тенденции развития аграрной науки в России» (Новосибирск, 2006); «Новые фармакологические средства в ветеринарии» (Санкт-Петербург, 2005, 2006, 2007); конгрессе «Пробиотики, пребиотики, синбиотики и функциональные продукты питания. Фундаментальные и клинические аспекты» (Санкт-Петербург, 2007); «Научное обеспечение АПК Сибири, Монголии и Казахстана» (Улан-Батор, 2007); на конференции фармакологов РФ «Фармакологические и экотоксикологические аспекты ветеринарной медицины» (Троицк, 2007); на I Международном конгрессе ветеринарных фармакологов «Эффективные и безопасные лекарственные средства» (Санкт-Петербург, 2008).
Публикации результатов исследований. По материалам диссертации опубликовано 44 научные работы, в том числе 8 статей в ведущих научных изданиях, рекомендованных ВАК Минобразования РФ («Сибирский вестник сельскохозяйственной науки», «Вестник КрасГАУ»), издана монография «Научные основы применения пробиотиков в птицеводстве».
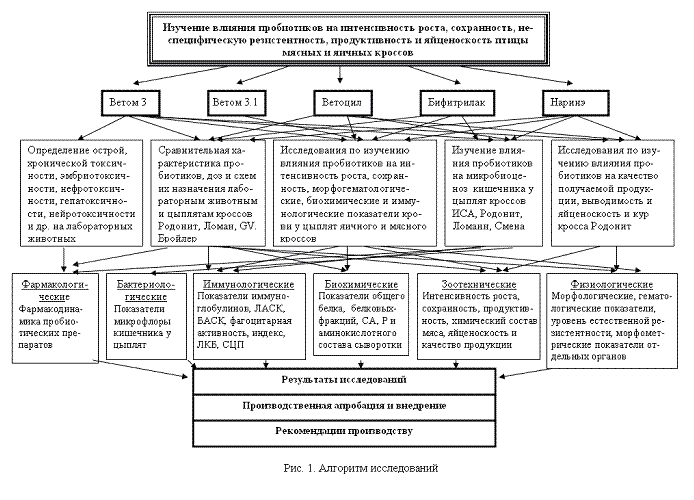
Объем и структура диссертации. Диссертация представляет собой рукопись компьютерного набора, состоит из разделов: введения, обзора литературы, материала и методов исследований, результатов исследования и их обсуждения, заключения, выводов, предложений производству, приложений и списка использованной литературы, содержащего 454 источника, в том числе 94 иностранных. Работа изложена на 323 страницах машинописи, иллюстрирована 91 таблицей и 29 рисунками.
Основные положения, выносимые на защиту:
1. Фармакотоксикологическая оценка пробиотиков на основе Bac. subtilis.
2. Пробиотические препараты оказывают стимулирующее действие на лейко- и эритропоэз, показатели неспецифической резистентности организма птицы. Интенсивность роста и качество мяса цыплят-бройлеров повышаются.
3. Пробиотики оптимизируют микробиоценоз кишечника. Количество индигенной микрофлоры в кишечнике увеличивается у птицы разных кроссов с определенной закономерностью.
4. Яйценоскость кур, качественные показатели яиц и выводимость цыплят при применении пробиотиков повышаются.
2.1. Материал и методы исследований
Экспериментально-клинические исследования по изучению пробиотических препаратов ветома 3; 3.1, ветоцила, наринэ, бифитрилака проводили с 1999 по 2008 г. на кафедре фармакологии и общей патологии НГАУ, ЗАО Агрофирма «Лебедевская» и ЗАО птицефабрика «Октябрьская» Новосибирской области в соответствии с открытой инициативной тематикой научно-исследовательских работ, регистрационный номер темы 01.200.1 13903. Исследования проводили на 126 белых мышах и 48 лабораторных крысах, на 1049 цыплятах кроссов ИСА, Бройлер, GV, Смена, Ломанн и Шавер и 47632 курах кросса Родонит (рис. 1). Всего было изучено на лабораторных животных 3 препарата, 12 доз и 5 схем их применения и в условиях производства 4 препарата, 5 доз и 11 схем. Лабораторных животных содержали в виварии кафедры и кормили согласно нормам рационов для лабораторных животных (Батрак Г.Е., Кудрин А.М., 1979). В экспериментах использовали здоровых животных, подобранных по принципу аналогов.
Острую и хроническую токсичность определяли на лабораторных белых мышах и крысах в соответствии с требованиями к доклиническому изучению общетоксического действия новых фармакологических веществ. Степень токсичности определяли по проценту гибели, общему состоянию, поведенческой активности (гипоактивность), снижению мышечного тонуса (гипотонус), наличию неврологического дефицита (нарушение координации движения, тремор, судороги) и выраженности ушного, корнеального и рефлекса Штраубе. При изучении токсичности также определяли эмбриотоксическое, нефротоксическое, гепатотоксическое и аллергизирующее действие ветома 3. За животными вели систематическое наблюдение, проводили клиническое обследование по общепринятой методике. Патолого-анатомическое исследование животных также проводили по общепринятой методике.
Для определения профилактической эффективности ветома 3 и 3.1, ветоцила, бифитрилака и наринэ учитывали физиологическое состояние, заболеваемость, исход заболевания и сохранность цыплят. При изучении клинико-физиологического состояния цыплят обращали внимание на общее состояние, аппетит, потребление воды, подвижность, оперение, пигментацию ног, наличие побочных нежелательных эффектов.
У подопытных животных изучали гематологические, биохимические и иммунологические показатели крови:
• гематологические: количество эритроцитов, лейкоцитов (меланжерным способом с использованием камеры Горяева), содержание гемоглобина (гемоглобин-цианидным методом); лейкограмму (по Болотникову И.А., 1980);
• биохимические: общий белок, альбумины, α, β, γ-глобулины с помощью автоматического биохимического анализатора на базе лаборатории качества кормов и продуктов животноводства (свидетельство НЦСМС № 464/2005 от 06.06.05 г.);
• иммунологические: цитохимический показатель супероксиддисмутазы полиморфноядерных нейтрофилов, количество дифенсивных белков (ЛКБ) (по Колабской Л.С. и др., 1975), фагоцитарную активность нейтрофилов (по Меньшикову В.В., 1989), фагоцитарный индекс (определяли средним числом фагоцитированных микробов, приходящихся на 1 активный лейкоцит), бактерицидную активность сыворотки крови (по Смирнову П.Н. и др., 1989), лизоцимную активность сыворотки крови
фотоэлектроколориметрическим методом (по Дорофейчику А.Г., 1968), иммуноглобулины A, M, G (по Манчини, 1987).
Для определения состава микрофлоры на 1, 20, 40-е и 1, 15, 30 и 45-е сутки опыта учитывали данные количественного и качественного состава микрофлоры кишечника цыплят (по Знаменскому В.А., 1986). Определяли индекс стабильности микрофлоры (отношение суммарного количества бифидо- и лактобактерий к количественному показателю кишечной палочки). Анатомическую разделку тушек птицы проводили в соответствии с методикой ВНИТИП (2000 г.) на 15, 30 и 45-е сутки эксперимента.
Качество тушек определяли по убойному выходу (отношение живой массы к массе полупотрошеной тушки) и индексу массивности (отношение массы полупотрошеной тушки к длине тушки от последнего шейного позвонка до кончика хвоста, см). Проводили расчет белково-качественного индекса, который является отношением аминокислот триптофана к оксипролину (по Мысик А.Т., 1985).
Для изучения влияние ветома 3 на пищевую ценность мяса определяли: белок (по Кьельдалю), жир (с использованием экстракционного аппарата Сокслета), количество влаги, золу (по ускоренному методу, основанному на применении в качестве катализатора раствора уксусно-кислого магния), аминокислоты, жирные кислоты, микроэлементы (на автоматическом биохимическом анализаторе).
При изучении продуктивности птицы учитывали в динамике абсолютную массу, показатели среднесуточного прироста живой массы и скорости роста животных, количество яиц на одну несушку в первую и вторую фазу яйцекладки. Яичная продуктивность определялась ежедневно, а качественные показатели яиц и масса (путем взвешивания средней пробы) в течение всего периода эксперимента.
Для изучения действия препарата в динамике индивидуально взвешивали цыплят в различные возрастные периоды (в 1-, 7-, 14-, 21-, 28-, 35- и 42-суточном, в 10-, 20-, 30-, 60- и 90-суточном, а также в 1-, 15-, 30-, 45-суточном возрасте).
Цифровые материалы обрабатывали с использованием программы биометрической обработки SNEDECOR V4, Microsoft Excel. Степень и достоверность различий полученных результатов определяли с помощью критериев Стьюдента, Фишера. Применяли методы дисперсионного и корреляционного анализа. Определяли связь между признаками и вычисляли степень влияния на них различных факторов (Сорокин О. Д., 2004).
2.2.1. Фармакологическая характеристика изучаемых пробиотических препаратов}
2.2. Результаты исследований
2.2.1. Фармакологическая характеристика изучаемых пробиотических препаратов
Пробиотики – это стабилизированные культуры микроорганизмов и продуктов их ферментации, обладающие свойством оптимизировать кишечные микробиоценозы, подавлять рост и развитие патогенной и условно-патогенной микрофлоры, повышать обменные процессы и защитные реакции организма, активизируя клеточный и гуморальный иммунитет (Ноздрин Г.А., Иванова А.Б. и др., 2005).
Нами также разработана классификация пробиотиков на основе Bacillus subtilis по направленности действия:
1) применяемые для функционального питания животных (велес);
2) применяемые для реабилитационной терапии и нормализации микробиоценоза после длительного применения антибиотиков (ветом 3, ветоцил);
3) применяемые для коррекции иммунитета, стимуляции роста и развития молодняка, повышения качества продукции (ветом 1.1, ветом 3);
4) применяемые для терапии при заболеваниях бактериальной и вирусной этиологии (ветом 1.1, ветомгин, зимун, биосептин).
Ветом 3; 3.1 содержит иммобилизированную высушенную споровую биомассу бактерий Bacillus subtilis штамма ВКПМВ-7048 соответственно 106, 107 и глюкозу. Ветоцил содержит иммобилизированную высушенную споровую биомассу бактерий Bacillus subtilis штамма ВКПМВ-7038 106 и природный цеолит. Препараты представляют собой порошок белого цвета, без запаха, хорошо растворимы в воде. Выпускаются в пластиковой упаковке по 500, 50 и 5 г, а также в капсулах и таблетках. Хранят в сухом месте при температуре 20°С. Срок годности 24 месяца.
Бифитрилак - комплексный препарат, представляющий собой порошок светло-серого цвета, состоящий из адсорбента и лиофилизированных штаммов бактерий Lactobacillus bulgaricus, Lactobacillus acidophilus, Lactobacillus fermentum, Bifidobacterium bifidum. В 1г препарата содержится 0,5 млрд м.к. бифидумбактерий и 1,5 млрд м.к. лактобактерий. Форма выпуска во флаконах или полиэтиленовых пакетах по 5, 500, 5000 г. Хранят в сухом темном месте при температуре 2-8 0С. Срок годности 12 месяцев.
Наринэ - порошок от светло-коричневого до белого цвета, состоящий из ацидофильной формы лактобактерина штамм Lactobacillus acidofilus n.v.Ep 317/402. Препарат выпускается в капсулах по 0,4 г. Хранится при температуре 2-4 0С. Срок годности 24 месяца.
2.2.2. Определение острой, хронической токсичности и эмбриотоксического действия ветома 3 на лабораторных животных
При изучении острой токсичности ветома 3 нами установлено, что в дозах 500, 1000, 1500, 2000, 2500 и 20000 мг/кг, превышающих терапевтическую в 10, 20, 30, 40, 50 и 400 раз, препарат не вызывал гибели животных и клинически проявляющихся изменений их физиологического состояния.
Испытуемый препарат не изменял физиологическую двигательную активность и не вызывал миорелаксации. У животных не отмечали признаков неврологического дефицита (нарушение координации движения, тремор, судорожные реакции). Препарат в изучаемых дозах не обладал гепатотоксическим, нефротоксическим и аллергизирующим действием. Ушной, корнеальный и рефлекс Штраубе регистрировали у животных опытных групп даже при увеличении дозы препарата в 400 раз. При патолого-анатомическом исследовании сердца, печени и селезенки нарушений в размере и структуре органов не отмечали.
При изучении хронической токсичности ветома 3 живая масса крыс опытной и контрольной групп за период эксперимента не имела достоверных различий, гибели животных не отмечали. Наблюдения за животными не выявили каких-либо отклонений от нормы в физиологическом состоянии и гематологических показателях.
При изучении эмбриотоксического действия на крысах ветома 3 в дозах 75, 3750 и 7500 мг/кг массы нами установлено, что на 10-й день беременности (начало интенсивного органогенеза) фетоплацентарные отношения в организме самок опытных групп не нарушались, что подтверждается массой плодов и их размерами, которые соответствовали физиологической норме и были аналогичны показателям контрольных животных. Длина и масса опытных крысят не имели достоверных различий на протяжении всего периода исследований. Как в опытных группах, так и в контроле шерстный покров у крысят появлялся на 3-5-й день, ушные раковины открывались на 4-5-й день, глаза - на 17-18-й день постэмбрионального развития.
Следовательно, ветом 3, по данным наших исследований, не обладает эмбриотоксическим действием, не оказывает токсического действия на организм лабораторных животных даже в дозе, превышающей в 400 раз терапевтическую. Не установлено его негативного влияния на морфометрические показатели внутренних органов у мышей. По классификации химических средств с учетом их токсичности ветом 3 относится к малотоксичным препаратам, IV класс токсичности.
2.2.3. Физиологические показатели роста и развития лабораторных животных в возрастном аспекте
и под влиянием различных пробиотиков, доз и схем их применения
Морфометрические показатели развития органов у мышей. При изучении ветома 3, ветоцила в дозе 75 мг/кг массы и наринэ в дозе 100 мг/кг кратностью 2 раза в сутки циклами по 3 суток с 3 дневным перерывом и через сутки в течение месяца отмечали изменение массы внутренних органов у лабораторных животных. Абсолютная масса паренхиматозных органов у мышей опытных групп изменялась с определенной закономерностью. На 10-е сутки исследований относительно аналогов из контроля увеличивалась масса селезенки, сердца, левой и правой почек у животных 1-4 и 6-й опытных групп соответственно от 0,8 до 20,9 (Р<0,1); от 1,59 до 12,9(Р<0,05) и от 2,9 до 30,6%; печени, только у мышей 2-й и 4-й опытных групп на 15,9 и 12,9%. В 17-суточном возрасте масса сердца была ниже у мышей всех опытных групп от 0,4 до 18,2%, а масса селезенки, левой и правой почек была выше только у мышей 1-й и 5-й опытных групп соответственно на 1,3 и 7,9; 14,0 и 4,3; и 31,6 и 19,5%; масса печени была выше у животных 5-й опытной группы на 0,6%. В 24-суточном возрасте масса селезенки, сердца и печени была выше у мышей 1-й и 5-й опытных групп соответственно от 1,0-8,0; 2,9-6,8 и 1,4-10,3%; масса левой и правой почек от 0,8 до 24,3%. В 31-суточном возрасте масса селезенки и печени была выше у мышей 1-6-й опытных групп от 0,45 до 28,9 и от 9,4 до 22,9%; сердца у мышей 1-й и 5-й опытных групп на 2,7 и 5,9%, левой и правой почек во 2, 3 и 5-й опытных группах от 0,6 до 10,5%.
Таким образом, изменение массы изучаемых органов зависило от схемы введения препаратов. При назначении изучаемых препаратов 2 раза в день через сутки отмечали более интенсивное увеличение паренхиматозных органов на 10-е сутки опыта. На 17, 24 и 31-е сутки опыта более выраженные изменения массы сердца, селезенки, печени и почек отмечали у животных опытных групп, которым ветом 3, ветоцил и наринэ назначали циклами. Масса внутренних органов в большей степени увеличивалась при применении ветома 3 и наринэ и в меньшей степени под влиянием ветоцила.
Морфометрические показатели роста и развития цыплят кросса Родонит. У цыплят опытных групп, получавших препараты ветом 3, ветоцил в дозе 50, 75 и 100 мг/кг массы и наринэ в дозе 100 мг/кг кратностью 2 раза в сутки циклами по 3 суток с 3- и 7-дневным перерывом и через сутки в течение месяца, среднесуточный прирост живой массы и относительная скорость роста были выше в 5-суточном возрасте у цыплят 8-й опытной группы соответственно на 10,3 и 9,1% (Р<0,05), а у цыплят других опытных групп на уровне и ниже аналогов из контроля; в 15-суточном возрасте у птицы 1, 3, 5, 7 и 10-й опытных групп от 3,6 до 32,0 и от 6,0 до 29,8%; в 30-суточном возрасте у цыплят 2, 4, 8, и 9-й опытных групп от 1,25 до 5,0 и от 1,6 до 7,0% соответственно. Аналогичные данные регистрировали и при изучении показателей абсолютной массы цыплят.
Изменение массы внутренних органов у цыплят опытных групп зависело от их возраста, применяемого препарата, схемы его назначения и дозы. В 5-суточном возрасте у опытных цыплят отмечали увеличение массы всех изучаемых органов за исключением тимуса и селезенки при применении ветома 3 и ветоцила в дозе 75 мг/кг массы циклами по 3 дня с 3-дневным интервалом в течение месяца. В 15- и 30-суточном возрасте у цыплят 1-й и 8-й опытных групп, получавших ветом 3 и ветоцил циклами в дозе 75 мг/кг массы, также отмечали увеличение массы тимуса, селезенки, бурсы, печени, слепых отростков и мышечного желудка.
Менее выраженные изменения массы внутрених органов отмечали при применении ветома 3 в дозе 50 и 75 мг/кг циклами по 3 дня с 7 суточным перерывом, ветоцила в дозе 100 мг/кг массы.
Таким образом, более интенсивное физиологическое развитие изучаемых органов происходит при применении ветома 3 и ветоцила циклами по 3 дня с 3-х дневным перерывом.
Гематологические показатели у цыплят кросса Родонит. У цыплят опытных групп в 5-суточном возрасте содержание эритроцитов и гемоглобина в крови повышалось в пределах физиологической нормы, лейкоцитов только у птицы 1-й и 6-й опытных групп на 5,5 и 2,7% (Р<0,05). В 15-суточном возрасте у цыплят опытных групп регистрировали увеличение лейкоцитов в пределах физиологической нормы от 1,8 до 17,7%, повышение количества эритроцитов у цыплят 5, 6 и 8-й опытных групп соответственно на 13,3; 3,1 и 4,0% (Р<0,05), уменьшение гемоглобина у животных всех опытных групп. В 30-суточном возрасте количество лейкоцитов в крови цыплят 2, 7 и 10-й опытных групп было выше соответственно на 6,3; 2,9 и 5,7%, количество эритроцитов в 1-5, 7-10-й опытных группах выше от 5,6 до 20,0%, гемоглобина у всех опытных групп выше от 5,0 до 21,6%.
Таким образом, изучаемые пробиотические препараты активизируют лейко- и эритропоэз у подопытных цыплят. Более выраженные изменения гематологических показателей отмечали при применении ветома 3 и наринэ циклами по 3 суток с 3-дневным перерывом в течение месяца.
2.2.4. Оценка влияния ветома 3; 3.1 и ветоцила на морфологические, гематологические,
биохимические, иммунологические показатели и интенсивность роста цыплят-бройлеров кроссов ИСА, Бройлер, GV, Смена
Морфобиохимические показатели крови у цыплят-бройлеров. У цыплят 1-й и 2-й опытных групп кросса ИСА, получавших ветом 3 в дозе 75 мг/кг массы 2 и 1 раз в сутки, через сутки в течение месяца, на 20-е сутки исследований отмечали повышение содержания лимфоцитов на 0,5% (Р<0,05) и псевдоэозинофилов на 3,4 (Р<0,1) и 2,8% (Р<0,05); количество эозинофилов было ниже на 8,8 (Р<0,1) и 5,9% (Р<0,05); содержание моноцитов и базофилов - на уровне показателей аналогов из контроля. На 40-е сутки исследований увеличивалось в крови содержание лимфоцитов на 0,6 и 0,2%, содержание эозинофилов снижалось на 9,1 и 3,0% (Р<0,05). В периферической крови у цыплят 1-й и 2-й опытных групп в 40-суточном возрасте в пределах физиологической нормы увеличивалось количество эритроцитов на 12,5 и 4,8%, лейкоцитов на 2,3 и 1,0% и содержание гемоглобина на 2,3% только у цыплят 1-й опытной группы. Характер и выраженность изменений в большей степени зависели от кратности применения препарата и в меньшей - от индивидуальных особенностей организма цыплят.
У цыплят 1-4-й опытных групп кросса Бройлер при применении ветома 3 в дозе 75 мг/кг массы кратностью 3 раза в сутки с использованием различных схем в 20-суточном возрасте отмечали достоверное увеличение количества лимфоцитов от 0,7 до 1,4% и снижение эозинофилов у цыплят 2-4 опытных групп от 16,7 до 27,8% (Р<0,05).
На 40-е сутки исследований в крови у цыплят 2-4-й опытных групп количество лимфоцитов было выше на 0,9; 1,8 (P<0,01); 1,2% (Р<0,1) по сравнению с контрольной группой. Количественное содержание псевдоэозинофилов у цыплят 2-й опытной группы было на уровне, а в 1, 3 и 4-й ниже аналогов из контроля соответственно на 2,0; 0,8; 1,6% (P<0,01); содержание эозинофилов снижалось в пределах физиологической нормы у цыплят 2-4-й опытных групп на 16,7 (P<0,05); 27,8 (Р<0,1); 16,7% (P<0,05), а в 1-й опытной группе этот показатель был выше цыплят-аналогов из контроля. Содержание моноцитов в крови у цыплят 1-й и 4-й опытных групп было на уровне с контролем, а у цыплят 2-й и 3-й опытной группы выше соответственно на 1,6 и 3,2% (Р<0,1).
Характер изменений морфологических показателей периферической крови в большей степени зависел от схемы и продолжительности введения препарата и в меньшей от индивидуальных особенностей организма цыплят.
В 40-суточном возрасте у цыплят 1-й и 2-й опытных групп кросса GV, получавших ветом 3 и ветом 3.1 в дозе 75 мг/кг 2 раза в сутки циклами по 3 дня с 3-дневным перерывом, относительно аналогов из контроля в крови отмечали увеличение количества псевдоэозинофилов соответственно на 4,1 и 11,9%; моноцитов только у цыплят 2-й опытной группы на 16,7%, лимфоцитов у цыплят 1-й опытной группы на 1,7%. У цыплят 1-й и 2-й опытных групп количество эозинофилов было ниже на 56,2 и 28,1%, базофилов на одном уровне с цыплятами из контрольной группы. В крови у цыплят 1-й и 2-й опытных групп повышалось количество эритроцитов и гемоглобина по сравнению с контрольной группой соответственно на 15,6 (Р<0,1) и 18,8 (Р<0,05); 1,9 и 3,8%; лейкоцитов только у птицы 2-й опытной группы на 11,5%.
У цыплят опытной группы кросса Смена, получавших ветом 3 в дозе 75 мг/кг живой массы по схеме 2 раза в сутки через сутки в течение 45 дней, в 15-суточном возрасте количество базофилов было выше на 13,3%, псевдоэозинофилов на 0,6, лимфоцитов на 0,5 и моноцитов на 1,0%; эритроцитов, гемоглобина и лейкоцитов в крови соответственно на 8,0; 4,8 (Р<0,01) и 0,3%; эозинофилов было меньше на 2,5%, относительно показателей аналогов из контроля.
В 30-суточном возрасте у цыплят опытной группы отмечали увеличение количества базофилов, лимфоцитов, моноцитов соответственно на 6,4; 0,3 и 12,5% (Р<0,05); эритроцитов, лейкоцитов и гемоглобина на 0,9; 11,3 и 6,1% (Р<0,01); количество эозинофилов и псевдоэозинофилов было ниже на 5,3 и 3,4% (Р<0,05) относительно цыплят-аналогов из контроля.
В 45-суточном возрасте у цыплят опытной группы количество базофилов, псевдоэозинофилов, лимфоцитов, моноцитов было выше на 5,5; 1,2; 0,45 и 20,7% (Р<0,05); эритроцитов и гемоглобина на 4,9 и 6,8% (Р<0,01) соответственно, а эозинофилов и лейкоцитов ниже на 2,6 и 0,4% относительно цыплят-аналогов из контроля.
Полученные нами данные могут свидетельствовать о стимуляции пробиотиками клеточных факторов иммунитета и окислительно-восстановительных процессов в организме у цыплят в пределах верхних границ физиологической нормы. В крови цыплят опытных групп кроссов Смена, ИСА, Бройлер и GV увеличивалось содержание псевдоэозинофилов, лимфоцитов, моноцитов, эритроцитов и гемоглобина. Эти изменения были более выражены в период назначения препарата, в период последействия происходят менее выраженные изменения позитивного характера в организме цыплят опытных групп. Динамика возрастных изменений соответствовала физиологическим нормам для цыплят-бройлеров.
Иммунологические показатели крови у цыплят-бройлеров кроссов ИСА, Смена. У цыплят 1-й и 2-й опытных групп кросса ИСА в 40-суточном возрасте активность лизоцима сыворотки крови была выше соответственно на 31,5 и 43,9% (Р<0,001), бактерицидная активность на 3,8 (Р<0,001) и 1,9% (Р<0,05) по сравнению с аналогами из контрольной группы (табл. 1).
Таблица 1 – Показатели неспецифической резистентности организма
у подопытных цыплят бройлеров кросса ИСА
|
Показатели |
Группа |
||
|
контрольная |
1-я опытная |
2-я опытная |
|
|
М±m |
М±m |
М±m |
|
|
ЛАСК, % |
5,58±0,08 |
7,34±0,09*** |
8,03±0,08*** |
|
БАСК, % |
94,80±0,69 |
98,40±0,67*** |
96,60±0,63* |
|
Содержание ЛКБ, ед. |
1,55±0,40 |
1,63±0,20* |
1,65±0,03# |
|
Общий белок, г/л |
55,80±0,08 |
40,20±0,07*** |
36,10±0,06# |
|
СЦП, ед. |
1,04±0,09 |
1,17±0,13 |
1,24±0,07 |
|
Фагоцитарный индекс |
5,10±0,30 |
5,30±0,32 |
5,40±0,32 |
|
Фагоцитарная активность, % |
42,60±0,69 |
43,20±0,65 |
45,20±0,67 |
# достоверно при Р<0,1; * Р<0,05; ** Р<0,01; *** P<0,001.
Примечание:*СЦП – средний цитохимический показатель супероксид - дисмутазы полиморфоядерных нейтрофилов.
Применение ветома 3 способствовало повышению активности лизосомально-катионных белков (цитохимический коэффициент) гранулоцитов крови цыплят 1-й и 2-й опытных групп относительно аналогов из контроля на 5,2 (Р<0,05) и 6,4% (Р<0,1), среднего цитохимического показателя супероксиддисмутазы полиморфноядерных нейтрофилов на 12,5 и 19,2% (Р≥0,1), фагоцитарного индекса на 3,9 и 5,9% (Р≥0,1), фагоцитарной активности крови на 1,4 и 6,1% (Р≥0,1) соответственно (см. табл.1).
Количество общего белка у опытных цыплят было ниже аналогов из контроля.
У цыплят кросса Смена содержание общего белка α-, γ-глобулинов и лизоцимная активность сыворотки крови повышались до 30-суточного возраста, затем происходило постепенное снижение этих показателей, и в 45-суточном возрасте отмечали незначительное повышение общего белка и снижение α-, γ-глобулинов и ЛАСК в сыворотке крови у цыплят опытной группы относительно аналогов из контроля. Альбумины и иммуноглобулины А в крови у цыплят опытной группы повышались в 15- и 45-суточном возрасте. БАСК у цыплят опытной группы была более высокой только до 15-суточного возраста с последующим снижением в 30- и 45-суточном возрасте. Увеличение содержания иммуноглобулинов G в сыворотки крови у цыплят отмечали только в 30-суточном возрасте.
Результаты наших исследований по морфологическому составу и иммунологическим показателям крови свидетельствуют о наличии определенных закономерностей в действии ветома 3. Под влиянием препарата количество лимфоцитов, моноцитов увеличивалось преимущественно в период применения препарата. Ветом 3 оказывал позитивное влияние на гуморальное звено неспецифической защиты организма цыплят. Лизосомально-катионные белки нейтрофилов включают в свой состав, в частности, такие белки как дифенсины, бактерицидный, проницаемость увеличивающий белок, протеиназы, эластазу, лактоферин, лизоцим. В результате их разнонаправленных воздействий на структуры микробных клеток и происходящие в них процессы происходит гибель патогенных микроорганизмов в естественных условиях при фагоцитозе. Максимально выраженные изменения изучаемых показателей отмечали у цыплят опытной группы в 30-суточном возрасте. В этом возрасте у цыплят в сыворотке крови повышалось в пределах физиологической нормы содержание общего белка, α-, γ-глобулинов, ЛАСК и иммуноглобулинов G. С увеличением периода назначения препарата сила его влияния постепенно снижалась.
Характер изменений изучаемых показателей зависел от кратности назначения препарата. С увеличением кратности происходили более интенсивные изменения позитивного характера в организме цыплят не только в период применения препарата, но и в период последействия.
Аминокислотный состав сыворотки крови у цыплят кросса Смена. Количество заменимых аминокислот аргинина, аланина, аспарагиновой кислоты, гистидина, глутаминовой кислоты, глицина, серина, цистина в крови цыплят опытной группы в 15-, 30- и 45-суточном возрасте было на уровне и ниже показателей аналогов из контроля, а пролина выше. Незаменимые аминокислоты в сыворотке крови у цыплят опытной группы в динамике изменялись с определенной закономерностью. В 15- и 30-суточном возрасте увеличивалось количество изолейцина на 26,0 и 4,0% (Р<0,1) и снижалось - лизина, треонина, валина, метионина, фенилаланина и лейцина от 0,3 до 10,5 и от 0,1 до 3,6% соответственно. В 45-суточном возрасте у цыплят опытной группы увеличивалось количество валина, метионина, изолейцина, лейцина и фенилаланина на 2,1; 2,0; 12,5; 10,5; 1,8% (Р<0,1) и уменьшалось лизина и треонина на 0,3 и 7,2% соответственно.
Следовательно, под влиянием ветома 3 содержание большинства заменимых и незаменимых аминокислот в сыворотке крови у опытных цыплят до 30-суточного возраста было на уровне и ниже показателей аналогов из контроля. В 45-суточном возрасте тенденция в количественном изменении заменимых аминокислот сохранялась, а количество большинства незаменимых аминокислот увеличивалось.
Интенсивность роста и сохранность цыплят-бройлеров кроссов ИСА, Бройлер, GV и Смена. Интенсивность роста птицы кросса ИСА под влиянием ветома 3 повышалась. Абсолютная масса и среднесуточный прирост у цыплят опытных групп были выше относительно аналогов из контроля в 7-, 14-, и 21-суточном возрасте от 0,8 до 3,4 и от 0,7 до 5,7% соответственно, а в 28-суточном возрасте только в 1-й опытной группе на 1,4 и 0,5%, цыплятам которой назначали ветом 3 кратностью 2 раза в сутки. Более высокую интенсивность роста регистрировали у цыплят, которые получали ветом 3 в дозе 75 мг/кг массы 2 раза в сутки.
У цыплят кросса Бройлер 2-4-й опытных групп абсолютная масса была выше относительно аналогов из контроля в 7-, 14-суточном возрасте от 3,8 до 10,3 и от 6,2 до 14,6%; в 21- и 28-суточном возрасте у цыплят 1-4-й опытных групп от 4,2 до 21,6 и от 4,3 до 13,0%; за опытный период от 2,9 до 15,4%. Среднесуточный прирост был выше у цыплят 2-4-й опытных групп в 7-, 14-, 21-суточном возрасте. Среднесуточный прирост в 28-суточном возрасте был на уровне и ниже цыплят-аналогов из контроля.
У цыплят 1-й и 2-й опытных групп кросса GV абсолютная масса была выше относительно цыплят-аналогов из контроля в 7-, 14-, 21-, 28- и 35-суточном возрасте от 1,88 до 17,54%. Среднесуточный прирост был выше в 7-суточном возрасте на 16 и 27,5%; в 14-суточном возрасте только у цыплят 1-й опытной группы на 1,2%; в 21-суточном возрасте у цыплят 2-й опытной группы на 1,2%; в 28-суточном возрасте у цыплят 1-й и 2-й опытных групп на 12,9 и 28,9%; в 35-суточном возрасте только у цыплят 1-й опытной группы на 9,3%. Относительная скорость роста цыплят, получавших ветом 3 в дозе 75 мг/кг 2 раза в сутки циклами по 3 дня с 3-дневным перерывом, была высокой только в 7-, 28- и 35-суточном возрасте.
У цыплят опытной группы кросса Смена, получавших ветом 3, абсолютная масса, среднесуточный прирост и относительная скорость роста были выше в 5-, 15- и 45-суточном возрасте соответственно на 6,1; 11,2 и 0,8%; 13,2; 13,4 и 5,6% (P<0,01); 9,3; 0,3 (P<0,01) и 5,8% (P<0,1).
Сохранность цыплят кросса ИСА в 1-й опытной группе в 7-, 14-, 21- и 28-суточном возрасте была выше относительно контроля на 1,3%, в 35- и 42-суточном на 4,2 и 3,2%, за опытный период на 2,0%, сохранность цыплят из 2-й опытной группы была в пределах показателей аналогов из контроля (рис. 2).
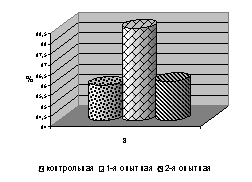
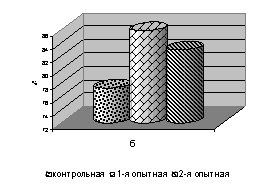
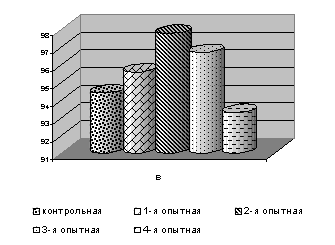
Рис. 2. Сохранность цыплят-бройлеров в завершающий период эксперимента: а – ИСА; б – GV; в – Бройлер
Сохранность цыплят кросса Бройлер за опытный период в 1-4-й опытных группах была выше по сравнению с контролем соответственно от 1,1 до 2,1%. Сохранность цыплят кросса GV была выше в 14-, 28-, 35- и 42-суточном возрасте у цыплят 1-й и 2-й опытных групп на 6,2 и 9,3; 14,3 и 17,8; по 14,8; 11,1 и 7,4%; в 21-суточном возрасте только у цыплят 2-й опытной группы на 3,1%, за опытный период сохранность цыплят 1-й и 2-й опытных групп была выше на 4,3 и 5,4%. Результаты наших исследований свидетельствуют о позитивном влиянии ветома 3 на сохранность цыплят-бройлеров (см. рис. 2).
Таким образом, ветом 3 стимулирует интенсивность роста и оказывает позитивное влияние на продуктивность и сохранность цыплят кроссов Бройлер, ИСА, GV и Смена.
В реакции организма цыплят на ветом 3 установлены определенные закономерности, проявление которых преимущественно зависело от кратности и схем применения препарата и в меньшей степени - от индивидуальных, возрастных и породных особенностей организма цыплят-бройлеров. Между кратностью применения ветома и интенсивностью роста цыплят-бройлеров просматривается прямая зависимость. Ветом 3 повышал скорость роста цыплят-бройлеров, не изменяя динамику физиологической скорости роста по возрастным периодам. Между продолжительностью введения препарата и интенсивностью роста цыплят наблюдается обратная зависимость. С увеличением продолжительности введения препарата интенсивность роста цыплят снижается. Определенное влияние на ростостимулирующее действие ветома 3 оказывали возраст цыплят и индивидуальные особенности кросса. Так, у цыплят кросса Смена максимальный прирост живой массы отмечали в 5- и 15-суточном возрасте, у цыплят кросса GV в 7- и 28-суточном, кросса ИСА в 7- и 14-суточном, а у кросса Бройлер в 7-, 14- и 21-суточном возрасте. Сила влияния ветома 3 на среднесуточный прирост цыплят-бройлеров в 7-суточном возрасте была наиболее высокой - 22,70±2,71% (Р<0,001), затем происходило постепенное ее снижение, и в 28-суточном возрасте она составляла 12,90±3,06% (Р<0,001), в 35-суточном возрасте этот показатель составил 6,83±3,27% (Р<0,05).
У цыплят опытных групп всех кроссов сохранность была более высокой на протяжении опытного периода. Препарат не оказывал негативного влияния на организм цыплят.
2.2.5. Оценка влияния ветома 3, ветоцила, бифитрилака и наринэ
на морфобиохимические показатели и продуктивность птицы яичного направления кроссов Родонит, Шавер, Ломанн
Морфологические и гематологические показатели крови у цыплят кросса Родонит. У цыплят 1-й и 2-й опытных групп кросса Родонит, получавших ветом 3 и ветоцил в дозе 75 мг/кг 2 раза в сутки циклами по 3 дня с 3 дневным перерывом в течение месяца, в 15-суточном возрасте в крови повышалось количество эритроцитов на 13,7 и 12,2% (Р<0,05), а содержание лейкоцитов и гемоглобина было ниже на 14,0 (Р<0,1) и 5,0; 7,0 и 14,9%; в 30-суточном возрасте количество эритроцитов и гемоглобина было выше на 39,4 и 32,8 (Р<0,1); 2,7 и 29,2% (Р<0,05) соответственно, а количество лейкоцитов ниже от 29,7-16%. В 15-суточном возрасте в периферической крови увеличивалось количество базофилов у цыплят 2-й опытной группы на 16,7% (Р<0,1), псевдоэозинофилов у цыплят 1-й и 2-й опытных групп на 4,0 и 3,4%, моноцитов на 7,1% (Р<0,05); содержание лимфоцитов и эозинофилов было ниже соответственно на 1,0 и 0,7; 18,7 и 37,5%. В 30-суточном возрасте количество лимфоцитов и моноцитов было выше у цыплят 1-й и 2-й опытных групп соответственно на 6,5 и 7,9 (Р<0,05); 9,7 (Р<0,1) и 22,6%, содержание псевдоэозинофилов и эозинофилов было ниже аналогов из контроля на 5,6 и 12,7; 49,1 (Р<0,05) и 37,3% (Р<0,1).
Морфологические и гематологические показатели крови у цыплят кросса Шавер. У цыплят кросса Шавер, получавших ветом 3 в дозе 75 мг/кг кратностью 1 и 2 раза в сутки циклами по 3 дня с 3-дневным перерывом в 30-суточном возрасте количество лейкоцитов и гемоглобина было в пределах физиологической нормы и выше относительно аналогов из контроля соответственно на 8,5 и 4,7; 25,5 и 22,2% (Р<0,1). Количество эритроцитов было выше только у цыплят 1-й опытной группы на 2,6% (Р<0,1). Количество лимфоцитов у цыплят 1-й и 2-й опытных групп в 30-суточном возрасте было выше на 1,7%, а содержание эозинофилов ниже на 12,5%.
Динамика гематологических показателей у цыплят опытных групп свидетельствует о позитивном влиянии изучаемых пробиотиков на лейко-, эритропоэз и окислительно-восстановительные процессы в организме птицы. Увеличение количества лимфоцитов указывает на повышение клеточных факторов иммунитета.
Биохимические показатели крови у птицы кроссов Родонит, Шавер, Ломанн. У цыплят кросса Родонит, получавших ветом 3 и ветоцил, содержание кальция и общего белка в сыворотке крови в 15-суточном возрасте было ниже, а в 30-суточном возрасте кальция и фосфора было выше, чем у аналогов из контроля, на 5,8 и 6,0; 37,7 (Р<0,05) и 36,2% (Р<0,1), общего белка у цыплят 1-й опытной группы на 23,1% (Р<0,1).
У цыплят 1-й опытной группы кросса Шавер в 15-суточном возрасте в сыворотке крови увеличивалось количество α и γ -глобулинов на 5,5 и 2,8% (Р<0,05) и уменьшалось количество общего белка и альбуминов относительно цыплят-аналогов из контроля (табл. 2) .
Таблица 2 – Биохимические показатели сыворотки крови
у цыплят кросса Шавер
|
Показатели |
Группа |
||
|
контрольная |
1-я опытная |
2-я опытная |
|
|
M±m |
M±m |
M±m |
|
|
В 15-суточном возрасте |
|||
|
Общий белок, г/л |
52,0±1,41 |
50,0±1,39* |
50,0±1,39* |
|
Альбумин,% |
33,0±0,19 |
32,0±0,22 |
33,0±0,18 |
|
α-глобулины,% |
18,0 ±0,26 |
19,0±0,26** |
18,0±0,26** |
|
β –глобулины,% |
12,0±0,18 |
12,0±0,18 |
13,0±0,21** |
|
γ –глобулины,% |
36,0±0,41 |
37,0±0,43** |
36,0±0,41** |
|
В 30-суточном возрасте |
|||
|
Общий белок, г/л |
57,0±1,10 |
58,0±1,16** |
60,0±1,39 |
|
Альбумины,% |
34,0±0,19 |
35,0±0,22 |
36,0±0,18 |
|
α –глобулины,% |
18,0±0,26 |
20,0±0,26 |
20,0±0,26 |
|
β –глобулины,% |
12,0±0,18 |
14,0±0,18 |
15,0±0,21 |
|
γ –глобулины,% |
37,0±0,43 |
38,0±0,43* |
40,0±0,41 |
*Р<0,1; **Р<0,05.
У цыплят 2-й опытной группы увеличивалось в крови только количество β-глобулинов на 8,3% (Р<0,05).
В 30-суточном возрасте в сыворотке крови у цыплят 1-й и 2-й опытных групп было выше относительно аналогов из контроля содержание общего белка на 1,75 (Р<0,05) и 5,3%, альбуминов на 2,9 и 5,9, α-, β- и γ -глобулинов соответственно на 11,1; 16,7 и 25,0; 2,7(Р<0,1) и 8,1%.
При сравнительной оценке бифитрилака, ветома 3 и ветоцила у цыплят кросса Ломанн препараты назначали в дозе 50 и 75 мг/кг массы соответственно 3 раза в сутки циклами по 5 суток с 5-дневным перерывом в течение месяца. В 15-суточном возрасте содержание общего белка, α- и β-глобулинов в сыворотке крови было ниже на 2,6; 18,3 и 10,8% у птицы, получавшей бифитрилак, а количество альбуминов и γ -глобулинов выше на 14,2 (Р<0,1) и 3,4% относительно аналогов из контроля. Цыплята, получавшие ветом 3, по содержанию общего белка и γ -глобулинов в сыворотке крови превышали показатели цыплят из контрольной группы на 4,1(Р<0,1) и 10,0%, содержание альбуминов было на уровне аналогов из контроля, а количество α- и β-глобулинов ниже на 20,3 и 12,8% соответственно. У цыплят, получавших ветоцил, количество γ -глобулинов было выше на 21,5% (Р<0,05), содержание общего белка в сыворотке крови на уровне аналогов из контроля, а количество альбуминов, α- и β-глобулинов ниже на 12,8; 7,6 и 22,3%.
В 30-суточном возрасте у цыплят 1-й и 2-й опытных групп содержание общего белка в сыворотке крови было ниже относительно аналогов из контроля на 1,9 (Р<0,01) и 0,7%, у цыплят 3-й опытной группы выше на 3,7% (Р<0,1), количество альбуминов выше у цыплят 1-3-й опытных групп соответственно на 10,4; 3,0 и 22,1% (Р<0,01). Количество α- и β-глобулинов у цыплят 1-3-й опытных групп было ниже, чем у аналогов из контроля, соответственно на 13,1 и 24,5; 22,0 и 23,8; 20,1 и 39,2%, а количество γ-глобулинов выше на 7,0 (Р<0,01); 15,3 и 13,1% (Р<0,1).
Следовательно, на основании результатов наших исследований можно предположить, что увеличение содержания общего белка, альбуминов и глобулиновых фракций в пределах физиологической нормы свидетельствует о повышении неспецифической резистентности организма птицы.
Отмечены определенные тенденции в изменении общего белка и его фракций в сыворотке крови цыплят опытных групп под влиянием пробиотиков. В 15-суточном возрасте отмечали увеличение количества общего белка только у цыплят, получавших ветом 3. У цыплят всех опытных групп в этот период регистрировали увеличение γ-глобулинов, причем в большей степени у цыплят 3-й опытной группы, получавших ветоцил.
В 30-суточном возрасте у цыплят опытных групп происходило увеличение количества альбуминов и γ-глобулинов, особенно у цыплят, получавших ветом 3. Незначительное увеличение количества белка отмечали у цыплят, получавших ветоцил. Стабильное увеличение γ-глобулинов в сыворотке крови у цыплят всех опытных групп свидетельствует о повышении уровня неспецифической резистентности организма. Оптимальные результаты получены у цыплят получавших ветом 3 и ветоцил в дозе 75 мг/кг живой массы 2 раза в сутки циклами по 3 дня в течение месяца.
Интенсивность роста цыплят кроссов Родонит, Шавер, Ломанн. У птицы кросса Родонит под влиянием ветома 3 и ветоцила в 7-суточном возрасте абсолютная масса у цыплят 1-й и 2-й опытных групп была ниже относительно аналогов из контроля на 11,7 и 15,1% (Р<0,05); в 14- и 21-суточном возрасте была выше только у цыплят 1-й опытной группы на 10,9 (Р<0,05) и 9,2% (Р<0,1), а у цыплят 2-й опытной группы ниже на 3,8 и 3,4% (Р<0,1). В 28-суточном возрасте абсолютная масса цыплят 1-й и 2-й опытных групп была выше относительно цыплят-аналогов из контроля на 11,5 и 9,2% (Р<0,1).
Среднесуточный прирост в 21-суточном возрасте у цыплят 1-й опытной группы выше на 6,7%, а у цыплят 2-й опытной группы ниже на 5,8%; относительная скорость роста ниже у цыплят 1-й и 2-й опытных групп на 4,7 и 3,5%. Среднесуточный прирост и относительная скорость в 28-суточном возрасте у цыплят 1-й и 2-й опытных групп были выше, чем у аналогов из контроля, на 13,6 и 35,7; 3,5 и 30,9%.
Максимальную интенсивность роста отмечали у цыплят 1-й опытной группы, получавших ветом 3 в дозе 75 мг/кг 2 раза в день 3 дня подряд с 3- дневным перерывом в течение месяца.
У птицы кросса Шавер в 7-, 14-, 21-, 28- и 35-суточном возрасте абсолютная масса цыплят 1-й и 2-й опытных групп была выше на 7,7 и 15,4; 6,7 и 10,0; 2,5 (Р<0,05) и 9,0; 3,4 (Р<0,1) и 11,37; 5,3 и 8,4% (Р<0,1) соответственно. Среднесуточный прирост у цыплят 1-й и 2-й опытных групп в 7-суточном возрасте был выше на 19,0 и 35,7%; в 14-суточном на 5,1 и 3,8; в 21-суточном только у цыплят 2-й опытной группы на 7,0% (Р<0,1); в 28-суточном выше на 5,5 (Р<0,1) и 17,8 (Р<0,05); в 35-суточном выше только у цыплят 1-й опытной группы на 10,9%. Относительная скорость роста цыплят 1-й и 2-й опытных групп в 7-суточном возрасте была выше, чем у цыплят-аналогов из контроля, соответственно на 10,0 (Р<0,1) и 21,2%; в 14- и 21-суточном возрасте ниже на 1,8 и 7,7; 7,6 и 1,8; в 28-суточном выше на 2,5 и 5,7; в 35-суточном возрасте выше только у цыплят 1-й опытной группы на 43,6% (Р<0,05). Оптимальные результаты получены у цыплят 2-й опытной группы, получавших ветом кратностью 2 раза в сутки, циклами 3 дня подряд, с 3-х дневным перерывом.
У цыплят кросса Ломанн под влиянием ветома 3, ветоцила и бифитрилака в 10-суточном возрасте отмечали увеличение абсолютной массы у цыплят 1, 2 и 3-й опытных групп на 5,8 (Р<0,1); 9,1 и 6,2%; в 20-суточном возрасте на 7,2; 2,9 (Р<0,1) и 6,9; в 30-суточном на 3,2; 10,2 и 7,7 (Р<0,1); в 60-суточном на 1,3 (Р<0,05); 11,5 и 13,6; в 90-суточном на 1,1(Р<0,1); 5,5 (Р<0,1) и 5,6% соответственно относительно аналогов из контроля. Среднесуточный прирост у цыплят 1-3-й опытных групп в 10-суточном возрасте был выше аналогов из контроля на 18,9; 28,3 и 19,8%; в 20-суточном только у цыплят 1-й и 3-й опытных групп на 8,2 и 7,1, а у цыплят 2-й опытной группы ниже на 3,9% (Р<0,05); в 30-суточном у цыплят 2-й и 3-й опытных групп выше на 13,6 и 2,3 (Р<0,1), а у цыплят 1-й опытной группы ниже на 8,6%; в 60-суточном возрасте у цыплят 1-3-й опытных групп на 0,2; 12,1 (Р<0,1) и 16,8% соответственно; в 90-суточном выше на 2,3; 10,5 и 11,8%. Относительная скорость роста у цыплят 1-3-й опытных групп в 10-суточном возрасте была выше относительно аналогов из контрольной группы соответственно на 15,2; 22,1 и 15,8%, в 20-суточном возрасте только у цыплят 1-й и 3-й опытных групп на 1,3 и 1,6, а у цыплят 2-й опытной группы ниже на 6,9%; в 30-суточном возрасте у цыплят 2-й опытной группы она была выше на 7,5%, у цыплят 1-й и 3-й группы ниже на 11,9 и 1,9%; в 60-суточном у цыплят 2-й и 3-й опытных групп выше соответственно на 0,6 и 3,9 и ниже в 1-й опытной группе на 1,6%; в 90-суточном возрасте у цыплят 1-й опытной группы была выше на 10,2%, у птицы 2-й и 3-й опытных групп ниже на 1,2 и 5,8%.
Выявлены определенные закономерности по влиянию пробиотических препаратов на интенсивность роста у цыплят яичных кроссов. Интенсивность роста цыплят кросса Родонит и Шавер, получавших ветом 3, была максимальной в 7- и 28-суточном возрате, а у цыплят кросса Ломанн в 10- и 30-суточном возрасте.
2.2.6. Оценка влияния ветома 3 на качество получаемой продукции
Показатели продуктивности птицы кросса Смена. В завершающий период эксперимента в 45-суточном возрасте живая масса у цыплят опытной группы была выше на 0,8% (Р<0,05), масса полупотрошеной тушки на 7,3, потрошеной на 15,4 (Р<0,05), масса грудных и бедренных мышц на 11,9 (Р<0,05) и 3,6%, а масса непотрошеной тушки ниже на 1,0% относительно цыплят-аналогов из контроля (табл. 3).
Таблица 3– Влияние ветома 3 на показатели убойного выхода тушки
|
Масса, г |
Контрольная группа |
Опытная группа |
|
М±m |
М±m |
|
|
Живая |
1943,3±167,3 |
1958,3±147,3** |
|
Тушки после обескровливания |
1895,3±176,1 |
1890,0±149,8 |
|
Непотрошеной тушки |
1783,3±163,3 |
1765,0±127,7 |
|
Полупотрошеной тушки |
1525,0±160,6 |
1636,6±149,7 |
|
Потрошенной тушки |
1256,6±163,3 |
1450,0±170,1** |
|
Грудных мышц |
333,3±30,53 |
373,0±14,57** |
|
Бедренных мышц |
160,5±8,212 |
166,3±7,86 |
**Р<0,05.
Убойный выход в 45-суточном возрасте составил в контроле 78,5, в опытной группе 83,6%.
Таким образом, под влиянием ветома 3 повышаются качественные и количественные показатели продукции. Масса грудных мышц у цыплят опытной группы была выше на 11,9% относительно аналогов из контроля, убойный выход на 5,1%.
Химический состав мяса цыплят. В мясе цыплят опытной группы в 15-суточном возрасте содержание белка и золы было выше на 18,9 (Р<0,1) и 0,5%(Р<0,05), а содержание жира и воды ниже на 20,1(Р<0,05) и 1,4% относительно показателей цыплят из контроля; в 30-суточном возрасте в мясе цыплят содержание белка и воды было выше на 0,3 и 0,7%, а жира и золы снижалось на 17,5 (Р<0,05) и 5,0%. В возрасте 45 суток в мясе цыплят увеличивалось содержание жира, белка и золы на 37,2; 11,9 (Р<0,01) и 26,7% (Р<0,1), а содержание воды снижалось на 2,7% (Р<0,01) относительно показателей цыплят из контроля (табл. 4).
Таблица 4 - Динамика химического состава мяса у подопытных цыплят-бройлеров
|
Показатель |
Группа |
|||||
|
контрольная |
опытная |
контрольная |
опытная |
контрольная |
опытная |
|
|
15 суток |
30 суток |
45 суток |
||||
|
Вода, % |
71,670±0,300 |
70,663±0,100 |
74,000±0,610 |
74,550±0,100 |
75,930±1,270 |
73,920±0,10*** |
|
Жир, % |
6,360±0,344 |
5,080±0,300** |
2,303±0,565 |
1,900±0,020** |
1,837±0,100 |
2,520±0,100 |
|
Белок, % |
20,790±1,169 |
24,730±0,100* |
22,520±1,484 |
22,597±0,200 |
20,120±1,277 |
22,530±0,300*** |
|
Зола, % |
1,180±0,001 |
1,187±0,300** |
1,003±0,367 |
0,953±0,030 |
0,810±0,093 |
1,027±0,700* |
|
Фосфор, мг % |
0,480±0,012 |
0,457±0,700* |
0,483±0,036 |
0,587±0,100* |
0,747±0,090 |
0,707±0,100* |
|
Кальций, мг % |
0,543±0,052 |
0,553±0,140* |
0,453±0,005 |
0,480±0,300 |
0,690±0,027 |
0,713±0,300* |
*Р<0,1; **Р<0,05; ***Р<0,01.
Фосфорно-кальциевый обмен в мясе цыплят-бройлеров опытной и контрольной групп находился в пределах нормы для птицы данного возраста и кросса. В 15- и 45-суточном возрасте в мясе цыплят содержание фосфора было ниже на 4,8 и 5,4%, а в 30-суточном выше на 21,5%; содержание кальция в мясе у цыплят опытной группы было выше в 15-, 30- и 45-суточном возрасте на 1,8; 5,9 и 3,3% (Р<0,1) соответственно.
Количество заменимых аминокислот в мышечной ткани у цыплят-бройлеров опытной группы изменялось. В 15-суточном возрасте у цыплят опытной группы отмечали увеличение аспарагиновой кислоты, цистина и пролина на 1,0; 6,7 и 5,1% (Р<0,05); в 30-суточном возрасте пролина на 6,7%, в 45-суточном возрасте аланина, аспарагиновой кислоты, глицина, цистина и пролина соответственно на 0,5; 0,9; 2,5; 43,5 и 2,5% (Р<0,05) относительно цыплят-аналогов из контроля.
Количество незаменимых кислот в мышечной ткани цыплят-бройлеров под влиянием ветома 3 также изменялось. В 15-суточном возрасте в мышечной ткани у цыплят опытной группы было выше количество лизина, треонина, валина и триптофана на 6,3; 1,1; 0,1 и 9,5%; в 30-суточном возрасте содержание метионина и изолейцина было выше на 9,7 и 0,6% относительно показателей цыплят из контроля. На 45-е сутки исследований цыплята опытной группы по содержанию в мышечной ткани лизина, треонина, валина, оксипролина, триптофана, лейцина превышали показатели аналогов из контроля соответственно на 8,7; 2,8; 1,3; 6,0; 11,9 и 1,3%. Белково-качественный показатель у цыплят в опытной группе был выше в 15-, 30- и 45-суточном возрасте соответственно на 10,6; 5,1 и 5,6%.
Установлено, что содержание незаменимых аминокислот у цыплят опытных групп изменяется с определенной закономерностью. Увеличение их количества в мышечной ткани происходит в завершающий период опыта перед убоем птицы, что обеспечивает высокое их содержание в мясе.
Качественный состав жира, содержащегося в мясе подопытных цыплят-бройлеров, определяется наличием полиненасыщенных жирных кислот, которые определяют не только энергетическую ценность жиров, но и обеспечение жизненно важных процессов в организме животных и человека. Линолевая, линоленовая и арахидоновая кислоты входят в состав клеточных мембран и других структурных элементов тканей. Они обеспечивают нормальный рост организма, обмен веществ и эластичность сосудов.
В 15-суточном возрасте в мышечной ткани у цыплят опытной группы содержание линолевой кислоты было выше, чем у цыплят в контроле, на 0,25% (Р<0,1); в 30- и 45-суточном возрасте – арахидоновой, линолевой и линоленовой соответственно на 15,9 (Р<0,05) и 7,9 (Р<0,05); 0, 1(Р<0,1) и 4,5; 4,5(Р<0,1) и 3,2% (Р<0,05) (табл. 5).
Таблица 5 – Динамика полиненасыщенных жирных кислот в мышечной ткани у подопытных цыплят-бройлеров, %
|
Показатель |
Группа |
|||||
|
контрольная |
опытная |
контрольная |
опытная |
контрольная |
опытная |
|
|
15 суток |
30 суток |
45 суток |
||||
|
Арахидоновая |
0,203±0,027 |
0,183±0,030 |
0,270±0,006 |
0,313±0,009** |
0,290±0,012 |
0,313±0,010** |
|
Линолевая |
9,870±0,006 |
9,887±0,030* |
9,870±0,012 |
9,877±0,003* |
11,910±0,015 |
12,450±0,060 |
|
Линоленовая |
0,673±0,015 |
0,637±0,023 |
0,670±0,022 |
0,700±0,021* |
0,720±0,029 |
0,743±0,030** |
*Р<0,1; **Р<0,05.
Таким образом, у цыплят кросса Смена под влиянием пробиотика в мясе увеличивалось количество жира, золы и белка, а содержание воды снижалось.
При изучении влияния ветома 3 на аминокислотный состав мяса установлено, что в мышечной ткани у цыплят содержание незаменимых аминокислот, таких как лизин, треонин, валин, оксипролин, триптофан и лейцин, и полиненасыщенных жирных кислот - арахидоновой, линолевой и линоленовой - увеличивалось к 45-суточному возрасту птицы. Следовательно, качество мяса и его питательная ценность повышается.
2.2.7. Оценка влияния ветома 3, ветоцила, бифитрилака на микробиоценоз кишечника у птицы
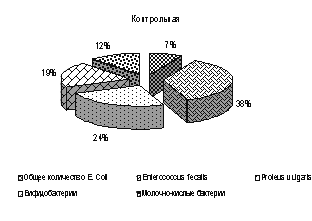
Состав микрофлоры кишечника у цыплят кросса Ломанн. У цыплят суточного возраста кросса Ломанн до применения пробиотических препаратов из содержимого фекалий выделяли E. сoli 27%, Enterococcus fecalis 11%, Staf. aureus 1%, Proteus vulgaris 23%, бифидобактерий 22% и молочно-кислых бактерий 16%.
В 15-суточном возрасте количество бифидобактерий у цыплят 1-3-й опытных групп было выше, чем у аналогов в контроле, соответственно на 15,2 (Р<0,05); 14,7; 14,2%, молочно-кислых бактерий в 1-й опытной группе выше на 3%, а во 2-й и 3-й на уровне с контролем. Количество E. coli у цыплят 1-3-й опытных групп было ниже относительно цыплят-аналогов из контроля соответственно на 13,27; 4,1; 12,3%; Enterococcus fecalis на 74,7; 67,0; 74,5; Proteus vulgaris на 84,8; 84,8 и 80,3; лактозонегативной E. coli у цыплят 1-й и 3-й опытных групп соответственно на 64,1 и 76,3, кишечной палочки со слабовыраженной ферментативными свойствами в 1-й и 3-й опытных группах на 38,5 и 34,5% (Р<0,01).
В 30-суточном возрасте у цыплят 1-3-й опытных групп количество кишечной палочки было выше соответственно на 18,6; 8,9 и 2,6%, молочно-кислых бактерий на 42,3; 39,8; 39,2 и бифидобактерий на 12,8; 12,5 и 12,5%. E. сoli лактозонегативную и со слабо выраженными ферментативными свойствами, а также Enterococcus fecalis не выделяли, Proteus vulgaris регистрировали только у цыплят 1-й опытной группы, и этот показатель был ниже на 46,24% относительно аналогов из контроля (рис. 3).
Под влиянием изучаемых пробиотиков у цыплят кросса Ломанн более выраженное увеличение бифидобактерий отмечали у цыплят 2-й и 3-й опытных групп в 15-суточном возрасте, а молочно-кислых бактерий в 30-суточном. Индекс стабильности микрофлоры (ИСМ) был выше у цыплят опытных групп от 4,0 до 19,0%. При продолжительном применении пробиотиков отмечали не только количественные, но и качественные изменения микрофлоры. Количество нормофлоры увеличивалось, а условно-патогенной микрофлоры снижалось.
Состав микрофлоры кишечника у цыплят кросса ИСА. У цыплят кросса ИСА до применения препарата из содержимого фекалий выделяли 43% E. coli, 37% бифидобактерий и 20% молочно-кислых бактерий.
В 20-суточном возрасте количество бифидобактерий в 1-й и 2-й опытных группах было выше по сравнению с аналогами из контроля соответственно на 8,2(Р<0,05) и 4,1% (Р<0,1).
|
|
|
|
|
|
Рис. 3. Микробиоценоз кишечника у цыплят кросса Ломанн в 30-суточном возрасте
Количество молочно-кислых бактерий в фекалиях превышало показатели цыплят в контроле на 13,2 и 6,6% (Р<0,05), а содержание E. coli в фекалиях цыплят 1-й и 2-й опытных групп было ниже на 1,4 и 0,8% (Р<0,1) соответственно.
В 40-суточном возрасте по сравнению с контрольной группой увеличилось количество бифидобактерий только у цыплят 1-й опытной группы на 3,9%, молочно-кислых бактерий и E. coli у цыплят 1-й и 2-й опытных групп соответственно на 19,4 и 6,6; 2,7 и 1,8% (Р<0,05). ИСМ у цыплят 1-й и 2-й опытных групп был выше на 7,3 и 0,5% относительно аналогов из контроля.
Таким образом, у опытных цыплят под влиянием ветома 3 ускоряется процесс заселения кишечника полезной микрофлорой и качественно изменяется микробный пейзаж в кишечнике.
Состав микрофлоры кишечника у цыплят кросса Смена. У цыплят опытной группы кросса Смена в 15-суточном возрасте относительно контроля увеличивалось количество молочно-кислых бактерий на 14,3%, уменьшалось количество кишечной палочки на 14,9%. У цыплят опытной группы регистрировали спорообразующие палочки рода Bac. subtilis в количестве 5,05±0,04 lg, КОЕ/г. Количество бифидобактерий у цыплят опытной группы было на уровне с контролем. В 30-суточном возрасте у цыплят опытной группы количество бифидо- и молочно-кислых бактерий было выше относительно аналогов из контроля на 1,4 (Р<0,05) и 14,3% соответственно, количество E. coli было ниже на 5,1% (Р<0,05), У цыплят опытной группы регистрировали спорообразующие палочки рода Bac. subtilis в количестве 5,59±0,10 lg, КОЕ/г.
В 45-суточном возрасте у цыплят опытной группы количество бифидо- и молочно-кислых бактерий было выше на 11,2 (Р<0,1) и 13,3%, E. сoli ниже на 13,6% (Р<0,05). У цыплят опытной группы регистрировали спорообразующие палочки рода Bac. subtilis в количестве 6,80±0,07 lg, КОЕ/г. ИСМ был выше у опытных цыплят на 13,8%.
Состав микрофлоры кишечника у цыплят кросса Родонит. До применения ветома 3 и ветоцила у подопытных цыплят суточного возраста из содержимого фекалий выделяли 35% E. coli, 40% бифидобактерий и 25% молочно-кислых бактерий.
В 15-суточном возрасте у цыплят 1-й и 2-й опытных групп по сравнению с аналогами из контроля увеличивалось количество бифидобактерий на 38,5 (Р<0,1) и 38,1%, молочно-кислых бактерий на 15,4 (Р<0,1) и 5,9, E. coli на 17,0 и 19,0% соответственно.
В 30-суточном возрасте у цыплят 1-й и 2-й опытных групп по сравнению с аналогами из контроля увеличивалось количество бифидобактерий на 38,3(Р<0,1) и 34,8%, молочно-кислых бактерий на 18,2(Р<0,1) и 9,2%, E. coli на 5,9 и 8,7%. ИСМ в 30-суточном возрасте был выше у цыплят 1-й и 2-й опытных групп на 23,0 и 14,0%.
Нами установлены определенные закономерности в изменении микробиоценоза под влиянием ветома 3 и ветоцила – препаратов, содержащих природный штамм Вас. subtilis, и бифитрилака. У птицы опытных групп в кишечнике уменьшается количество патогенной и условно-патогенной микрофлоры и увеличивается содержание полезной микрофлоры не только при применении препарата, но и в период его последействия. Процесс заселения кишечника бифидо- и молочно-кислыми бактериями у цыплят опытных групп под влиянием пробиотических препаратов происходит быстрее. Максимальное количество бифидобактерий у опытных цыплят отмечали в 15-20-суточном возрасте, а молочно-кислых бактерий в 30-40-суточном. Изменения микробиоценоза в кишечнике птицы опытных групп способствовали нормализации процессов пищеварения, активизации обменных процессов, повышению естественной резистентности организма и его устойчивости к действию неблагоприятных факторов внешней среды, повышению интенсивности роста и продуктивности цыплят.
2.2.8. Оценка влияния пробиотиков на яйценоскость, качество яиц и выводимость
Яйценоскость кур-несушек кросса Родонит. Ветом 3 назначали в дозе 75 мг/кг 3 дня подряд курам в 100-суточном возрасте. У опытных кур повышалась яйценоскость и качественные показатели яиц. Количество яиц массой 45-50 г у кур опытной группы в 22-недельном возрасте было выше относительно кур-аналогов в контроле на 0,6%, массой 50,1-55 г – на 13,4, массой 55,1-60 г - на 1,9, массой 65,1-70 г - на 2,3 и массой свыше 70 г – на 1%. От кур опытной группы не получили яиц массой 60,1 - 65 г. У кур- несушек опытной группы была выше плотность яиц на 0,5%, содержание витамина А в яйце на 12,5%.
Яценоскость птицы опытной группы была выше аналогов из контроля: в первый месяц исследований в возрасте до 24 недель на 4,6%; в возрасте до 28 недель на 3,98; в возрасте до 32 недель на 4,78; в возрасте до 36 недель на 4,49; в возрасте до 40 недель на 5,87; в возрасте до 44 недель на 6,71 и в возрасте до 48 недель на 8,33%. В этот период у птицы прекращается рост, и масса яиц становится максимальной.
Полученные нами данные свидетельствуют о позитивном влиянии изучаемого пробиотика на яйценоскость кур-несушек. В динамике с увеличением возраста яйценоскость птицы увеличивалась.
Яйценоскость племенной птицы кросса Родонит. Ветом 3 в дозе 50 мг/кг 5 дней подряд назначали курам в 100-суточном возрасте. Качественные показатели яиц у кур опытной группы были выше относительно аналогов из контроля по массе яйца на 3,8%, по толщине скорлупы на 5,1, удельному весу на 0,6, количеству каротиноидов и витамина А в яйце на 17,2 и 22,2%. Оплодотворенность яиц от кур из опытной группы была выше по сравнению с аналогами из контроля на 33,3, выводимость на 5,4, сохранность кур на 3,1, а расход кормов ниже на 11,6%. В сыворотке крови у кур опытной группы в возрасте 100 суток до назначения препарата количество белка было выше на 2,7%, кальция и фосфора на уровне и ниже показателей аналогов из контроля. У кур опытных групп через 2 недели после прекращения введения препарата в сыворотке крови количество кальция и фосфора было выше на 17,5 и 5,6% соответственно, а содержание белка на уровне показателей аналогов из контроля.
Полученные нами данные свидетельствуют о позитивном влиянии изучаемого пробиотика на яйценоскость кур-несушек. Под влиянием ветома 3 она повышалась в зависимости от возраста на 3,98 - 8,33%. Максимальную продуктивность отмечали у кур опытной группы на 7-й месяц исследований. Под влиянием ветома 3 возрастают качественные показатели, оплодотворяемость яиц и выводимость цыплят.
ВЫВОДЫ
1. Ветом 3 является новым пробиотическим препаратом, который содержит иммобилизированную высушенную биомассу Basillus subtilis нерекомбинантного штамма ВКПМ 7048 и глюкозу. Ветом 3 относится к малотоксичным препаратам (IV класс токсичности), не обладает эмбриотоксическим, неврологическим, гепатотоксическим, нефротоксическим действием, не изменяет двигательную активность, рефлексы (ушной, корнеальный, Штраубе) и не вызывет миорелаксации.
2. Морфометрические изменения внутренних органов у белых мышей и цыплят кросса Родонит опытных групп изменялись с одинаковой закономерностью. Под влиянием ветома, ветоцила в дозе 75 мг/кг массы и наринэ 100 мг/кг, при назначении их цыплятам 2 раза в сутки, циклами по 3 дня с 3-дневным перерывом в течение месяца, происходит увеличение изучаемых органов с 5- до 30-суточного возраста. Иммунокомпетентные органы (тимус, бурса Фабрициуса и селезенка) более интенсивно развивались у цыплят 15- и 30-суточного возраста, получавших ветом 3.
3. Морфогематологические показатели крови у цыплят мясных (ИСА, Бройлер, GV, Смена) и яичных кроссов (Родонит, Шавер, Ломанн) изменяются с одинаковой закономерностью. В крови цыплят опытных групп на 20-е сутки повышается содержание лимфоцитов от 0,5 до 1,7% и псевдоэозинофилов от 2,8 до 16,2%, на 40-е сутки исследований увеличивается содержание моноцитов от 1,6 до 16,7% и лимфоцитов на 0,2-1,8%. Количество эозинофилов в крови цыплят опытных групп в течение эксперимента понижалось от 2,6 до 28,2%. Характер и выраженность изменений в большей степени зависели от кратности, схем и продолжительности применения препарата. У цыплят всех кроссов увеличивается в крови количество эритроцитов и лейкоцитов и содержание гемоглобина до верхних границ физиологической нормы.
4. Содержание общего белка, альбуминов и α-, β-,γ-глобулинов у цыплят кроссов Смена, Ломанн и Шавер изменялось с определенной закономерностью. Количество общего белка в сыворотке крови у цыплят опытных групп было выше от 0,6 до 23,1%. Содержание γ-глобулинов и альбуминов повышалось в пределах физиологической нормы у опытных цыплят в 30- и 45-суточном возрасте от 2,7 до 15,3 и от 1,3 до 22,1%. Количество заменимых аминокислот в крови у цыплят опытных групп было ниже и на уровне показателей аналогов в контроле, за исключением пролина, который увеличивался в течение всего опытного периода. Из незаменимых аминокислот в крови у опытных цыплят в 15- и 30-суточном возрасте увеличивалось количество изолейцина на 26,0 и 4,0%, в 45-суточном возрасте валина, метионина, изолейцина, лейцина и фенилаланина на 2,1; 2,0; 12,5; 10,5; 1,8% соответственно. Более выраженные изменения биохимических показателей крови отмечали у цыплят, получавших ветом 3.
5. Уровень неспецифической резистентности организма цыплят под влиянием ветома 3 повышается. В крови цыплят опытных групп БАСК, увеличивалась до 15-суточного возраста на 7,7%, ЛАСК, иммуноглобулины G до 30-суточного возраста на 8,9 и 14,7%. С увеличением продолжительности введения препарата сила его влияния на иммунологические показатели постепенно уменьшается, и в 45-суточном возрасте у цыплят кросса Смена снижается в крови содержание α-,γ-глобулинов, ЛАСК, БАСК и иммуногобулинов G. Активность лизосомально-катионных белков, средний цитохимический показатель супероксиддисмутазы полиморфноядерных нейтрофилов, фагоцитарный индекс и фагоцитарная активность сыворотки крови опытных цыплят кросса ИСА превышали показатели аналогов из контроля.
6. Ветом 3, ветоцил и бифитрилак изменяют качественный и количественный состав микрофлоры в кишечнике у цыплят кроссов Родонит, Смена, Ломанн и ИСА и ускоряют процесс колонизации кишечника бактериями-симбионтами. В кишечнике увеличивается количество бифидо- и молочно-кислых бактерий и снижается содержание условно-патогенной микрофлоры. Более интенсивное увеличение количества бифидобактерий отмечали в 15- и 20-суточном возрасте от 4,1 до 38,5%, а молочно-кислых бактерий в 30- и 40-суточном возрасте от 6,6 до 42,3% при применении ветома 3. Индекс стабильности микрофлоры повышался в динамике и был выше аналогов из контроля от 0,5 до 23,0%. Микробиоценоз у цыплят кроссов Ломан, ИСА и Родонит в кишечнике изменялся с одинаковой закономерностью.
7. Пробиотики стимулируют интенсивность роста цыплят преимущественно в период назначения препаратов, не изменяя динамику физиологической скорости роста по возрастным периодам. Применение препарата позволяет сократить период откорма цыплят-бройлеров на 5-7 суток, повысить среднесуточный прирост от 0,5 до 28,9% и сохранность птицы от 1,1 до 11,5%. Ростостимулирующее действие ветома 3 зависело от возраста и физиологических особенностей кросса. У цыплят-бройлеров кросса Бройлер отмечали высокую интенсивность роста с 7- до 21-суточного возраста; кросса Смена с 5- до 15-суточного; кросса GV с 7- до 28-суточного; кросса ИСА с 7- до 14-суточного возраста.
8. Убойный выход мяса, масса полупотрошеной и потрошеной тушки, грудных и бедренных мышц были выше показателей аналогов из контрольной группы в 45-суточном возрасте соответственно на 6,5; 7,3; 15,4; 11,9 и 3,6%. Под влиянием ветома 3 в мясе опытных цыплят увеличивалось содержание жира, белка и золы на 37,2; 11,9 и 26,7%, а содержание воды снижалось на 2,7% относительно показателей цыплят из контроля.
9. Количество заменимых и незаменимых аминокислот в мясе у цыплят опытных групп изменяется с определенной закономерностью. Увеличение количества большинства аминокислот в мышечной ткани происходит в завершающий период опыта в 45-суточном возрасте, что обеспечивает их высокое содержание в мясе. Белково-качественный показатель у цыплят в опытной группе был выше в 15-, 30- и 45-суточном возрасте соответственно на 10,6; 5,1 и 5,6%. В мышечной ткани у опытных цыплят увеличивалось количество полиненасыщенных жирных кислот: линолевой, линоленовой и арахидоновой от 3,2 до 7,9%.
10. Яйценоскость кур кросса Родонит под влиянием ветома 3 повышается. С увеличением периода яйценоскости продуктивность птицы возрастает в динамике. Куры опытной группы по продуктивности превышали аналогов из контроля от 3,98 до 8,33%. Под влиянием пробиотика повышаются инкубационные качества яиц у племенной птицы: масса яиц на 3,8%, толщина скорлупы на 5,1, удельный вес на 0,6, количество каротиноидов и витамина А на 17,2 и 22,2, оплодотворенность на 33,3, выводимость на 5,4%.
11. В технологической схеме выращивания и эксплуатации птицы для получения здоровой высокопродуктивной птицы, экологически чистой и качественной продукции необходимо регламентированное применение пробиотиков с суточного возраста, с учетом физиологических особенностей организма и критических периодов в жизни птицы. Цикличное введение в организм пробиотиков позволяет максимально раскрыть физиологические возможности и имеющиеся резервы организма птицы. Разработанная нами концепция предполагает применение пробиотиков в замкнутом цикле «цыпленок – курица – яйцо – цыпленок».
ПРАКТИЧЕСКИЕ ПРЕДЛОЖЕНИЯ
Материалы диссертации вошли в следующие нормативные документы:
1. Технические условия на ветом 3. ТУ 9291-037-23609643-06 от 20.10.06 г. Разработчики: НПФ «Исследовательский центр», ФГУ «ВГНКИ», ФГОУ ВПО «НГАУ».
2. Применение пробиотиков цыплятам в течение первого месяца жизни и повторное его назначение курам несушкам в 100-суточном возрасте обеспечивает высокую сохранность и яйценоскость птицы в период ее эксплуатации. Оптимальной схемой применения пробиотиков курам яичного направления является их назначение цыплятам с суточного возраста в дозе 75 мг/кг массы 2 раза в сутки циклами по 3 суток с 3-дневным перерывом в течение месяца и птице в возрасте 100 суток 3 дня подряд в дозе 75 мг/кг массы.
3. Для повышения интенсивности роста, сохранности и качества мяса ветом 3 необходимо применять цыплятам-бройлерам в дозе 75 мг/кг массы 2 раза в сутки через 24 ч в течение месяца.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ
Статьи в ведущих научных журналах, рекомендованных ВАК Минобразования РФ и науки
1. Иванова А.Б. Влияние пробиотического препарата ветом 3 на морфологические показатели крови цыплят-бройлеров / А.Б. Иванова // Сиб. вестн. с.-х. науки. – 2005. - №2. С. 132-138.
2. Иванова А.Б. Физиологические показатели скорости роста цыплят и биохимический состав сыворотки крови при применении пробиотиков / А.Б. Иванова // Сиб. вестн. с.-х. науки. – 2006. - №4. – С. 62-66.
3. Иванова А.Б. Изменение качественного и количественного состава микрофлоры кишечника у цыплят-бройлеров при применении ветома 3 / А.Б. Иванова // Сиб. вестн. с.-х. науки.– 2006. - №.2 - С. 102-105.
4. Беркольд Ю.И. Влияние пробиотических препаратов на основе Bacillus subtilis на физиологические показатели роста цыплят-бройлеров / Ю.И. Беркольд, А.Б. Иванова // Сиб. вестн. с.-х. науки.– 2006. - №4. – С. 45-48.
5. Ноздрин Г.А. Пробиотики на основе Bacillus subtilis и их роль в поддержании здоровья животных разных видов / Г.А. Ноздрин, А.Б. Иванова, А.Г. Ноздрин // Сиб. вестн. с.-х. науки. – 2006. - №7.– С. 63-66.
6. Иванова А.Б. Влияние пробиотиков на основе Bacillus subtilis на микробиоценозы кишечника животных в норме и при патологии / А.Б. Иванова, А.Г. Ноздрин // Вестн. КрасГАУ - 2006.- №11.– С. 141-143.
7. Иванова А.Б. Влияние пробиотического препарата ветом 3 на качество мяса цыплят-бройлеров / А.Б. Иванова, Г.А. Ноздрин // Сиб. вестн. с.-х. науки. – 2007. - №8. – С. 69-74.
8. Иванова А.Б. Фармакологическая коррекция продуктивности птицы с использованием пробиотиков / А.Б. Иванова, Г.А. Ноздрин // Сиб. вестн. с.-х. науки. – 2008. - №5.– С. 110-115.
Работы, опубликованные в сборниках научных трудов, материалах конференций и других изданиях
9. Иванова А.Б. Коррекция микробиоценозов в пищеварительном тракте у цыплят с использованием ветома 3 / А.Б. Иванова // Материалы 1-й междунар. науч. конф. «Селекция, ветеринарная генетика и экология».-Новосибирск, 2001. - С. 57.
10. Иванова А.Б. Активизация факторов неспецифической резистентности защиты организма цыплят при применении ветома 3 / А.Б. Иванова // Материалы 1-й междунар. науч. конф. «Селекция, ветеринарная генетика и экология». - Новосибирск, 2001. – С. 57-58.
11. Ноздрин Г.А. Изучение влияния ветома 3 на рост и развитие цыплят / Г.А. Ноздрин, А.Б. Иванова, И.В. Наумкин // Актуальные вопросы ветеринарии: материалы 3-й науч.- практ. конф. фак. вет. медицины НГАУ. – Новосибирск, 2001. – С. 60-61.
12. Ноздрин Г.А. Превентивное применение пробиотиков цыплятам / Г.А. Ноздрин, А.Б. Иванова, И.В. Наумкин //Актуальные вопросы ветеринарии: материалы 3-й науч.-практ. конф. фак. вет. медицины НГАУ. – Новосибирск, 2001. – С. 18-19.
13. Иванова А.Б. Влияние ветома 3 на сохранность цыплят-бройлеров / А.Б. Иванова // Материалы науч.- практ. конф. // Урал. гос. академия вет. медицины – Троицк, 2002. - С. 38.
14. Ноздрин Г.А. Фармакопрофилактика и фармакотерапия при гинекологических заболеваниях у коров с использованием пробиотиков: метод. Рекомендации /А.Г. Ноздрин, А.Б. Иванова, О.Ю. Леденева, А.Г. Ноздрин. - Новосибирск, 2002. – 27 с.
15. Ноздрин Г.А. Коррекция роста и развития цыплят-бройлеров кроссов «ISA» и «Бройлер-6» с использованием ветома / Г.А. Ноздрин, А.Б. Иванова, А.Г. Ноздрин // Пути повышения эффективности АПК в условиях вступления России в ВТО: материалы междунар. науч.-практ. конф. –Уфа, 2003. - С. 232-234.
16. Иванова А.Б. Изменение микробиоценоза у цыплят при применении пробиотиков / А.Б.Иванова // Новые фармакологические средства в ветеринарии: материалы междунар. науч.-практ. конф. - СПб., 2003. -С.16-17.
17. Ноздрин Г.А. Фармакологические аспекты применения пробиотиков на основе Bac. subtilis для стимуляции роста животных / Г.А. Ноздрин, А.Б. Иванова, А.Г. Ноздрин, А.И. Шевченко // Новые фармакологические средства в ветеринарии: материалы междунар. науч.-практ. конф. – СПб., 2003. - С. 27-28.
18. Ноздрин Г.А. Динамика сохранности цыплят-бройлеров в различные возрастные периоды при применении пробиотиков / Г.А. Ноздрин, А.Б. Иванова, А.И. Шевченко, А.Г. Ноздрин // Новые фармакологические средства в ветеринарии: материалы междунар. науч.-практ. конф. – СПб., 2003. - С. 17.
19. Ноздрин Г.А. Хронофармакологические особенности влияния ветома 3 на морфологические показатели крови у телят, больных гастроэнтеритом /А.Г. Ноздрин, Д.А. Одношевский, А.Б. Иванова, А.Г. Ноздрин // Новые фармакологические средства в ветеринарии: материалы междунар. науч.-практ. конф.- СПб., 2003. - С. 28-29.
20. Ноздрин Г.А. Влияние ветома 1.1. на морфологические показатели крови цыплят-бройлеров кросса «Смена-2» / Г.А. Ноздрин, А.И. Шевченко, А.Б. Иванова, А.Г. Ноздрин // Новые фармакологические средства в ветеринарии: материалы междунар. науч.-практ. конф. – СПб., 2003 - С. 76.
21. Nozdrin G.A. The use of ecologically safe probiotics in poultry farming / G.A. Nozdrin, A.B. Ivanova, A.G.Nozdrin // Veterinary Genetics Selection Ecology. –Novosibirsk, 2003. – Vol. 2. P. 202-203.
22. Nozdrin G.A. The use of probiotics to produce ecologically safe products / G.A. Nozdrin, A.B. Ivanova, A.G.Nozdrin, A.I. Shevchenko // Veterinary Genetics Selection Ecology. - Novosibirsk, 2003. – Vol. 2. - P. 203-204.
23. Иванова А.Б. Применение ветома 3 цыплятам-бройлерам различного возраста с профилактической целью / А.Б. Иванова // Новые пробиотические и иммунотропные препараты в ветеринарии: материалы Рос. науч.-практ. конф. НГАУ. – Новосибирск, 2003. - С. 26-27.
24. Иванова А.Б. Изучение терапевтической эффективности препарата зимун 3.22 при гнойно-катаральном мастите у коров / А.Б. Иванова // Новые пробиотические и иммунотропные препараты в ветеринарии: материалы Рос. науч.- практ. конф. НГАУ. – Новосибирск, 2003. - С. 36-37.
25. Иванова А.Б. Влияние ветома 3 на сохранность и интенсивность роста цыплят-бройлеров различных кроссов / А.Б.Иванова // Новые пробиотические и иммунотропные препараты в ветеринарии: материалы Рос. науч.-практ. конф. НГАУ. – Новосибирск, 2003. - С. 48.
26. Ноздрин Г.А. Технологические аспекты применения пробиотических препаратов / А.Б. Иванова, О.Ю. Леденева, Д.А. Одношевский, А.И. Шевченко // Новые пробиотические и иммунотропные препараты в ветеринарии: материалы Рос. науч.-практ. конф. НГАУ. – Новосибирск, 2003. - С. 55-56.
27. Ноздрин Г.А. Механизм антимикробного действия пробиотических препаратов / Г.А. Ноздрин, А.Б. Иванова, А.Г. Ноздрин // Новые пробиотические и иммунотропные препараты в ветеринарии: материалы Рос. науч.- практ. конф. НГАУ. – Новосибирск, 2003. - С. 56-58.
28. Ноздрин Г.А. Оптимизация микробиоценозов среды обитания животных путем направленного изменения микробных экосистем с использованием пробиотиков: рекомендации / Г.А. Ноздрин, А.Б. Иванова, А.Г. Ноздрин. - Новосибирск, 2004. - 52 с.
29. Ноздрин Г.А. Научные основы применения пробиотиков в птицеводстве: монография / Г.А. Ноздрин, А.Б. Иванова, А.И. Шевченко, А.Г. Ноздрин: Новосиб. гос. аграр. ун-т. – Новосибирск, 2005. – 224 с.
30. Иванова А.Б. Влияние ветома 3 и ветоцила на гематологические показатели крови цыплят / А.Б. Иванова // Новые фармакологические средства в ветеринарии: материалы XVII междунар. межвуз. науч.-практ. конф. - СПб., 2005. - С. 73-74.
31. Иванова А.Б. Влияние ветома 3 на интенсивность роста и сохранность цыплят-бройлеров /А.Б. Иванова//Современные тенденции развития аграрной науки в России: материалы IV междунар. науч.-практ. конф. молодых ученых, посвящ. 70-летию НГАУ. – Новосибирск, 2006. – С. 214-216.
32. Ноздрин Г.А. Разработка и применение пробиотических препаратов для ветеринарии / Г.А. Ноздрин, А.Б. Иванова, А.Г. Ноздрин, Е.Н. Демина, А.И. Леляк, А.А. Малярчук // Научное обеспечение АПК Сибири, Монголии и Казахстана: материалы 10-й междунар. конф. по науч. обеспечению азиат. территорий. - Улан-Батор, 2007. – С. 359-360.
33. Иванова А.Б. Оценка влияния пробиотического препарата ветома 3.3 на биохимические показатели сыворотки крови у цыплят / А.Б. Иванова // Фармакологические и экотоксикологические аспекты ветеринарной медицины: материалы науч.-практ. конф. фармакологов Российской Федерации. – Троицк, 2007. – С. 106-110.
34. Ноздрин Г.А. Влияние пробиотических препаратов велес 6.59 и ветом 3.3 на прирост живой массы у цыплят / Г.А. Ноздрин, А.Б. Иванова, М.К. Медведев // Новые фармакологические средства в ветеринарии: материалы XIX междунар. науч.-практ. конф. - СПб., 2007.- С. 54.
35. Ноздрин Г.А. Влияние препарата велес 6.59 на интенсивность роста у телят / Г.А. Ноздрин, А.Б. Иванова, А.Г. Ноздрин, И.С. Верина, А.И. Леляк, А.А. Малярчук / /Новые фармакологические средства в ветеринарии: материалы XIX междунар. науч.-практ. конф. - СПб., 2007.- С. 54-55.
36. Ноздрин Г.А. Основные итоги разработки и применения пробиотиков / Г.А. Ноздрин, А.Б. Иванова, А.Г. Ноздрин, А.И. Леляк, А.А. Малярчук // Пробиотики, пребиотики, синбиотики и функциональные продукты питания. Фундаментальные и клинические аспекты: науч.- практ. журн. - 2007. - № 1-2 – С. 58.
37. Ноздрин Г.А. Изучение влияния ветома 3 на качество яйца птицы кросса Родонит / А.Г. Ноздрин, А.Б. Иванова // Пробиотики, пребиотики, синбиотики и функциональные продукты питания. Фундаментальные и клинические аспекты: науч.-практ. журн. - 2007. – № 1-2. - С. 57.
38. Иванова А.Б. Использование ветома 3 для повышения продуктивности птицы / А.Б. Иванова // Пробиотики, пребиотики, синбиотики и функциональные продукты питания. Фундаментальные и клинические аспекты: науч.-практ. журн. - 2007. – № 1-2.- С. 43.
39. Ноздрин Г.А. Пробиотики на основе Bacillus subtilis - новый класс экологически адекватных препаратов / Г.А. Ноздрин, А.Б. Иванова, А.Г. Ноздрин, Е.Н. Демина, А.И. Леляк, А.А. Малярчук и др. // Эффективные и безопасные лекарственные средства в ветеринарии: материалы I междунар. конгр. вет. фармакологов. - СПб., 2008.- С. 90-91.
40. Ноздрин Г.А. Изучение влияния гомобиотика велес 6.59 на организм молодняка крупного рогатого скота / Г.А. Ноздрин, А.Б. Иванова, А.Г. Ноздрин, И.С. Верина, В.Д. Соколов, Н.Л. Андреева // Эффективные и безопасные лекарственные средства в ветеринарии: Материалы I междунар. конгр. вет. фармакологов. – СПб., 2008.- С. 92-93.
41. Nozdrin G.A. Chronopharmacological features of Vetom 1.1. action on morphological blood values of healthy calves / G.A. Nozdrin, Y.I. Berkold, A. B. Ivanova, E.N. Demina //Bioligy, Economics and Education: Proceedings of the international Scientific Conference «Bioligy, Economics and Education» (June 28-29, 2007, Novosibirsk SAU). – Novosibirsk, 2008. – P. 149-151.
42. Способ повышения яйценоскости птицы. Заявка на изобретение №2008118650 ФИПС от 12.05.08 г./ Ноздрин Г.А., Иванова А.Б, Ноздрин А.Г.: заявитель и патентообладатель ФГОУ ВПО «НГАУ».
43. Способ повышения качества мяса цыплят-бройлеров. Заявка на изобретение №2008118778 ФИПС от 12.05.08 г./ Ноздрин Г.А., Иванова А.Б., Ноздрин А.Г.: заявитель и патентообладатель ФГОУ ВПО «НГАУ».
44. Способ повышения продуктивности сельскохозяйственной птицы. Заявка на предполагаемое изобретение №2008123421 ФИПС от 09.06.2008 г. / Шевченко А.И., Ноздрин Г.А., Шевченко С.А., Иванова А.Б. и др.: заявитель и патентообладатель ФГОУ ВПО «НГАУ».
Подписано в печать 02. 07. 2008 г. Формат 60×84 1 / 16
Печ. л. 2,0. Тираж 150 экз. Заказ № 130.
__________________________________________________________________
Отпечатано в ООО «Печатное издательство Агро-Сибирь»
г. Новосибирск, ул. Никитина 155, тел. (383) 267-19-90,
e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
2.2.6. Оценка влияния ветома 3 на качество получаемой продукции