Вестник РАМН, 2004 г., № 11, с. 29-32
© КОЛЛЕКТИВ АВТОРОВ, 2004 УДК 579.25:579.6
Е. А. Ставский, О. Н. Гришаева, А. И. Леляк, Н. М. Ларина, Л. А. Тимукина, Л. В. Митько, Р. С. Коваль,
В. В. Серебров, И. В. Ренау, О. В. Культенко
ЭКСПЕРИМЕНТАЛЬНАЯ ОЦЕНКА ВОЗМОЖНОСТИ ПЕРЕДАЧИ ИСКУССТВЕННОГО ГЕНА ЛЕЙКОЦИТАРНОГО ИНТЕРФЕРОНА-а2 ЧЕЛОВЕКА В ДРУГИЕ ВИДЫ МИКРООРГАНИЗМОВ
ГНЦ вирусологии и биотехнологии "Вектор", ЗАО "Вектор-Бест", ООО НПФ "Исследовательский центр", пос. Кольцово, Новосибирская область; ГВДУ "Областная ветеринарная лаборатория" ФГУ ВГНКИ (ОС ФГУ ВГНКИ), НИИ систематики и
экологии животных СО РАН, Новосибирск
Согласно действующей в Российской Федерации нормативной документации по охране здоровья населения страны, окружающей среды и контролю генно-инженерной деятельности, предусматривается оценка возможной передачи клонированного фрагмента ДНК в другие виды микроорганизмов, распространенных в местах потенциального попадания генно-инженерно-модифицированных микроорганизмов (ГИММ) в окружающую среду [6]. Это является наиболее актуальным для открытых систем [4, 5, 19]. В данном случае попадание ГИММ в окружающую среду является неизбежным и прогнозируемым. Имеющийся опыт изучения жизнеспособности селекционных штаммов-продуцентов и ГИММ в природе позволяет полагать, что эти микроорганизмы, попадая в окружающую среду, значительно уступают по жизнеспособности микроорганизмам, обитающим в естественных экологических нишах [1, 3, 7, 10, 12, 16]. Микроорганизмы, в том числе ГИММ, в условиях естественного обитания и искусственной интродукции способны высвобождать из лизирующихся клеток хромосомную и плазмидную ДНК в окружающую среду. В зависимости от внешних условий плазмиды могут сохранять трансформирующую активность в течение длительного времени. Это один из серьезных факторов риска интродукции, потенциально способствующий неконтролируемой диссеминации рекомбинантной ДНК с возможным ее проникновением в клетки новых хозяев [1, 4, 13, 16, 18]. В связи с изложенным проведение экспериментальных работ по оценке рисков интродукции в окружающую среду ГИММ является актуальным и практически важным как для получения и накопления фактологических материалов по различным аспектам биологической безопасности использования рекомбинантных микроорганизмов, так и для отработки методологии проведения таких работ.
Целью настоящей работы являлась экспериментальная оценка возможности передачи клонированного в бактерии В. subtilis фрагмента ДНК (штамм ВКПМ В-7092, содержащий ген лейкоцитарного интерферона-α2 человека) в другие виды микроорганизмов, распространенные в местах потенциального попадания указанного ГИММ в окружающую среду (в почву).
Материал и методы
Штамм В. subtilis ВКПМ В-7092 (Всероссийской коллекции промышленных микроорганизмов) является рекомбинантным штаммом, клетки которого содержат плазмиду со структурным геном зрелой формы лейкоцитарного интерферона-α2 человека. Данная плазмида направляет в клетках В. subtilis ВКПМ В-7092 синтез и секрецию вне бактериальной клетки биологически активного интерферона [11, 16]. Указанный ГИММ относится к аэробам. При росте на среде LA он дает форму колоний, похожую на ромашку. Колонии белесые. Бактерии имеют вид палочек. Величина клеток одно-суточной агаровой культуры (2 — 4) х (0,5 — 0,8) мкм. Образуют споры. Капсулы не образуют. По Граму окрашиваются положительно. Штамм размножается при 15—50°С, оптимальный рост при температуре 36—37°С. Вызывает гидролиз крахмала, редукцию нитратов. Расщепляет глюкозу, сахарозу, маннит, мальтозу и лактозу. Штамм устойчив к канамицину. Кроме интерферона-α2, синтезирует антибиотик широкого спектра действия, подавляющий рост грибов, стафилококков, стрептококков и синегнойной палочки[11].
В экспериментах использовали пробиотик ВЕТОМ 1.1 производства ООО НПФ "Исследовательский центр" (пос. Кольцово, Новосибирская область). Действующим началом пробиотика являются бактерии штамма В. subtilis ВКПМ В-7092.
Пробы почвы отбирали в местах попадания указанного ГИММ во внешнюю среду в сельскохозяйственных предприятиях, длительно применявших для лечения и профилактики заболеваний крупного рогатого скота пробиотик ВЕТОМ 1.1, в частности, в АОЗТ "Кирзинское" Ордынского района Новосибирской области, в котором использовали указанный препарат на протяжении 8 лет. Для сравнения было выбрано не применявшее указанный препарат СПК "Рогалевское" (Ордынский район Новосибирской области). Пробы почвы отбирали с участков земли, в которые 8, 5 лет и 1 год назад был внесен навоз из ферм АОЗТ "Кирзинское" (соответственно пробы № 1, 2 и 3). Для сравнения использовали пробы с участка земли из СПК "Рогалевское", в который навоз из ферм был внесен 6 лет назад.
Бактериальные культуры из проб почвы выделяли на жидких и плотных бактериальных средах с канамицином по принятым методам [8, И, 15, 16].
С целью обнаружения в пробах почвы возможного наличия хромосомной и плазмидной ДНК, попавших в окружающую среду из лизировавшихся бактериальных клеток ГИММ, получали водные вытяжки из проб почвы № 1, 2 и 3.
Первичную идентификацию штамма ГИММ среди выделенных из проб почвы бактериальных культур проводили по комплексу его основных культуралъно-морфологических признаков [И]. Точную идентификацию штамма ГИММ В. subtilis ВКПМ В-7092 осуществляли методом двухраундо-вой ПЦР с применением праймеров, специфичных для клонированной ДНК и маркерам гена лейкоцитарного интерферона-α2 человека и канамицина. Для получения ДНК из культур указанных микроорганизмов их выращивали на плотной питательной среде МПА с канамицином. При этом использовали культуры клеток, полученные в конце экспоненциальной — начале стационарной фазы развития. Поскольку искомые генетические фрагменты находятся в плазмидных структурах, которыми был трансформирован штамм В. subtilis ВКПМ В-7092, то из анализируемых бактериальных культурмодифицированным методом щелочного лизиса Бирнбойма— Доли выделяли плазмидные ДНК [17]. Аналогичным способом обрабатывали водные вытяжки проб почвы № I, 2 и 3. Полученные ДНК исследовали методом двухраундовой ПЦР.
Для выявления специфических фрагментов ДНК с помощью программы "Олиго-6" были разработаны и синтезированы специфические праймеры (искусственного маркера гена лейкоцитарного интерферона человека с длинами фрагментов соответственно 452 и 328 п. н.; маркера гена устойчивости к канамицину — 834 к 314 п. н.)- Специфичность праймеров была подтверждена с помощью программы BLAST (/gi: 396443/, /gi: 31415690/, /gi:29568850/, /gi: 3953638/) Национального института здоровья США (http:// www.ncbi.Nih.gov/blast). Для этих праймеров были подобраны и отработаны условия проведения ПЦР. Поскольку было известно, что искомые генетические фрагменты находятся в плазмидных структурах, которыми был трансформирован штамм В. subtilis ВКПМ В-7092, были выделены плазмидные ДНК из бактериальных культур [11, 16, 17], изолированных из проб почвы, и проанализированы в ПЦР. Для проведения двухраундовой ПЦР использовали стандартные реактивы, растворы и оборудование.
Амплификацию осуществляли в 30 мкл смеси, содержащей ПЦР-буфер (10 мМ трис-HQ рН 8,3, 50 мМ KCI), 2 мМ MgCl2, 0,2 мМ каждого dHТФ, 20 рМ каждого праймера, 2,5 ед. Taq-ДНК-полимеразы, 5 мкл исследуемой пробы. Проводили 30 циклов амплификации для всех используемых праймеров в следующем режиме.
Первый раунд ПЦР: 95°С, 3 мин, 1 цикл; 94°С, 30 с; 58°С, 30 с; 72°С, 30 с, 30 циклов; 72°С, 3 мин, 1 цикл.
После первого раунда 1 мкл амплификата переносили в пробирки с реакционной смесью для второго раунда ПЦР.
Второй раунд ПЦР: 95°С, 3 мин, 1 цикл; 94°С, 30 с; 68°С, 30 с; 72°С, 30 с, 30 циклов; 72°С, 3 мин, 1 цикл.
Детекцию амплифицированной ДНК после ПЦР проводили методом гель-электрофореза в 2% агарозном геле. Полученные результаты считали удовлетворительными при наличии в геле хорошо видимой полосы ДНК расчетной длины. Положительными считали образцы с наличием в геле полосы ДНК, соответствующей по длине фрагменту ДНК контрольного образца, а также нужной полосе в маркере длин фрагментов. Обработку и анализ полученных результатов осуществляли с применением стандартных статистических методов [9].
Результаты и обсуждение
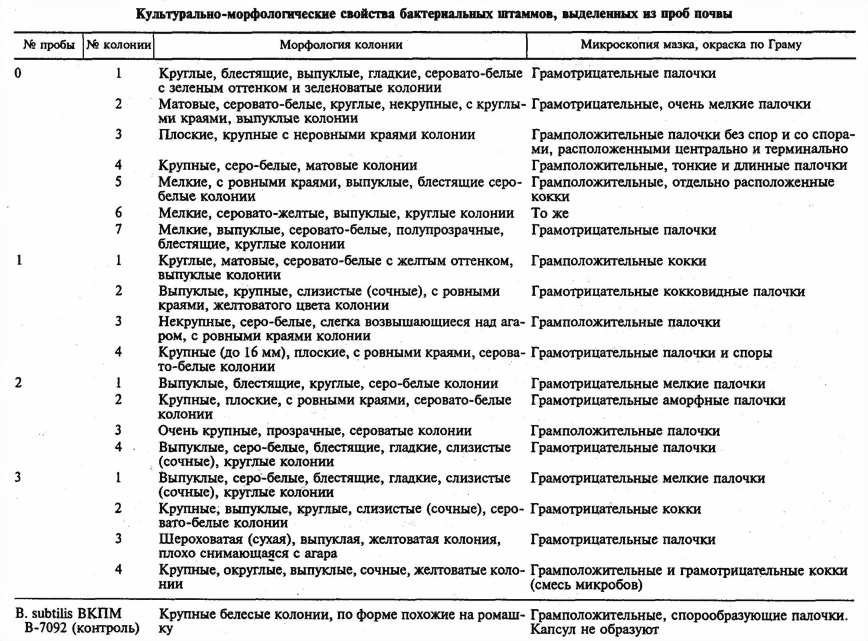
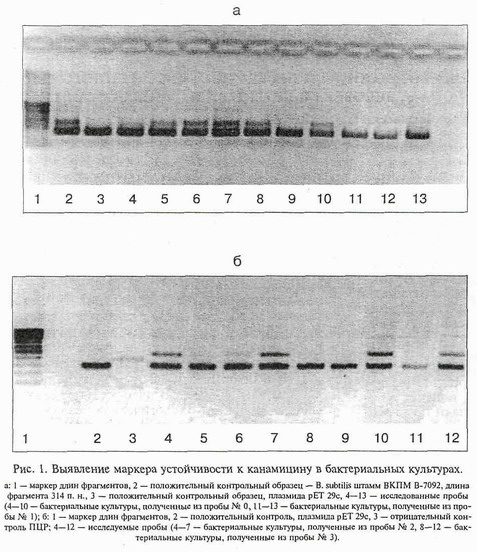
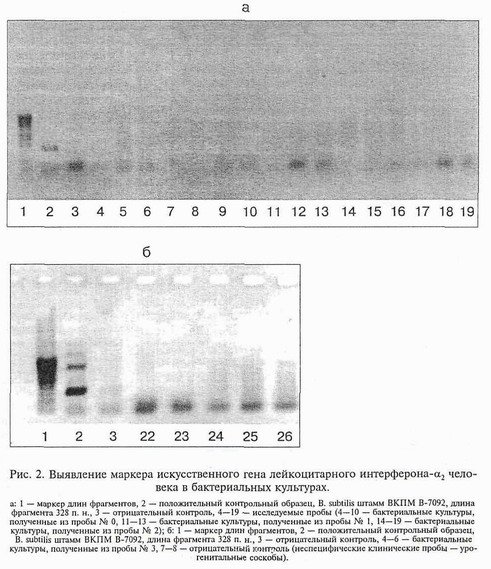
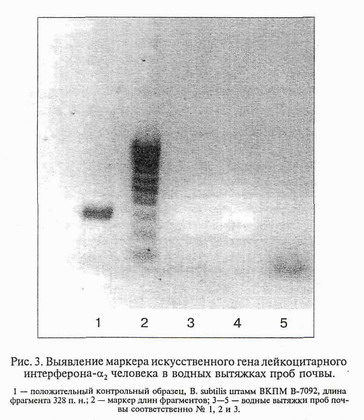
В результате проведенных исследований в местах потенциального попадания ГИММ в окружающую среду было выделено 19 бактериальных культур. В таблице представлены некоторые их культурально-морфологические свойства. Результаты анализа исследованных образцов ДНК методом ПЦР приведены на рис. 1 и 2. На рис. 3 представлены результаты исследования водных вытяжек проб почвы № 1, 2 и 3.
.
Из 19 видов канамициноустойчивых бактериальных культур (см. табл.) 7 выделены из проб почвы с участка земли СПК "Рогалевское". В этом хозяйстве для профилактики и лечения животных никогда не применяли пробиотик ВЕТОМ 1.1. Из проб почвы АОЗТ "Кирзинское", где указанный пробиотик использовали от 1 года до 8 лет, было выделено по 4 вида бактериальных культур. Изучение 19 выделенных бактериальных культур по основным культурально-морфологическим признакам [11] не выявило наличия среди них культуры В. subtilis ВКПМ В-7092.
Из представленных на рис. 1 данных следует, что в геномах клеток 19 выделенных бактериальных культур установлено наличие маркера гена канамицина. Полученные результаты, а также имеющиеся данные литературы свидетельствуют, скорее всего, о факте циркуляции в природных микробных популяциях генов устойчивости к канамицину, а также о факте широкой распространенности канамициноустойчивости как среди почвенных популяций, так и среди микрофлоры желудочно-кишечного тракта животных [1,2, 13, 14]. Как видно на рис. 2, изученные бактериальные культуры не содержат маркера гена лейкоцитарного интерферона-α2 человека. Представленные на рис. 1—3 данные свидетельствуют об отсутствии среди 19 изученных культур бактерий В. subtilis ВКПМ В-7092, так как методом двухраундовой ПЦР с применением специфических праймеров не удалось выявить и идентифицировать среди них этот ГИММ.
Представленные на рис. 3 данные указывают на то, что исследованные пробы почвы из АОЗТ "Кирзинское" не содержат рекомбинантной плазмидной ДНК из лизировавшихся клеток ГИММ, которая могла бы сохраниться в почве на протяжении всего срока наблюдения (от 1 года до 8 лет).
Таким образом, экспериментальная оценка отдаленных последствий рисков интродукции ГИММ В. subtilis штамм ВКПМ В-7092 в окружающую среду при сроках наблюдения от 1 года до 8 лет показала, что в пробах почвы сельскохозяйственного предприятия, применявшего для лечения и профилактики заболеваний крупного рогатого скота пробиотик ВЕТОМ 1.1, методами первичной и точной идентификации не выявлены бактерии данного ГИММ. Интродукция В. subtilis штамм ВКПМ В-7092 в окружающую среду не привела к его неограниченному росту и распространению в почве. Экспериментальным путем было также показано отсутствие переноса из ГИММ В. subtilis штамм ВКПМ В-7092 плазмидных генов (гены лейкоцитарного интерферона-α2 человека) в другие виды микроорганизмов, распространенные в местах попадания этого ГИММ в окружающую среду (в почву). Не выявлено наличия в пробах почвы рекомбинантной плазмидной ДНК из лизировавшихся клеток указанного ГИММ.
ЛИТЕРАТУРА
1. Белявская В. А. Конструирование лечебно-профилактических препаратов на основе живых генетически модифицированных микроорганизмов: Дис. ... д-ра биол. наук. — Кольцово, 2000.
2. Белявская В. А-, Каштрова Т. А., Биндаренко В. М. и др. // Журн. микробиол. - 2001. - № 2. - С. L9-20.
3. Борисова М. П., Новоскольцева Т. М., Иренков И. П. и др. // Рыбоводство и рыболовство. — 2000. — № 2. — С. 15—20.
4. Бельков В, В. // Генетика. - 1994. - Т. 30, № 5. - С. 581— 592.
5. Дебабов В. Г. // Биотехнология. — 1992. — № 6. — С. 8—11.
6. Закон Российской Федерации "О государственном регулировании в области генноинженерной деятельности" (№ 86ФЗ от 05.07.96). - М., 1996.
7. Крылова Т. Ю.. Попова Л. Ю.г Печуркин Н. С. и др. // Микробиология. - 2000. - Т. 69, № 2. - С. 270-273.
S. Лабинская А. С. Микробиология с техникой микробиологических исследований. — М., 1978. 9. Лакин Г. Ф. Биометрия. — М., 1980.
10. Максимова Е. Е., Шпагина В. В., Попова Л. Ю. и др. // Микробиология. - 1998. - Т. 67, № 2. - С. 170-175.
11. Пат. РФ № 2142287. — 1997. Штаммы бактерий Bacillus subtilis и Bacillus Iicheniformis, используемые в качестве компонентов препарата против вирусных и бактериальных инфекций, и препарат на основе этих штаммов / Щелкунов С. Н., Петренко В- А., Рязанкина О. И. и др.
12. Попова Л. Ю., Каргатова Т. В., Максимова Е. Е., Белявская
B. А. // Микробиология. - 1997. - Т. 66, № 6. - С. 761-766.
13. Прозоров А. А. // Микробиология. — 1999. — Т. 68, № 5. —
C. 632-646.
14. Соракулова И. Б., Белявская В. А., Масычева В. И., Смирнов В. В. // Вестн. РАМН. - 1997. ~ № 3. - С. 46-49.
15. Справочник по микробиологическим и вирусологическим методам исследования / Под ред. М. О. Биргера. — М., 1982.
16. Щелкунов С. Н- Генетическая инженерия. — Новосибирск, 1997. - Ч. 2.
17. Birnboim Н. С, Doty J. Ц Nucleic. Acids Res. - 1979. -Vol. 7, N6. - P. [513-1522.
18. Recorbet G, Steinberg C, Faurie G. // FEMS Microbiol. Lett. - 1992. - Vol. 65, N 9. - P. 3763-3766.
19. Smit E., van Ebas J. D., van Veen J. А. // FEMS Microbioi. Rev. - 1992. - Vol. 88. - P. 263-278.
Поступила 20.02.04
EXPERIMENTAL EVALUATION OF POSSIBLE TRANSMISSION OF HUMAN cc-2 INTERFERON ARTIFICIAL GENE TO OTHER MICROORGANISM SPECIES
EA. Stavsky, O.N. Grishaeva, A.I. Lelyak, N.M. Larina, LA. Timuki-na, L.V. Mitko, R.S. Koval, V.V. Serebrov, I.V. Renau, O.V. Kultenko
Described within the case study are experimental evaluation data on the remote results of introduction of gene-engineered microorganisms (GEM) of the В-7092 В. subtilis strain into the environment with the follow-up ranging from 1 to 7 years. No bacteria of the above GEM were detected (among selected 19 bacterial cultures) in soil samples from an agricultural farm, where the VETOM I.I probiotic was used for the treatment and prevention of cattle; primary and precise identification (two-round PCR with specific primers) was applied. The introduction of the В-7092 В. subtilis strain into the environment did not result in its unlimited growth and proliferation in soil. No transfer of plasmid genes (genes of leukocytic human a-2 interferon) from the B-7092 B. subtilis strain GEM to microorganism species available in the environment (soil) was registered. No recom-binant plasmid DNA from lysed GEM cells was detected in soil samples.
Оригинал статьи (pdf)







