М.Ш. Акбаев – доктор ветеринарных наук, профессор, заведующий кафедрой паразитологии МГАВМиБ им. К.И. Скрябина;
С.Б. Ромашкин – заместитель главного госветинспектора Московской области;
Т.П. Крылова – главный госветинспектор Домодедовского района Московской области
Испытание пробиотика Ветом 1.1 с целью профилактики и лечения диареи телят
Общеизвестно, что весьма уязвимым возрастом для крупного рогатого скота является ранний период его постнатального развития, когда от заболеваний желудочно-кишечного канала ЖКК) новорожденных телят хозяйства несут значительный экономический ущерб (Сидоров М.А., 1987, Федоров Ю.Н. 1996, Каврук Л.С., Попов Н.И., Малахов Ю.А., Тугаринов О.А. и др., 2001).
Это связано с рядом объективных причин. Одним из основных факторов в возникновении желудочно-кишечных болезней телят первых дней жизни, является нарушение зоотехнических норм содержания и правил кормления, а также не выполнение специальных ветеринарных и санитарных требований на животноводческих фермах.
В связи с широким применением антибиотиков и распространением антибиотикоустойчивости у многих видов бактерий, практический интерес вызывает использование в животноводстве альтернативных средств, в частности пробиотиков, бактериофагов и др..
С этой целью в основном используется технологическая микрофлора, к которой относятся молочнокислые микроорганизмы и их рекомбинанты, а также бифидобактерии.
В научном мире нередко определяют понятие “пробиотик” как антоним антибиотиков (M. Vanbelle et all, 1990).
В наших опытах для профилактики и лечения диареи и дисбактериоза у телят мы применяли пробиотик Ветом 1.1, изготовляемый научно – производственной фирмой “Исследовательский центр”, Новосибирской области.
Действующим компонентом Ветома 1.1 являются бактерии Basillus subtilis (штамм ВКПМ В-7092) трансформированные плазмидой РВМВ 105, способные продуцировать человеческий лейкоцитарный альфа-2-интерферон.
Материалы и методы
Испытание эффективности Ветом 1.1 для профилактики и лечения диареи телят, проводили в период с сентября 2001 года по январь 2002 года в трех хозяйствах: АО “Барыбино” Домодедовского района, ЗАО “Знамя Подмосковья” Подольского и ЗАО Племзавод “Островецкий” Раменского районов Московской области.
В опытах было использовано 65 телят от 1 до 12-и дневного возраста. Из них Ветом 1.1 получали с целью профилактики диареи 41, а для лечения 24 теленка. С профилактической целью пробиотик давали с молозивом или физиологическим раствором с первого дня жизни в течение 10-12 суток, а с лечебной целью – при наличии диареи. Ежедневно у телят учитывали параметры клинического состояния: температуру тела, пульс и дыхание, состояние видимых слизистых оболочек, шерстного покрова, характер приема молока, частоту дефекации и консистенцию фекалий.
Для определения состава микрофлоры желудочно-кишечного канала исследовали фекалии и кровь от трех групп телят (больных, леченных Ветомом 1.1 и “здоровых”) по 6 голов в каждой группе.
Фекалии брали в стерильные пробирки и разводили в стерильном физиологическом растворе от 10-1 до 10-8. Из четырех диагностически значимых разведений (10-4 – 10-8) проводили посевы на дифференциально – диагностические среды (Эндо, Плоскирева). Для выделения сальмонелл использовали среду накопления, висмут – сульфитный агар и среду Плоскирева.
Для первичной идентификации выделенные культуры отсевали на трехсахарный агар с мочевиной по Олькеницкому. Для идентификации лакто- и бифидобактерий – на среду Блаурокка и МРС-2.
Гемолитические свойства выделенных культур определяли на 5%-м кровяном агаре.
Патогенность культур изучали на белых мышах по общепринятой методике.
У телят этих групп брали кровь для определения показателей естественной резестентности и иммунологической реактивности.
Для оценки клеточных и гуморальных факторов естественной резестентности были использованы методы, описанные в “Методических рекомендациях по тестированию естественной резестентности телят” Емельяненко П.А. с соавт. (1980 год). При этом определяли иммуноглобулины классов G и М методом радиальной иммунодиффузии, уровень лизоцима – по степени литической активности сыворотки крови в отношении Micrococcus lisodeikticus, бактерицидную активность – по степени подавления роста тест – микроба E. coli 020 испытуемой сыворотки крови, а также функциональную активность нейтрофильных лейкоцитов периферической крови. Для оценки клеточных факторов иммунной системы определяли абсолютное и относительное количество Т- и В – лимфоцитов методом выделения общей популяции в градиенте плотности фекол-верографина 1,076-1,077 с последующим разделением лимфоцитов с помощью видовых антииммуноглобулиновых сывороток по Эрнсту Л.К. с соавторами (1998 год).
Результаты исследований
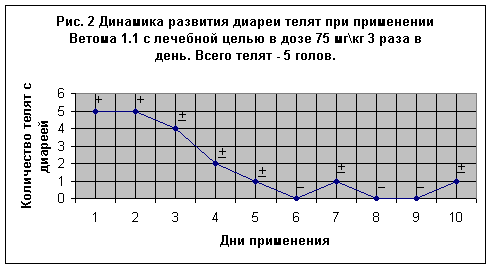
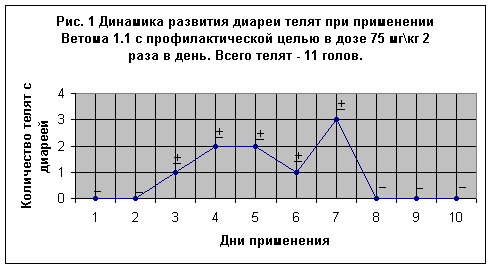 В АО “Барыбино” при летнем лагере в сентябре 2001 года был поставлен опыт № 1 на 16-и телятах. Первая группа включала 11 новорожденных телят, которые получали пробиотик с момента рождения в течение 10-и суток с профилактической целью в дозе 75 мг\кг массы тела 2 раза в день (утром и вечером). Первую дозу молозива с пробиотиком давали из бутылочки с диаметром отверстия соска не более 2 мм. (Рис 1). Вторая группа состояла из 5-и телят 3-5 суточного возраста с признаками диареи, которые получали Ветом 1.1 в течение 11 суток с лечебной целью в дозе 75 мг\кг 3 раза в день (утром, в полдень и вечером) Рис. 2.
В АО “Барыбино” при летнем лагере в сентябре 2001 года был поставлен опыт № 1 на 16-и телятах. Первая группа включала 11 новорожденных телят, которые получали пробиотик с момента рождения в течение 10-и суток с профилактической целью в дозе 75 мг\кг массы тела 2 раза в день (утром и вечером). Первую дозу молозива с пробиотиком давали из бутылочки с диаметром отверстия соска не более 2 мм. (Рис 1). Вторая группа состояла из 5-и телят 3-5 суточного возраста с признаками диареи, которые получали Ветом 1.1 в течение 11 суток с лечебной целью в дозе 75 мг\кг 3 раза в день (утром, в полдень и вечером) Рис. 2.
Как видно из Рис. 1 все 11 новорожденных телят не имели в первые двое суток каких-либо признаков отклонений от физиологических норм (на рисунке отмечены знаком -). Температура тела в пределах (38,9-39,2) оС, пульс до 131, дыхание до 40, слизистые бледно – розового цвета, шерстный покров гладкий блестящий, кал кашицеобразный, желтоватого цвета. Тем не менее на третий день у одного теленка, а на 4-й и 5-й дни у двух телят отмечали слабые признаки диареи. Фекалии были несколько размягчены, цвет мало изменен (на рисунке телята отмечены знаком +). Однако на 2-й день, с начала нарушения функций ЖКК, состояние этих телят приходило в норму. На 6-е и 7-е сутки (у одного из трех телят соответственно) снова было отмечено размягчение фекалий, которые на 8-е и 9-е сутки нормализовались. В среднем температура тела составляла 38,8 оС.
 Таким образом, из числа 11-и телят, получавших пробиотик с целью профилактики, заболевших телят с выраженными признаками диареи не было зарегистрировано. Температура тела в среднем по группе составляла 39,01 оС.
Таким образом, из числа 11-и телят, получавших пробиотик с целью профилактики, заболевших телят с выраженными признаками диареи не было зарегистрировано. Температура тела в среднем по группе составляла 39,01 оС.
На Рис. 2 представлены данные больных телят в возрасте 3-5 суток, которые имели клинические признаки диареи различной степени тяжести (на рисунке отмечено знаком +). Выделения были жидкие с заметным гнилостным запахом, желтовато-зеленоватого цвета, при этом аппетит был сохранен. У двух телят диарея протекала в более легкой форме, температура тела составляла в среднем 39,05 оС (до начала применения пробиотика телята получали антибиотики).
С начала применения пробиотика, в дозе 75 мг\кг массы тела 3 раза в день, профузная диарея прекратилась лишь на 3-и сутки. Выделения стали кашецеобразными, а у одного теленка фекалии полностью нормализовались. В дальнейшем слабый понос был отмечен у 2-х телят на 4-е сутки и по одному теленку на 5, 7 и 10-е сутки. У всех телят диарея прекращалась на 2-й день. Следует отметить, что в дни применения Ветом 1.1 телята охотно принимали молоко, общее состояние было удовлетворительное. Температура тела по группе телят в среднем составила 39,04 оС.
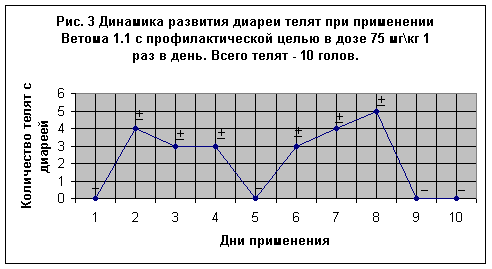
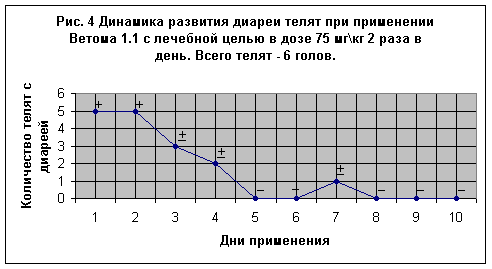
Опыт № 2 был проведен параллельно первому в том же хозяйстве “Барыбино” на ферме “Лобаново” на 16-и новорожденных телятах, из которых 10 телят получали пробиотик с целью профилактики в дозе 75 мг\кг 1 раз в день (Рис. 3), а 6-и телятам препарат давали с лечебной целью в той же дозе 2 раза в день (Рис. 4). Телята содержались в типовом помещении, в первые 11 суток опытов индивидуально в отдельных клетках. Ветом 1.1 с профилактической целью применяли с молозивом и молоком.
Правда на 2-й день опыта из 10-и телят у 4-х отмечали слабый понос (фекалии несколько размягчены, что отмечено знаком +). Такого рода слабое расстройство функции ЖКК обнаруживали и в дальнейшем у отдельных телят, которое полностью прекратилось на 9-е сутки с начала опытов.
 Следует подчеркнуть, что у большинства телят, после приема молозива отмечается разжижение фекалий, которое, как правило, прекращается через сутки. В целом из этой группы телят, получавших пробиотик с целью профилактики, слабую диарею устанавливали в течение 1-2-х суток. Общее состояние телят на конец опыта было удовлетворительным. Во время опытов антибиотики не применяли. Аппетит был сохранен, температура тела в пределах физиологической нормы, шерстный покров блестящий.
Следует подчеркнуть, что у большинства телят, после приема молозива отмечается разжижение фекалий, которое, как правило, прекращается через сутки. В целом из этой группы телят, получавших пробиотик с целью профилактики, слабую диарею устанавливали в течение 1-2-х суток. Общее состояние телят на конец опыта было удовлетворительным. Во время опытов антибиотики не применяли. Аппетит был сохранен, температура тела в пределах физиологической нормы, шерстный покров блестящий.
Вторая группа состояла из 6-и телят (Рис. 4) в возрасте от 2-х до 4-х суток (два теленка 2-х дневного возраста, четыре – 6-и дневного). В день начала применения препарата у всех телят, в особенности у 4-х, отмечали диарею, протекавшую в тяжелой форме (на рисунке отмечено знаком +). Однако после применения препарата общее состояние у 2-х телят улучшилось и диарея прекратилась через 2 дня. У 4-х телят с тяжелой формой диареи, признаки диареи прекратились через 3 дня. В последующие дни у телят признаков расстройства ЖКТ не было отмечено, общее состояние оставалось удовлетворительным, температура тела в пределах физиологической нормы.
Аналогичный опыт № 3 был нами проведен на 20-и телятах в ЗАО “Знамя Подмосковья” в октябре 2001 года из них 12 телят, по 6 в каждой группе, получали Ветом 1.1 с целью профилактики в дозе 50 мг\кг. При этом, одна группа получала препарат один раз в день, а другая группа – один раз раз в два дня в течение 10-и дней. Остальные 8 телят были больные и пробиотик получали с лечебной целью 2 раза в день в дозе 50 мг\кг.
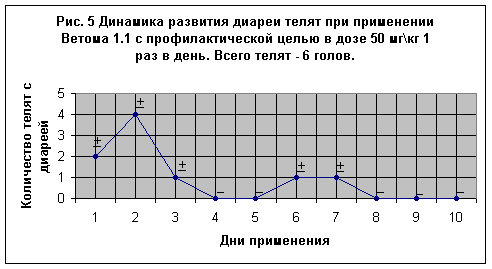
На Рис. 5 представлены результаты применения пробиотика 6-и телятам один раз в день. При этом 4-е клинически здоровых теленка (№№ 77, 200, 201, 202) препарат получали в первую выпойку молозива в дозе 50 мг\кг 1 раз в день в течение 10-и суток. В дальнейшем, у 2-х телят (№№ 200 и 201) после выделения первородного кала, фекалии на 2-й, а у теленка № 200 и на 3-й день оказались несколько разжиженными. У теленка № 77 диарея в легкой форме была отмечена на 6-е и 7-е сутки. Два теленка № 227 и 349 однодневного возраста, в день применения препарата поносили, хотя выделения были не жидкими, а телята были активными. На 2-е сутки после дачи препарата фекалии заметно сформировались и далее полностью нормализовались.
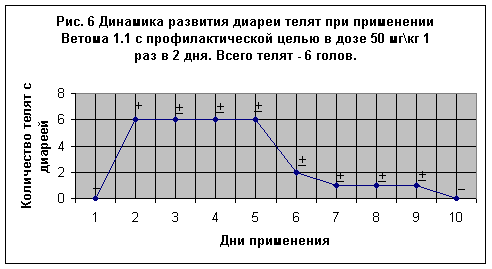
На Рис. 6 представлены данные применения Ветома 1.1 6-и клинически здоровым телятам, которым после рождения давали пробиотик с первой порцией молозива в дозе 50 мг\кг 1 раз в 2 дня в течение 10-и суток. Как видно из рисунка у всех 6-и телят на 2-е сутки после дачи пробиотика отмечалась диарея, при этом аппетит сохранялся. На 3-5 сутки выделения у телят имели кашецеобразную консистенцию. На 6-е сутки у 4-х телят диарея прекратилась и только у двух она продолжалась. В последующие трое суток только у телят №№ 102, 125, 174, 186 фекалии имели разжиженную консистенцию в течение суток. К концу опыта все телята были активными, молоко принимали охотно, шерстный покров был блестящим, фекалии сформированы.
Таким образом, применение пробиотика по схеме 1 раз в 2 дня оказалось не достаточно эффективным.
На Рис. 7 представлены результаты лечения 8-и телят в возрасте 2-3 суток, имевших к началу опыта явно выраженные клинические признаки диареи. Из них у 4-х животных (№№ 2256, 5481, 5486, 5488) фекалии имели примесь крови, а у теленка № 5482 дополнительно диагностировали острую катаральную бронхопневмонию. Пробиотик задавали с молоком 2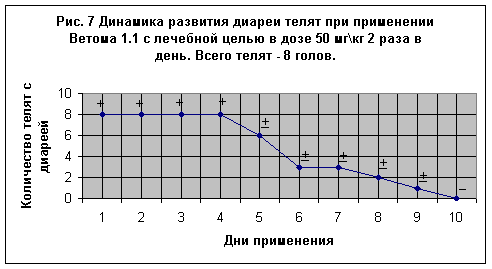 раза в день в дозе 50 мг\кг. На 4-й день с начала опыта у 3-х телят фекалии стали более густой консистенции, частые позывы дефекации прекратились, а на 5-7 день диарея у телят №№ 2256, 5486, 5487 отсутствовала. У теленка № 5485 улучшение общего состояния наступило на 5-й день лечения, у № 5488 – на 7-й день, у № 5489 – на 6-й день лечения. У теленка № 5482 улучшение наступило к концу 6-го дня, но через день диарея вновь возобновилась в слабой форме и на 9-е сутки теленок пал (паталогоанатомический диагноз – острая катаральная бронхопневмония). В целом у всех телят общее состояние улучшилось на 7-8-е сутки. Однако, как видно из рисунка, доза в 50 мг\кг при двухкратной даче больным телятам не достаточно эффективна.
раза в день в дозе 50 мг\кг. На 4-й день с начала опыта у 3-х телят фекалии стали более густой консистенции, частые позывы дефекации прекратились, а на 5-7 день диарея у телят №№ 2256, 5486, 5487 отсутствовала. У теленка № 5485 улучшение общего состояния наступило на 5-й день лечения, у № 5488 – на 7-й день, у № 5489 – на 6-й день лечения. У теленка № 5482 улучшение наступило к концу 6-го дня, но через день диарея вновь возобновилась в слабой форме и на 9-е сутки теленок пал (паталогоанатомический диагноз – острая катаральная бронхопневмония). В целом у всех телят общее состояние улучшилось на 7-8-е сутки. Однако, как видно из рисунка, доза в 50 мг\кг при двухкратной даче больным телятам не достаточно эффективна.
Опыт № 4 был проведен в ЗАО Племзавод “Островецкий” Раменского района в декабре 2001 года на 13 телятах, из которых 5 (в возрасте 2-3 суток) имели признаки диареи, а 8 новорожденных телят – клинически здоровые.
Новорожденные телята имели живую массу 30-35 кг, крепкую конституцию, хорошо развитый сосательный рефлекс. Пробиотик получали в дозе 50 мг\кг 1 раз в день с первой порцией молозива. С начала дачи препарата (Рис. 8) на 2, 4, 5, 7-й дни у отдельных телят (по
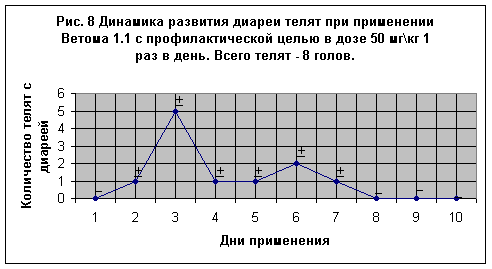 одному теленку в день) было отмечено незначительное разжижение фекалий, которые нормализовались на следующий день. На 3-й день у 5-и телят и на 6-й день у 2-х телят были отмечены признаки диареи. В дальнейшем, на 8-10 дни, телят с признаками нарушения функции ЖКК не было обнаружено. Все телята клинически были здоровыми.
одному теленку в день) было отмечено незначительное разжижение фекалий, которые нормализовались на следующий день. На 3-й день у 5-и телят и на 6-й день у 2-х телят были отмечены признаки диареи. В дальнейшем, на 8-10 дни, телят с признаками нарушения функции ЖКК не было обнаружено. Все телята клинически были здоровыми.
5 телят с выраженными признаками диареи (Рис. 9) пробиотик получали в дозе 50 мг\кг 2 раза в день. Через день после применения пробиотика диарея в слабой степени была отмечена у 1-го теленка, на 3-й и 4-й дни у 2-х телят соответственно, на 5-й – у одного теленка и на 6-й день у 2-х животных наблюдали разжижение фекалий. К 7-у дню жизни у всех телят наступало выздоровление.
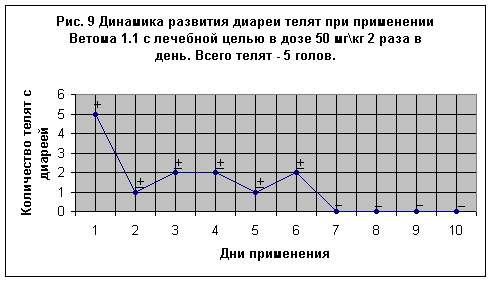
Если рассмотреть данный опыт в целом, то можно отметить, что клиническое выздоровление телят, больных диареей, происходило через день после начала дачи препарата. Такого рода быстрое выздоровление телят можно объяснить тем, что диарея у телят протекала преимущественно в легкой форме (не было отмечено обилие слизи, следов крови, телята имели хороший аппетит, температура тела была в пределах 38,9 оС).
Для определения состава и свойств микрофлоры содержимого ЖКК у телят, мы провели исследование 18-и проб фекалий от 6-и больных телят, 6 подвергнутых лечению пробиотиком и 6 “клинически здоровых”.
3.10.01 года было проведено исследование 6-и проб фекалий от больных телят (11-12 суточного возраста) с явно клиническими признаками диареи. Телята в день исследования получали антибиотики. Фекалии были жидкой консистенции с характерным зловонным запахом, желтовато-зеленоватого цвета. Из всех 6-и проб в разведении 107 выделяли культуры энтеропатогенных E. сoli, которые образовывали зону гемолиза на 5% кровяном агаре. Все выделенные культуры были патогенными для белых мышей (гибель наступала на 2-е сутки). Из 2-й и 3-й пробы, кроме того, выделяли Klebsiella pneumoniae, а из 3, 4 и 6 проб – Proteus vulgaris и Proteus mirabilis в разведении 10-6 – 10-7.
Bifidobacterium bifidum в разведении 10-1 устанавливали в виде следов, а молочнокислые бактерии были выявлены только в разведении 10-3 (при норме бифидо- и лактобактерии выделяются в разведениях фекалий 10-7-10-8). Из всех проб были выделены граммотрицательные кокки.
Таким образом, высокое содержание энтеропатогенной кишечной палочки в ассоциации с протеем и клебсиеллой, на фоне низкого содержания нормальной (полезной) микрофлоры, вызывает диарею у телят.
24.10.01 года были исследованы 6 проб фекалий от телят, леченных Ветомом 1.1, в возрасте 10-12 суток. В день взятия проб фекалий, диареи у телят не было выявлено. Фекалии разводили от 10-1 до 10-8 и проводили посев на дифференциально – диагностические среды и 5% кровяной агар. На плотных питательных средах в разведениях 10-1 – 10-4 выделяли незначительное количество колоний, а из разведений 10-6 - 10-8 роста микрофлоры не было обнаружено. Из всех проб на среде Эндо выделяли колонии E. coli, не обладающие гемолитическими свойствами при росте.
На висмут – сульфитном агаре культуры образовывали колонии темно – коричневого цвета без металлического блеска и мелкие светлые колонии. Из всех полученных проб отбирали изолированные колонии с ровными краями и окрашивали их по Грамму. В мазках преобладали граммотрицательные палочки, которые располагались единично, редко цепочками или попарно. Обнаруживали граммположительные кокки в незначительном количестве. Патогенность определяли путем заражения белых мышей суточными бульонными культурами. Все выделенные культуры оказались не патогенными.
Таким образом, из проб фекалий телят, подвергнутых лечению пробиотиком, были выделены непатогенная E. coli, кокки и стрептококки.
19.12.01 года были исследованы 6 проб фекалий от “клинически здоровых” телят. Пробы были доставлены из хозяйства ЗАО Племзавод “Островецкий”, где отход телят от заболеваний ЖКК регистрируется редко. Но, тем не менее, фекалии от телок №№ 1892, 1891, бычка № 8 были разжиженной консистенции, а бычка № 10 и телок №№ 1879, 1890 – плотной.
В день взятия проб фекалий телята были активными, молоко принимали охотно, температура тела находилась в пределах физиологической нормы, шерстный покров блестящий. Фекалии у телят №№ 8, 1891, 1892 имели гнилостный запах.
Пробы фекалий разводили от 10-1 до 10-8, и из каждой пробирки высевали на дифференциально – диагностические среды (Эндо, Плоскирева). Из разведения фекалий 10-1 проводили посев на среду накопления по 1 см3, а для выделения бифидо- и лактобактерий использовали среды Блаурокка и МРС-2. Из среды накопления делали посев на висмут – сульфитный агар.
В результате было выявлено, что у телят под №№ 10, 1879, 1890 выделена E. coli, Kl. pneumoniae, а в пробе № 10 – сальмонеллы. Однако среди этих культур патогенных штаммов не было установлено. При этом, содержание бифидо- и лактобактерий оказалось в норме.
Что же касается показателей телят под №№ 8, 1891, 1892, то у них были выделены энтеропатогенные штаммы E. coli, P. mirabilis, Kl. pneumoniae. В пробе фекалий теленка № 1892 была идентифицирована Pseudomonas aeruginosa (синегнойная палочка). С характерным пигментом зеленого цвета и патогенная для белых мышей. Содержание бифидо- и лактобактерий было незначительным.
Таким образом, хотя эти три теленка внешне были клинически здоровы, но фактически оказались источником возбудителя инфекции.
Исследование крови 1-ой группы телят больных диареей (Таблица 1) показало, что фагоцитарная реакция нейтрофилов была весьма интенсивной, что свидетельствует об ответной реакции организма на проникновение инфекционного фактора. Об этом свидетельствуют достаточно высокие показатели уровня гуморальных факторов (Таблица 2), иммуноглобулина G в особенности, и как следствие – высокие показатели бактерицидной активности сыворотки крови, как суммарной реакции, отражающей состояние естественной резистентности. Из Таблицы 1 видны высокие значения Т- и В- лимфоцитов, ответственных за клеточные и гуморальные факторы резистентности, что также указывает на значительный воспалительный процесс. Все это свидетельствует о том, что телята больны и это подтверждается наличием у них жидких фекалий и соответственного микробного фона.
Показатели клеточных факторов естественной резестентности и иммунологической реактивности телят.
Таблица 1
|
№ п\п |
Фагоцитарная активность |
Т - лимфоциты |
В - лимфоциты |
||||
|
|
% фагоцитоза |
Индекс фагоцитоза |
% переваривания за 30 минут |
Абсолютное количество, тыс\мкл |
Относительное количество, % |
Абсолютное количество, тыс\мкл |
Относительное количество, % |
|
1 |
84 |
2,12 |
22 |
1,65 |
73,33 |
0,6 |
26,67 |
|
2 |
72 |
1,96 |
32 |
1,45 |
78,37 |
0,4 |
21,63 |
|
3 |
56 |
0,8 |
27,5 |
1,7 |
82,92 |
0,35 |
17,08 |
|
4 |
68 |
1,2 |
24 |
1,15 |
74,19 |
0,4 |
25,81 |
|
5 |
72 |
1,68 |
37,3 |
1,1 |
75,86 |
0,35 |
24,14 |
|
6 |
80 |
2,72 |
8,4 |
1,7 |
85 |
0,3 |
15 |
|
Среднее значение |
72+3,65 |
1,75+0,25 |
25,2+3,7 |
14,6+0,1 |
78,28+1,78 |
0,4+0,04 |
21,72+1,77 |
|
1 |
32 |
0,48 |
11 |
1,75 |
71,42 |
0,7 |
28,58 |
|
2 |
24 |
0,32 |
12 |
1,65 |
71,43 |
0,65 |
28,27 |
|
3 |
36 |
0,48 |
13,3 |
1,5 |
65,9 |
0,75 |
34,1 |
|
4 |
36 |
0,56 |
17 |
1,15 |
65,71 |
0,65 |
34,29 |
|
5 |
40 |
0,6 |
22,6 |
1,3 |
68,42 |
0,6 |
31,58 |
|
6 |
28 |
0,32 |
20 |
1,7 |
72,34 |
0,65 |
27,66 |
|
Среднее значение |
32,7+2,2 |
0,46+0,046 |
16+1,74 |
1,51+0,07 |
69,25+1,12 |
0,66+0,019 |
30,75+1,12 |
|
1 |
96 |
4,01 |
17 |
2,25 |
72,5 |
0,85 |
27,5 |
|
2 |
84 |
3,5 |
0,7 |
2,2 |
75 |
0,75 |
27,3 |
|
3 |
56 |
0,72 |
33 |
1,8 |
75 |
0,6 |
25 |
|
4 |
80 |
1,44 |
15 |
1,95 |
68,42 |
0,9 |
31,58 |
|
5 |
88 |
5,56 |
20 |
2,3 |
74,19 |
0,8 |
25,81 |
|
6 |
84 |
3,12 |
17 |
1,85 |
68,5 |
0,85 |
31,5 |
|
Среднее значение |
81,3+5,08 |
3,06+0,72 |
17+3,64 |
2,03+0,08 |
72,3+1,2 |
0,79+0,04 |
28,12+1,05 |
Ко второй группе относились телята, леченные пробиотиком Ветом 1.1 в течение 10-11 суток. Как видно из Таблиц 1 и 2 по состоянию имунного статуса, практически все показатели естественной резистентности значительно снижены по сравнению с первой группой и близки к норме. Достаточно высокие значения В-лимфоцитов ответственных за гуморальный иммунитет, свидетельствуют о наличии значительного титра антител, выработанных организмом телят этой группы за время болезни. По всем показателям эта группа животных находится в самом благоприятном клиническом состоянии, так как применение Ветома 1.1 дало заметно хорошие результаты.
Весьма неоднозначными оказались эти же показатели крови у 3-й группы “клинически здоровых” телят из ЗАО Племзавод “Островецкий”. Хотя в день взятия крови эти телята были оценены как здоровые, показатели фагоцитоза, лизоцима и бактерицидной активности (Таблицы 1 и 2) оказались повышенными. То же самое можно сказать и об иммуноглобулинах G и М. Увеличены и показатели Т и В – лимфоцитов (правда, встречаются несколько низкие показатели у 2-х телят). Создается впечатление, что эти животные находятся еще на стадии выздоровления и процесс ответной реакции организма на инфекцию еще не прошел. Поэтому говорить о состоянии животных как о здоровых – преждевременно.
Показатели гуморальных факторов сыворотки крови телят.
Таблица 2
|
№ п\п |
Лизоцим | Бактерицидная активность | Иммуноглобули
ны |
||||||
| D, мм | С колиб. | С, мкг\мл | Д1 | Д2 | Дельта Д | БАСК, % | Ig G, мг\мл | Ig M, мг\мл | |
|
1 |
10 | 27,5 | 127,5 | 0,118 | 0,123 | 0,005 | 89,79 | 25 | 3,8 |
|
2 |
8 | 5,2 | 26 | 0,143 | 0,165 | 0,022 | 55,1 | 18,6 | 2,45 |
|
3 |
7,5 | 3,5 | 17,5 | 0,118 | 0,118 | 0 | 100 | 14 | 1,6 |
|
4 |
7,5 | 3,5 | 17,5 | 0,128 | 0,128 | 0 | 100 | 15,2 | 1,85 |
|
5 |
6,5 | 1,5 | 7,6 | 0,135 | 0,14 | 0,005 | 89,79 | 17,2 | 2,45 |
|
6 |
7 | 2,25 | 11,25 | 0,125 | 0,13 | 0,005 | 89,79 | 12 | 1,6 |
|
Среднее значение |
|
|
15,43+2,39 |
|
|
|
87,42+6,19 | 17+1,7 | 2,3+0,3 |
|
1 |
6,8 |
1,8 |
9 |
0,12 |
0,175 |
0,055 |
0 |
12 |
2,5 |
|
2 |
7 |
2,25 |
11,25 |
0,158 |
0,184 |
0,026 |
46,9 |
16,4 |
3,2 |
|
3 |
6,8 |
1,8 |
9 |
0,148 |
0,19 |
0,042 |
14,28 |
15,2 |
1,6 |
|
4 |
6 |
1 |
5 |
0,14 |
0,19 |
0,05 |
0 |
10,8 |
1,6 |
|
5 |
6 |
1 |
5 |
0,153 |
0,202 |
0,049 |
0 |
16,4 |
2,5 |
|
6 |
6 |
1 |
5 |
0,133 |
0,182 |
0,049 |
0 |
15,2 |
2,5 |
|
Среднее значение |
|
|
7,38+1,02 |
|
|
|
|
14,33+0,88 |
2,32+0,19 |
|
1 |
6 |
1 |
5 |
0,248 |
0,26 |
0,012 |
57,1 |
18,6 |
3,2 |
|
2 |
7 |
2,2 |
11 |
0,242 |
0,256 |
0,014 |
50 |
12 |
2,5 |
|
3 |
7 |
2,2 |
11 |
0,274 |
0,282 |
0,04 |
85,7 |
12 |
2,5 |
|
4 |
7,5 |
3,9 |
19,5 |
0,54 |
0,0,56 |
0,02 |
28,6 |
6 |
1,6 |
|
5 |
8 |
5,2 |
26 |
0,278 |
0,296 |
0,018 |
35,7 |
9,8 |
2,5 |
|
6 |
8 |
5,2 |
26 |
0,254 |
0,288 |
0,034 |
0 |
6 |
1,6 |
|
Среднее значение |
|
|
16,42+2,9 |
|
|
|
42,85+10,28 |
10,73+1,75 |
2,32+0,19 |
Заключение
Нарушение функций ЖКК у новорожденных телят является одной из основных проблем в условиях Нечерноземья. Практически каждый теленок после рождения переболевает в той или иной степени заболеваниями с признаками диареи. Из-за этого в первые 12 – 20 суток жизни телята, как правило, резко худеют, отстают в росте и развитии. Если за это время не принимать действенные меры по предупреждению болезни, то происходит задержка роста и развития, что приводит к формированию неполноценного стада.
К сожалению, среди ученых и практических работников в области животноводства, долгие годы не было искреннего понимания, и суть вопроса оставалась до конца не выясненной. Более 25 лет, с 60-х годов прошлого века, в научном мире страны превалировала теория о причинах возникновения диареи, зависящих только от неправильного кормления и содержания животных. Другая сторона проблемы – инфекция, оставалась в тени. Хотя известно давно, что организм животного, при любом типе кормления и содержания, служит средой обитания для всех биологических агентов: бактерий, вирусов, грибов, паразитов и др..
В настоящее же время, превалирует другая сторона проблемы, где причиной диареи являются бактерии и вирусы.
Как ветеринарные врачи, имея значительный стаж и опыт работы с крупным рогатым скотом, мы глубоко убеждены в том, что эти две указанные выше проблемы не отделимы друг от друга.
Если конкретно рассмотреть вопрос содержания и кормления крупного рогатого скота, в том числе и телят, то за исключением отдельных хозяйств, эти вопросы решаются крайне сложно. Во многих хозяйствах типовые родильные отделения отсутствуют, а имеющиеся приспособленные помещения непосредственно контактируют с коровниками. Ночное дежурство не везде налажено и родившиеся ночью телята, либо в коровнике, либо в приспособленных “родильных отделениях”, пребывают неоправданно долгое время, облизывая грязь и навоз. Коровники находятся в антисанитарном состоянии, а поверхность животных сильно загрязнена. Редким стало применение опилок и использование извести-пушонки в проходах между рядами коров. Что касается побелки стен и проведения периодической дезинфекции коровников и родильного отделения, то у многих специалистов эти вопросы вызывают полное равнодушие. В самих “боксах” и родильных отделениях, где пребывают новорожденные телята, сырость и грязь присутствуют постоянно.
Правда, можно указать положительные примеры выращивания телят, где заболевания ЖКК у новорожденных регистрируются существенно реже. А если и встречаются, то проходят в более легкой форме. Так, в ЗАО “Островецкий” Раменского района Московской области, главный ветеринарный врач Солдатов А.Н. долгие годы использовал выращивание телят холодным методом в индивидуальных домиках на открытой площадке с ранней весны до глубокой осени, где падеж телят происходит в редких случаях.
Весьма образцовым является хозяйство Племзавод “Русь” Домодедовского района Московской области. Руководство хозяйства строго соблюдает ветеринарно-санитарные условия, зоогигиенические и зоотехнические нормы кормления и содержания разновозрастных групп животных.
Что же касается кормления телят, то этот вопрос требует конкретного пересмотра в большинстве хозяйств Нечерноземья. Прежде всего, стельных коров необходимо переводить в запуск за 2 месяца до отела. Обязательным является исследование коров, пошедших запуск, на наличие мастита. Во всех хозяйствах необходимо проводить за 45-50 дней до отела вакцинацию против эшерихиоза и сальмонеллеза. При этом рекомендуется использование иммуномодуляторов (полиоксидоний, Т- и В-активин, левамизол, пробиотики и т.д.), согласно инструкции по их применению. Коров рекомендуется переводить в родильное отделение за 5-7 дней до отела, зная данные случного реестра. Предварительно поверхность коровы чистят, копыта обмывают. При входе в родильное отделение необходимо иметь коврики и дезбарьеры. Кроме того, при родильном отделении нужно иметь выгульные дворики, чтобы роженицы могли пользоваться регулярным моционом до родов и через 4-5 суток после родов. Весь период пребывания в родовом отделении составляет 25 суток.
Теленка после рождения следует кормить не позже 1-2 часов, подпустив к матери, после предварительного туалета вымени и сосков. Сдаивание первых струек молозива из сосков роженицы (с последующим обеззараживанием его) перед тем, как подпустить к ней теленка – обязательно. Следует подчеркнуть, что выпойка новорожденного теленка должна проходить в течение 12 минут.
Ранняя и неоднократная дача молозива (в целом около 5 литров) теленку не только обогащает организм колостральными антителами, но и регулирует состав микрофлоры ЖКК. Частота кормления телят в молозивный период имеет существенное значение в регуляции и формировании ферментной констеляции ЖКК. Исходя из этого, телят в молозивный период, следует поить по 4-5 раз в сутки.
Известно, что рост и развитие организма молодняка и его продуктивность, непосредственно связана с разнообразными функциями пищеварительного канала. Пищеварение как сложный физиологический процесс осуществляется в результате комплекса взаимосвязанных функций пищеварительных органов - моторной, секреторной, экскреторной и всасывательной. Поэтому нужно быть особо внимательным к вопросам кормления телят первые 20 дней жизни для обеспечения нормальной работы ЖКК.
В хозяйствах, где мы проводили опыты, телята были подвержены диарее в первый день жизни. Несмотря на выраженный понос, температура тела у телят находилась в пределах (38,5 – 39,0) оС, аппетит сохранен. Поэтому ставили диагноз диспепсия. Это подтверждалось тем, что эшерихиозом телята болеют в 3-10 суточном возрасте в зависимости от течения болезни, и характеризуется массовостью и высокой летальностью животных. Сальмонеллезом болеют телята от 10 суточного до 2 месячного возраста. При вирусных диареях болеют 7-12 дневные животные, хотя при ротавирусной инфекции болезнь может возникать у 1-2 суточных телят с летальностью 50%.
В последние годы многие исследователи считают, что острые кишечные заболевания телят в первые дни жизни вызываются преимущественно условно – патогенной микрофлорой (Спесивцева Л.Я., Воронин Е.С., с соавторами, 1989, 1991 года; Девришев Д.А. с соавторами, 1991-1999 года).
Учитывая результаты наших опытов и наблюдений, можно допустить, что телята болели диспепсией, возникшей на почве нарушения норм кормления и содержания, как кормов, так и телят. В последующем, при продолжающихся нарушениях условий содержания и кормления, а также несвоевременного лечения, телята могли подвергнуться влиянию условно патогенной микрофлоры, что усугубило течение диареи.
У группы из 6-и телят больных диареей, которых лечили антибиотиками, мы исследовали пробы фекалий и кровь. Установили, что у всех животных была выделена энтеропатогенная кишечная палочка. Кроме того, из двух проб были выделены еще Kl. pneumoniae, а из трех проб - P. vulgaris, P. mirabilis, в большом количестве. Что касается полезной микрофлоры, то Bifidobacterium bifidum была отмечена в виде следов, а лактобактерии обнаруживались в разведении 10-3. У этих же телят (Таблицы 1 и 2) было отмечено резкое повышение фагоцитоза по всем показателям, завышены значения Т и В- лимфоцитов и иммуноглобулинов.
Небезынтересны показатели исследований фекалий и крови телят, которые были представлены как от “здоровых животных”. При исследовании фекалий этих телят из трех проб были выделены энтеропатогенные штаммы E. coli, P. mirabilis, Kl. pneumoniae, из одной пробы еще и P. aeruginosa (синегнойная палочка), из трех проб были выделены только непатогенные штаммы E. coli и Kl. pneumoniae (из одной пробы еще и непатогенная сальмонелла).
Данные крови этих телят (Таблицы 2 и 4) оказались весьма близки с данными явно больных животных. Это указывает на то, что практически они были подвержены влиянию условно – патогенной микрофлоры и телятники, в которых они находились – неблагополучны.
В отличие от больных и “условно здоровых” телят, у животных с неярко выраженными признаками диареи и успешно пролеченных пробиотиком, показатели крови (Таблицы 2 и 3) находились в пределах физиологической нормы. Хотя повышенные значения В-лимфоцитов свидетельствуют о наличии титра антител, выработанных организмом животных на первичный контакт с условно-патогенной микрофлорой. При исследовании фекалией этих телят, нами не были обнаружены патогенные штаммы микроорганизмов. Что касается содержания лактобактерий и бифидобактерий, то оно оказалось в пределах физиологической нормы.
Из наших опытов видно, что у телят, получавших Ветом 1.1 с целью профилактики в первые часы кормления (Рис. 1, 5, 8) понос в легкой форме отмечался у отдельных животных лишь на 2-й день. При этом у большинства телят, расстройство ЖКК нормализовалось в тот же или на второй день. Причем наиболее эффективными оказались дозы 50 мг\кг 1 раз в день и 75 мг\кг 2 раза в день. Следует указать, что доза 50 мг\кг 1-2 раза в день дала примерно такие же результаты, что и 75 мг\кг 2 раза в день. Это мы объясняем тем, что ЗАО Племзавод “Островецкий”, где применяли дозу 50 мг\кг 1 раз в день, высокотехнологическое хозяйство с хорошо развитой кормовой базой и достаточно налаженной системой выращивания телят, где животные менее подвержены заболеваниям ЖКК.
Как показывает передовая наука в области медицины и ветеринарии, современное состояние здоровья населения страны, а в животноводстве – молодняка крупного рогатого скота, свиней и птиц требует широкого использования различного рода препаратов, для поддержания и восстановления иммунобиологического гомеостаза, и в первую очередь – пробиотиков (Рокия М., 1994; Воробьев О.В., 1997; Евсеева О.В., 1999; Каврук Л.С., Светоч Э.А., 1999 и др.).
Применение пробиотика Ветом 1.1 как с целью профилактики, так и для лечения, эффективно предотвращает нарушения ЖКК и оказывает благоприятное воздействие на организм телят.








