2. Хронофармакология пробиотиков при их применении здоровым животным
2.1. Хронобиологические особенности действия ветома 3 на морфологические показатели крови у здоровых мышей
Главный принцип превентивного применения лекарственных средств заключается в том, чтобы максимальная концентрация применяемых лекарств совпадала с акрофазой показателей. Этот принцип базируется на законе J. Wilder (1962), согласно которому та или иная функция тем слабее стимулируется и легче угнетается, чем исходно она сильнее активирована. Оптимизация времени введения лекарств основывается преимущественно на расчете времени, необходимом для создания максимальной концентрации препарата в крови ко времени развития определенного события (Комаров Ф.И. и соавт., 2000).
Эффективность превентивной хронотерапии наглядно была продемонстрирована у людей, больных эссенциальной гипертонией, в работах Л.Г. Хетагуровой (1991), Р.М. Заславской с соавт. (1991-1996), К.К. Токбаевой (1997). Использование гипотензивных препаратов разных фармакологических групп (α- и β-адреноблокаторов, клофелина, адельфана и др.) за 1,5-2 ч до установленной при первом биоритмологическом исследовании акрофазы систолического артериального давления и минутного объема сердца, позволяло достигнуть в более короткие сроки (в 2 раза) снижения артериального давления при применении меньших разовых, суточных и курсовых доз (в 2-3 раза) соответствующих препаратов, чем при традиционной терапии (Заславская Р.М., 1996). Превентивная хронотерапия гепарином и дезагрегантами оказалась более эффективной, чем традиционное лечение этими препаратами больных хроническим пиелонефритом и хронической почечной недостаточностью. Аналогичная закономерность превентивного действия гепарина и тренала на циркадианную ритмику гемостаза при инсулинзависимом сахарном диабете и синдроме диабетической нефропатии была выявлена А.И. Семеновой (1995).
Цель наших исследований заключалась в изучении хронофармакологических особенностей действия ветома 3 на морфологические показатели крови и интенсивность роста здоровых животных. Для реализации поставленной цели в виварии кафедры фармакологии и общей патологии Института ветеринарной медицины Новосибирского государственного аграрного университета были проведены опыты на мышах.
До начала эксперимента белых беспородных мышей (массой 18-20 г) в течение 5 суток адаптировали к условиям среды: свет с 7 до 22 ч, температура 18…20°С. Кормили дважды в день в 8 и 20 ч, воду давали ab libitum.
Животные по принципу аналогов были разделены на 5 опытных и контрольную группы по 12 в каждой. Мышам опытных групп назначали ветом 3 в дозе 50 мг/кг массы 2 раза в сутки вместе с кормом в различное время: в 1-й опытной группе – в 7 и 19 ч, 2-й – в 8 и 20 ч, 3-й – в 9 и 21 ч, 4-й – в 12 и 22 ч, 5-й – в 14 и 22 ч (табл. 1). Пробиотик назначали в течение 5 суток. Мышам из контроля препарат не применяли.
Для изучения действия препарата в динамике исследование крови и взвешивание мышей проводили перед началом опыта, на 6, 15 и 30-е сутки эксперимента. Кровь стабилизировали 10%-м раствором трилона Б.
Таблица 1. Схема опыта
| № гр. |
Тип группы |
Препараты |
Путь введения |
Дозы и кратность применения |
Время назначения |
|
1 |
Опытные |
Ветом |
Внутрь |
мгкгр в день |
7 и 19 ч. |
|
2 |
8 и 20 ч. |
||||
|
3 |
9 и 21 ч. |
||||
|
4 |
12 и 22 ч. |
||||
|
5 |
14 и 22 ч. |
||||
|
6 |
Контроль |
Не применяли |
|||
Морфологические исследования крови включали определение уровня эритроцитов и лейкоцитов (меланжерным способом с использованием камеры Горяева), гемоглобина (по Сали), скорости оседания эритроцитов (по Панчекову). Лейкограмму определяли по И.А. Болотникову (1980). С целью изучения хронофармакологических особенностей ростостимулирующего действия ветома 3 определяли абсолютный, среднесуточный и относительный приросты живой массы.
Временную организацию действия ветома 3 на показатели крови и живой массы животных изучали с помощью графически-параметрического метода анализа биологических ритмов (Романов Ю.А., 1979) и определяли следующие параметры: мезор – среднее значение показателей (фазы) за промежуток времени; акрофазу – момент крайнего отклонения фазы; активную (пассивную) фазы – значения фазы, лежащие выше (ниже) мезора; абсолютную амплитуду – разность между максимальным и минимальным значениями фазы; относительную амплитуду – отношение максимального к минимальному значению фазы; коэффициент синхронизации – отношение относительной амплитуды к промежутку времени между максимальным и минимальным значениями фазы (Комаров Ф.И., Рапопорт С.И., 2000).
Обработку данных проводили методами вариационной статистики с использованием программы «PGN-1.4». Достоверность результатов определяли с помощью критерия Стьюдента.
В результате проведенных исследований установлено, что до применения ветома 3 количество эритроцитов, лейкоцитов у мышей опытных и контрольной групп не имело достоверных различий и находилось в пределах физиологических норм, а количество гемоглобина и лимфоцитов было ниже физиологической нормы.
На 6-е сутки исследований у мышей 1–5-й опытных групп уровень эритроцитов в крови превышал аналогичный показатель животных контрольной группы на 3,6 (P<0,1), 1,4, 5,3 (P<0,1), 6,9 (P<0,05), 0,1% соответственно. По сравнению с исходными данными количество эритроцитов у животных 1–5-й опытных и контрольной групп увеличилось на 3,1; 3,2; 4,7; 6,3; 4,1 и 1,7% соответственно.
В активной фазе влияния ветома 3 на уровень эритроцитов на 6-е сутки исследований находились показатели 1, 3 и 4-й опытных групп ((9,38±0,11) 1012/л; (9,53±0,21) 1012/л; (9,67±0,10) 1012/л), которые превышали мезор ((9,36±0,25) 1012/л) на 0,2; 1,8 и 3,3% соответственно, в пассивной фазе находились показатели 2-й и 5-й опытных групп ((9,18±0,17) 1012/л; (9,05±0,20) 1012/л), которые были ниже мезора на 1,9 и 3,2% соответственно. Акрофаза влияния ветома 3 на уровень эритроцитов в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня эритроцитов 4-й опытной группы.
На 15-е сутки исследований содержание эритроцитов в крови мышей 1–5-й опытных групп было выше по сравнению с контролем на 7,0 (P<0,1), 5,8; 9,5 (P<0,05), 11,9 (P<0,05); 3,4%, а по сравнению с исходными данными – на 3,9; 4,9; 6,3; 8,6; 4,9% соответственно. Тогда как у животных контрольной группы количество эритроцитов в единице объема крови уменьшилось по сравнению с исходными данными на 0,8%.
В активной фазе влияния ветома 3 на уровень эритроцитов на 15-е сутки исследований находились показатели 3-й и 4-й опытных групп ((9,67±0,21) 1012/л; (9,88±0,10) 1012/л), которые превышали мезор ((9,49±0,29) 1012/л) на 1,9 и 4,1% соответственно, в пассивной фазе находились показатели 1, 2 и 5-й опытных групп ((9,45±0,23) 1012/л; (9,34±0,12) 1012/л; (9,13±0,21) 1012/л), которые были ниже мезора на 0,4; 1,6 и 3,8% соответственно. Акрофаза влияния ветома 3 на уровень эритроцитов в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня эритроцитов 4-й опытной группы (рис. 1).
На 30-е сутки исследований уровень эритроцитов в крови мышей 1–5-й опытных групп был выше по сравнению с аналогами из контроля на 7,9; 9,1 (P<0,5); 11,1 (P<0,01); 15,2 (P<0,05); 4,2%, а по сравнению с исходными данными – на 4,7; 8,2; 7,8; 11,8; 5,8% соответственно. Количество эритроцитов в единице объема крови животных контрольной группы на 30-е сутки опыта было ниже по сравнению с исходными данными на 0,8%.
В активной фазе влияния ветома 3 на уровень эритроцитов на 30-е сутки исследований находились показатели 3-й и 4-й опытных групп ((9,81±0,16) 1012/л; (10,17±0,24) 1012/л), которые превышали мезор ((9,66±0,36) 1012/л) на 1,4 и 5,2% соответственно, в пассивной фазе находились показатели 1, 2 и 5-й опытных групп ((9,53±0,31) 1012/л; (9,63±0,12) 1012/л; (9,2±0,25) 1012/л), которые были ниже мезора на 1,4; 0,4 и 4,9% соответственно. Акрофаза влияния ветома 3 на уровень эритроцитов в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня эритроцитов 4-й опытной группы (рис. 1). У животных 3-й опытной группы так же отмечали резкое увеличение эритроцитов, близкое к показателям животных 4-й опытной группы.
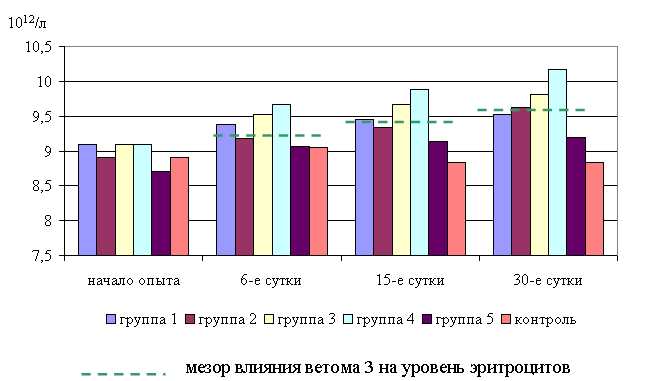
Рис. 1. Динамика уровня эритроцитов у мышей во время опыта
Таким образом, ветом 3 способствует повышению уровня эритроцитов в пределах физиологических норм в крови мышей опытных групп, причем действие ветома 3 на данный показатель находится в зависимости от времени введения препарата. Оптимальное увеличение отмечено при применении препарата в 12 и 22 ч.
Уровень гемоглобина в крови мышей также изменялся под влиянием ветома 3.
На 6-е сутки исследований у мышей 1–5-й опытных групп уровень гемоглобина в крови превышал аналогичный показатель животных контрольной группы на 1,5; 3,1 (P<0,1); 4,0 (P<0,1); 5,6 (P<0,05); 1,5%, а по сравнению с исходными данными – на 2,3; 3,9; 2,3; 5,6; 2,4% соответственно. У аналогов из контроля содержание гемоглобина в крови на 6-е сутки опыта по сравнению с исходными данными не изменилось.
В активной фазе влияния ветома 3 на уровень гемоглобина на 6-е сутки исследований находились показатели 3-й и 4-й опытных групп ((124,83±1,33) г/л; (126,67±1,67) г/л), которые превышали мезор ((124,37±2,43) г/л) на 0,9 и 2,3%, в пассивной фазе находились показатели 1, 2 и 5-й опытных групп ((121,83±0,83); (123,67±1,33); (121,83±2,67) г/л), которые были ниже мезора на 1,6, 0,1 и 1,6% соответственно. Акрофаза влияния ветома 3 на уровень гемоглобина в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня гемоглобина 4-й опытной группы.
Уровень гемоглобина в крови мышей 1–5-й опытных групп на 15-е сутки исследований был выше по сравнению с контролем на 4,1; 6,6 (P<0,1); 7,3 (P<0,05); 9,6 (P<0,05); 4,9%, а по сравнению с исходными данными – на 3,2; 5,7; 3,8; 7,8; 3,6% соответственно. Тогда как у животных контрольной группы уровень гемоглобина снизился на 1,7% по сравнению с исходными данными.
В активной фазе влияния ветома 3 на уровень гемоглобина на 15-е сутки исследований находились показатели 2, 3 и 4-й опытных групп ((125,83±1,67); (126,67±2,83); (129,33±0,83) г/л), которые превышали мезор ((125,7±2,54) г/л) на 0,1; 0,8 и 2,9%, в пассивной фазе находились показатели 1-й и 5-й опытных групп ((122,83±0,67); (123,83±1,33) г/л), которые были ниже мезора на 2,3 и 1,5% соответственно. Акрофаза влияния ветома 3 на уровень гемоглобина в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня гемоглобина 4-й опытной группы (рис. 2).
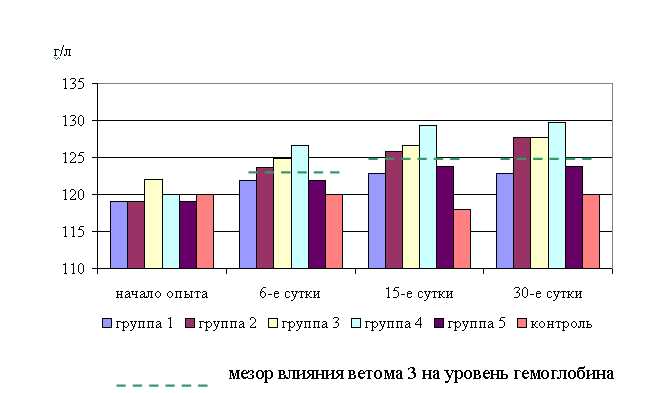
Рис. 2 Динамика уровня гемоглобина у мышей во время опыта
На 30-е сутки исследований у мышей 1–5-й опытных групп уровень гемоглобина в крови превышал аналогичный показатель животных контрольной группы на 2,4; 6,4 (P<0,05); 6,4 (P<0,05); 8,1 (P<0,01); 3,2%. По сравнению с исходными данными уровень гемоглобина у животных 1–5-й опытных и контрольной групп увеличился на 3,2; 7,3; 4,6; 8,1; 4,1 и 1,7% соответственно.
В активной фазе влияния ветома 3 на уровень гемоглобина на 30-е сутки исследований находились показатели 2, 3 и 4-й опытных групп ((127,67±1,33); (127,67±0,83); (129,67±0,83) г/л), которые превышали мезор ((126,33±2,88) г/л) на 1,1; 1,1 и 2,6%, в пассивной фазе находились показатели 1-й и 5-й опытных групп ((122,83±1,76); (123,83±1,67) г/л), которые были ниже мезора на 2,8 и 2,0% соответственно. Акрофаза влияния ветома 3 на уровень гемоглобина в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня гемоглобина 4-й опытной группы (рис. 3).
Таким образом, ветом 3 способствует повышению уровня гемоглобина в крови мышей опытных групп, причем действие ветома 3 на данный показатель находится в зависимости от времени введения препарата. Содержание гемоглобина в единице объема крови до начала исследований было ниже физиологической нормы, по окончанию опыта уровень гемоглобина повысился, практически достигнув физиологической нормы при применении ветома 3 в 12 и 22 ч. Акрофаза влияния препарата на уровень эритроцитов и гемоглобина приходится на одно время. Максимальное увеличение этих показателей регистрировали при назначении ветома 3 в 12 и 22 ч.
Под влиянием ветома 3 уровень лейкоцитов в крови мышей опытных групп также изменялся.
На 6-е сутки исследований у мышей 1–5-й опытных групп уровень лейкоцитов в крови превышал аналогичный показатель животных контрольной группы на 0,8; 4,2; 13,5 (P<0,05); 12,1 (P<0,05); 0,4% соответственно. Содержание лейкоцитов в крови животных 1–5-й опытных и контрольной групп увеличилось по сравнению с исходными данными на 9,7; 12,3; 11,3; 11,9; 7,1 и 0,8 % соответственно.
В активной фазе влияния ветома 3 на уровень лейкоцитов на 6-е сутки исследований находились показатели 3-й и 4-й опытных групп ((12,35±0,45) 109/л; (12,2±0,33) 109/л), которые превышали мезор ((11,56±0,68) 109/л) на 6,8 и 5,5 % соответственно, в пассивной фазе находились показатели 1, 2 и 5-й опытных групп ((10,97±0,35) 109/л; (11,34±0,67) 109/л; (10,92±0,39) 109/л), которые были ниже мезора на 5,1; 1,9 и 5,5% соответственно. Акрофаза влияния ветома 3 на уровень лейкоцитов в крови мышей опытных групп приходилась на 9 и 21 ч, что соответствует показателям уровня лейкоцитов 3-й опытной группы.
На 15-е сутки количество лейкоцитов в единице объема крови мышей 1–5-й опытных групп было выше по сравнению с контролем на 3,2; 5,9; 14,4; 14,8; 1,3%, а по сравнению с исходными данными – на 11,5; 13,3 (P<0,05); 11,3 (P<0,1); 13,8 (P<0,05); 7,3% соответственно. Тогда как у животных контрольной группы содержание лейкоцитов по сравнению с исходными данными не изменилось.
В активной фазе влияния ветома 3 на уровень лейкоцитов на 15-е сутки исследований находились показатели 3-й и 4-й опытных групп ((12,35±0,69) 109/л; (12,4±0,73) 109/л), которые превышали мезор ((11,66±0,68) 109/л) на 5,9 и 6,3% соответственно, в пассивной фазе находились показатели 1, 2 и 5-й опытных групп ((11,15±0,37) 109/л; (11,44±1,03) 109/л; (10,94±0,12) 109/л), которые были ниже мезора на 4,5; 1,4 и 6,3% соответственно. Акрофаза влияния ветома 3 на уровень лейкоцитов в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня лейкоцитов 4-й опытной группы (рис. 3).
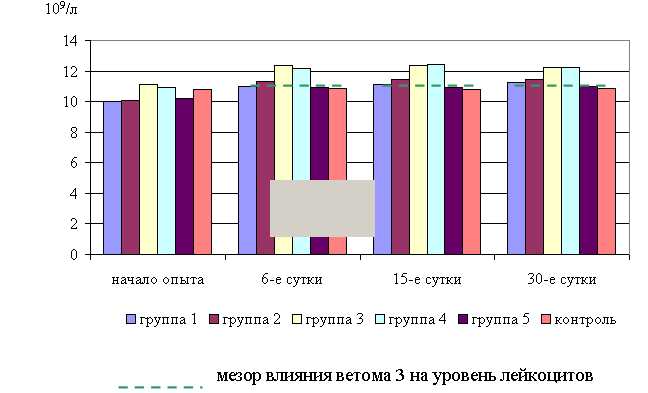
Рис. 3 Динамика уровня лейкоцитов у мышей во время опыта
На 30-е сутки исследований у мышей 1–5-й опытных групп уровень лейкоцитов в крови превышал аналогичный показатель животных контрольной группы на 3,2; 5,3; 12,5 (P<0,05); 12,5 (P<0,05); 0,7 % соответственно. По сравнению с исходными данными количество лейкоцитов у животных 1–5-й опытных и контрольной групп увеличилось на 12,4; 13,6; 10,4; 12,4; 7,5; 0,9 % соответственно.
В активной фазе влияния ветома 3 на уровень лейкоцитов на 30-е сутки исследований находились показатели 3-й и 4-й опытных групп ((12,25±1,12) 109/л; (12,25±0,67) 109/л), которые превышали мезор ((11,64±0,69) 109/л) на 5,2 %, в пассивной фазе находились показатели 1, 2 и 5-й опытных групп ((11,24±0,56) 109/л; (11,47±0,67) 109/л; (10,97±0,84) 109/л), которые были ниже мезора на 3,5; 0,7; 5,8 % соответственно. Акрофаза влияния ветома 3 на уровень лейкоцитов в крови мышей опытных групп приходилась на период с 9 до 12 и с 21 до 22 ч, что соответствует показателям уровня лейкоцитов 3 и 4-й опытных групп (рис. 2).
Таким образом, ветом 3 способствует повышению уровня лейкоцитов в крови мышей опытных групп до верхних пределов физиологической нормы, причем действие ветома 3 на данный показатель находится в зависимости от времени введения препарата. Оптимальное увеличение отмечено при применении препарата в 9 и 21, и 12 и 22 ч. Следовательно, на основании результатов наших исследований, можно делать вывод о том, что ветом 3 активизирует эритро- и лейкопоэз в пределах физиологической нормы. Оптимальные результаты получены при назначении препарата с 9 до 12 и с 21 до 22 ч.
Скорость оседания эритроцитов у мышей опытных и контрольной групп до начала исследований достоверно не отличалась и составляла в среднем 3,5-4,0 мм/ч. На 6-е сутки исследований, данный показатель снизился в опытных группах и составил в среднем 2,5-3,0 мм/ч, тогда как в контрольной группе скорость оседания эритроцитов оставалась на уровне 4,0 мм/ч. На 15 и 30-е сутки исследований тенденция по снижению скорости оседания эритроцитов у мышей опытных групп сохранилась.
Анализ лейкограммы свидетельствует о наличии зависимости влияния ветома 3 на видовой состав лейкоцитов крови телят от временного фактора.
Уровень лимфоцитов до применения препарата был ниже физиологической нормы (табл. 3).
Таблица 3. Лейкоцитарный профиль мышей до применения препарата, %
|
Показатель |
Опытные группы |
Контроль | ||||
| 1-я | 2-я | 3-я | 4-я | 5-я | ||
| Э | 1,0±0,58 | 0,7±0,67 | 1,3±0,33 | 1,0±0,58 | 0,7±0,33 | 0,7±0,67 |
| Б | 0 | 0 | 0 | 0 | 0 | 0 |
| Ю | 2,3±0,33 | 2,3±0,67 | 3,0±0,58 | 2,3±0,33 | 2,3±0,33 | 3,0±0,58 |
| П | 5,3±0,33 | 6,0±0,58 | 6,0±1,0 | 5,7±0,33 | 6,0±0,58 | 6,6±0,88 |
| С | 28,0±1,15 | 29,3±1,2 | 27,3±1,86 | 27,3±2,4 | 27,0±2,31 | 27,0±1,0 |
| Л | 59,7±2,03 | 58,0±1,76 | 59,3±2,60 | 58,7±8,65 | 59,7±1,33 | 58,7±3,53 |
| М | 3,7±1,20 | 3,7±0,67 | 3,1±0,58 | 5,0±1,0 | 4,3±1,86 | 4,0±0,58 |
Примечание: здесь и далее Э – эозинофилы, Б – базофилы, Ю, П, С – юные, палочкоядерные и сегментоядерные нейтрофилы, Л – лимфоциты, М – моноциты.
На 6-е сутки исследований процентное содержание лимфоцитов у мышей 1–5 опытных групп было выше по сравнению с аналогичным показателем животных из контроля на 8,7 (P<0,05); 5,4; 5,4; 6,3; 6,1 %, а по сравнению с исходными данными – на 4,4; 4,1; 1,9; 3,7; 1,8 % соответственно, тогда как у мышей контрольной группы уровень лимфоцитов снизился по сравнению с исходными данными на 2,4 % (табл. 4).
В активной фазе влияния ветома 3 на уровень лимфоцитов на 6-е сутки исследований находились показатели 1-й опытной группы, которые превышали мезор (60,96 %) на 2,2 %, в пассивной фазе находились показатели 2–5-й опытных групп, которые были ниже мезора на 0,9; 0,9; 0,1; 0,3 % соответственно. Акрофаза влияния ветома 3 на уровень лимфоцитов в крови мышей опытных групп приходилась на 7 и 19 ч, что соответствует показателям уровня лимфоцитов 1-й опытной группы.
Таблица 4. Лейкоцитарный профиль мышей на 6-е сутки исследований, %
| Показатель |
Опытные группы |
Контроль | ||||
| 1-я | 2-я | 3-я | 4-я | 5-я | ||
| Э |
0 |
0 |
1,3±0,88 Cv=114,56 |
0 |
0 |
0 |
| Б |
0 |
0 |
0 |
0 |
0 |
0 |
| Ю |
3,3±0,33 Cv=17,32 |
4,3±0,67 Cv=26,65 |
4,7±1,33 Cv=86,6 |
4,3±0,67 Cv=26,65 |
3,3±0,33 Cv=17,32 |
3,0±0,58 Cv=50,0 |
| П |
6,0±0,58 Cv=16,67 |
6,3±0,33 Cv=9,12 |
6,0±1,15 Cv=40,0 |
6,0±0,58 Cv=16,67 |
5,7±0,67* Cv=20,38 |
7,6±0,58 Cv=14,29 |
| С |
24,7±2,40 Cv=16,88 |
25,0±1,0 Cv=6,93 |
24,6±6,74 Cv=69,37 |
24,5±1,15 Cv=9,09 |
25,7±0,33 Cv=2,25 |
26,4±0,67 Cv=4,88 |
| Л |
62,3±1,76** Cv=4,90 |
60,4±1,67 Cv=4,84 |
60,4±11,92 Cv=44,25 |
60,9±2,08 Cv=5,72 |
60,8±2,03 Cv=6,02 |
57,3±0,33 Cv=0,96 |
| М |
3,7±0,88 Cv=45,83 |
4,0±0*** Cv=0 |
3,0±1,04* Cv=65,83 |
4,3±0,88 Cv=35,25 |
4,5±1,33 Cv=40,75 |
5,7±0,33 Cv=10,19 |
Примечание: здесь и далее * - P<0,1, ** - P<0,05, *** - P<0,01
На 15-е сутки исследований уровень лимфоцитов у мышей 1–5-й опытных групп был выше по сравнению с контролем на 9,2; 9,8; 10,3; 14,6; 8,5 %, а по сравнению с исходными данными – на 1,2; 4,7; 2,9; 8,0; 0,5 % соответственно. У аналогов из контроля данный показатель снизился по сравнению с исходными данными на 5,8 % (табл. 5). В активной фазе влияния ветома 3 на уровень лимфоцитов на 15-е сутки исследований находились показатели 4-й опытной группы, которые превышали мезор (61,1 %) на 3,8 %, в пассивной фазе находились показатели 1, 2, 3 и 5-й опытных групп, которые были ниже мезора на 1,1; 0,7; 1,1; 1,9 % соответственно. Акрофаза влияния ветома 3 на уровень лимфоцитов в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня лимфоцитов 4-й опытной группы.
На 30-е сутки исследований уровень лимфоцитов у мышей 1–5-й опытных групп был выше по сравнению с контролем на 7,0; 5,4; 10,1; 10,1; 10,6 % соответственно. По сравнению с исходными данными процентное содержание лимфоцитов увеличилось у животных 2, 3, 4 и 5-й групп на 1,2; 3,4; 4,4; 3,2 %, тогда как у мышей 1-й и контрольной группы – снизилось на 0,2 и 5,1 % соответственно (табл. 6)..
Таблица 5. Лейкоцитарный профиль мышей на 15-е сутки исследований, %
| Показатель | Опытные группы | Контроль | ||||
|
1-я |
2-я |
3-я |
4-я |
5-я |
||
| Э |
0 |
0 |
0,7±0,33 Cv=86,6 |
0 |
1,0±0,58 Cv=100,0 |
0 |
| Б |
0 |
0 |
0 |
0 |
0 |
0 |
| Ю |
3,3±0,33 Cv=17,32 |
3,3±0,67 Cv=34,64 |
2,3±0,67 Cv=49,49 |
4,3±0,33 Cv=13,32 |
3,7±0,88 Cv=41,66 |
3,0±0,58 Cv=100,0 |
| П |
6,5±0,58 Cv=14,29 |
6,3±0,33 Cv=9,12 |
6,7±0,33 Cv=8,66 |
6,7±0,33 Cv=8,66 |
6,3±0,88 Cv=24,12 |
5,9±0,33 Cv=15,75 |
| С |
26,3±1,45 Cv=9,56 |
26,7±0,88 Cv=5,73 |
25,7±2,33 Cv=15,75 |
22,3±1,45** Cv=11,27 |
25,3±0,67** Cv=4,22 |
29,7±1,2 Cv=7,52 |
| Л |
60,4±1,33 Cv=3,83 |
60,7±1,53 Cv=4,41 |
61,0±4,04 Cv=11,48 |
63,4±0,88 Cv=2,41 |
60,0±1,53 Cv=4,56 |
55,3±8,69 Cv=27,19 |
| М |
3,5±1,0 Cv=57,74 |
3,0±0,58 Cv=33,33 |
3,6±1,2 Cv=56,77 |
3,3±0,33 Cv=17,32 |
3,7±0,88 Cv=41,66 |
6,1±1,53 Cv=52,92 |
Таблица 6. Лейкоцитарный профиль мышей на 30-е сутки исследований, %
| Показатель |
Опытные группы |
Контроль |
||||
|
1-я |
2-я |
3-я |
4-я |
5-я |
||
|
Э |
0 |
0 |
0 |
0 |
0 |
0,7±0,33 Cv=86,6 |
|
Б |
0 |
0 |
0 |
0 |
0 |
0 |
|
Ю |
3,7±0,67 Cv=31,49 |
4,0±0,58* Cv=25,0 |
2,7±0,33 Cv=21,65 |
4,3±0,33* Cv=13,32 |
2,3±0,67 Cv=49,49 |
1,7±0,88 Cv=91,65 |
|
П |
7,3±0,88 Cv=20,83 |
7,3±0,67 Cv=15,75 |
6,3±0,67 Cv=18,23 |
5,7±0,33 Cv=7,53 |
5,7±0,33 Cv=10,19 |
5,0±1,53 Cv=52,92 |
|
С |
25,7±0,67** Cv=4,50 |
26,3±1,45 Cv=9,56 |
26,7±0,67 Cv=4,75 |
24,7±2,85 Cv=22,09 |
26,7±2,33 Cv=15,16 |
29,6±1,2 Cv=7,10 |
|
Л |
59,6±1,76 Cv=5,24 |
58,7±1,2 Cv=3,55 |
61,3±7,69 Cv=24,97 |
61,3±4,26 Cv=12,02 |
61,6±1,2 Cv=3,38 |
55,7±3,38 Cv=10,53 |
|
М |
3,7±0,88** Cv=32,73 |
3,7±1,2* Cv=56,77 |
3,0±1,0** Cv=34,64 |
4,0±1,0* Cv=43,3 |
3,7±1,73 Cv=60,0 |
7,3±0,88 Cv=20,83 |
В активной фазе влияния ветома 3 на уровень лимфоцитов на 30-е сутки исследований находились показатели 3, 4 и 5-й опытной группы, которые превышали мезор (60,5 %) на 1,3; 1,3; 1,8 %, в пассивной фазе находились показатели 1-й и 2-й опытных групп, которые были ниже мезора на 1,5 и 3,0 % соответственно. Акрофаза влияния ветома 3 на уровень лимфоцитов в крови мышей опытных групп приходилась на 14 и 22 ч, что соответствует показателям уровня лимфоцитов 5-й опытной группы.
Таким образом, ветом 3 повышал уровень лимфоцитов мышей опытных групп до границ физиологических норм, однако, анализ влияния циркадианных ритмов действия ветома 3 на уровень лимфоцитов не позволяет сделать однозначных выводов.
Уровень моноцитов у мышей всех групп до применения препарата находился в пределах физиологических норм (табл. 3).
На 6-е сутки исследований процентное содержание моноцитов у мышей 1–5 опытных групп было ниже по сравнению с аналогичным показателем животных из контроля на 35,1; 29,8 (P<0,01); 47,4 (P<0,1); 24,6; 21,1 % соответственно. По сравнению с исходными данными уровень моноцитов у мышей 3-й и 4-й опытных групп снизился на 3,2; 14,0 %, у животных 2-й и 5-й опытных групп – увеличился на 8,1; 4,7 %, а у аналогов из 1-й опытной группы – остался без изменений. У мышей контрольной группы содержание моноцитов на 6-е сутки опыта было выше границ физиологической нормы, увеличившись по сравнению с исходными данными на 42,5 %. Анализ хронобиологических особенностей влияния ветома 3 на уровень моноцитов на 6-е сутки опыта не позволяет сделать однозначных выводов (табл. 4).
Процентное содержание моноцитов в крови мышей 1–5 опытных групп на 15-е сутки исследований было ниже по сравнению с аналогичным показателем животных из контроля на 42,6; 50,8; 41,0; 45,9; 39,3 % соответственно. По сравнению с исходными данными уровень моноцитов у мышей 1, 2, 4 и 5-й опытных групп снизился на 5,4; 18,9; 34,0 и 14,0 %, а у животных 2-й опытной группы – увеличился на 16,1 %. У мышей контрольной группы содержание моноцитов на 15-е сутки опыта было выше границ физиологической нормы и возросло по сравнению с исходными данными на 52,5 %. Анализ хронобиологических особенностей влияния ветома 3 на уровень моноцитов на 15-е сутки опыта не позволяет сделать однозначных выводов (табл. 5)..
На 30-е сутки исследований процентное содержание моноцитов у мышей 1–5 опытных групп было достоверно ниже по сравнению с аналогичным показателем животных из контроля на 49,3 (P<0,05); 49,3 (P<0,1); 59,0 (P<0,05); 45,2 (P<0,1); 49,3 % соответственно. По сравнению с исходными данными уровень моноцитов у мышей 3, 4 и 5-й опытных групп снизился на 3,2; 20,0; 14,0 %, а у животных 1-й и 2-й опытных групп – остался без изменений. У мышей контрольной группы содержание моноцитов на 30-е сутки опыта было значительно выше границ физиологической нормы и увеличилось по сравнению с исходными данными на 82,5 %. Анализ хронобиологических особенностей влияния ветома 3 на уровень моноцитов на 30-е сутки опыта не позволяет сделать однозначных выводов (табл. 6).
Таким образом, у мышей опытных групп содержание моноцитов за весь период опыта оставалось в пределах физиологических норм, тогда как у животных контрольной группы – значительно превышало последние. Анализ влияния циркадианных ритмов действия ветома 3 на уровень моноцитов не позволяет сделать однозначных выводов.
Уровень нейтрофилов у мышей всех групп до применения препарата находился в пределах физиологических норм (табл. 3).
На 6-е сутки исследований у мышей 1–5 опытных групп по отношению к аналогам из контроля процентное содержание сегментоядерных форм нейтрофилов было ниже на 6,4; 5,3; 6,8; 7,2; 2,7 %, палочкоядерных форм – ниже на 21,1; 17,1; 21,1; 21,1; 25,0 (P<0,1) %, юных форм – выше на 10,0; 43,3; 56,7; 43,3; 10,0 % соответственно. По сравнению с исходными данными уровень сегментоядерных форм нейтрофилов у мышей 1–5-й опытных и контрольной групп снизился на 11,8; 14,7 (P<0,1); 9,9; 10,3; 4,8 и 2,2 % соответственно. Содержание палочкоядерных форм нейтрофилов по сравнению с исходными данными у животных 1, 2 и 4-й опытных групп увеличилось на 13,2; 5,0 и 0,2 %, тогда как у мышей 3-й опытной группы – не изменилось, а у животных 5-й опытной и контрольной групп – уменьшилось на 5,0 и 13,2 % соответственно. Уровень юных форм нейтрофилов по сравнению с исходными данными у мышей 1–5-й опытных групп был выше на 43,5 (P<0,1); 86,9; 56,7; 86,9 (P<0,1); 43,5 (P<0,1) % соответственно, тогда как у аналогов из контроля данный показатель не изменился (табл. 4).
Необходимо отметить, что на 6-е сутки опыта уровень палочкоядерных нейтрофилов был выше границы физиологической нормы, остальные показатели находились в пределах физиологической нормы. Анализ хронобиологических особенностей влияния ветома 3 на уровень нейтрофилов на 6-е сутки опыта не позволяет сделать однозначных выводов.
На 15-е сутки исследований у мышей 1–5 опытных групп по отношению к аналогам из контроля процентное содержание сегментоядерных нейтрофилов было ниже на 11,4; 10,1; 13,5; 24,9 (P<0,05); 14,8% (P<0,05), палочкоядерных – выше на 10,2; 6,8; 13,6; 13,6; 6,8 % соответственно. Уровень юных нейтрофилов по сравнению с аналогами из контроля у мышей 1, 2, 4 и 5-й опытных групп был выше на 10,0; 10,0; 43,3; 23,3 % соответственно, тогда как у животных 3-й опытной группы – ниже на 23,3 %. По сравнению с исходными данными уровень сегментоядерных нейтрофилов у мышей 1–5-й опытных групп снизился на 6,1; 8,9; 5,9; 18,3; 6,3 % соответственно, тогда как у аналогов из контроля – увеличился на 10,0 %. Содержание палочкоядерных нейтрофилов по сравнению с исходными данными у животных 1–5-й опытных и контрольной групп увеличилось на 22,6; 5,0; 11,7; 17,5 (P<0,1); 5,0; 10,6 % соответственно. Уровень юных нейтрофилов по сравнению с исходными данными у мышей 1, 2, 4 и 5-й опытных групп был выше на 43,5 (P<0,1); 43,5; 89,6 (P<0,05) и 60,9 % соответственно, тогда как у животных 3-й опытной группы – ниже на 23,3 %, а у аналогов из контроля – не изменился.
Необходимо отметить, что на 15-е сутки исследований уровень сегментоядерных нейтрофилов у мышей контрольной группы находился на верхней границе нормы, а содержание юных и палочкоядерных форм – в пределах физиологической нормы. Анализ хронобиологических особенностей влияния ветома 3 на уровень нейтрофилов на 15-е сутки опыта не позволяет сделать однозначных выводов (табл. 5).
На 30-е сутки исследований у мышей 1–5 опытных групп по отношению к аналогам из контроля процентное содержание сегментоядерных нейтрофилов было ниже на 13,2 (P<0,05); 11,1; 9,8; 16,6; 9,8 %, палочкоядерных – выше на 46,0; 46,0; 26,0; 14,0; 14,0 %, юных форм – выше в 2,2; 2,3 (P<0,1); 1,6; 2,5 (P<0,1); 1,4 раза соответственно. По сравнению с исходными данными уровень сегментоядерных нейтрофилов у мышей 1–5-й опытных групп снизился на 8,2; 10,2; 2,2; 9,5;, 1,1 % соответственно, тогда как у аналогов из контроля – увеличился на 9,6 %. Содержание палочкоядерных нейтрофилов по сравнению с исходными данными у животных 1, 2 и 3-й опытных групп увеличилось на 37,7; 21,6 и 5,0 %, тогда как у мышей 4-й опытной группы – не изменилось, а у животных 5-й опытной и контрольной групп – уменьшилось на 5,0 и 24,2 % соответственно. Уровень юных нейтрофилов по сравнению с исходными данными у мышей 1, 2 и 4-й опытных групп был выше на 60,9; 73,9; 86,9 (P<0,05) %, тогда как у животных 5-й опытной группы – не изменился, а у аналогов из 3-й опытной и контрольной групп – был ниже на 10,0 и 43,3 % соответственно.
Необходимо отметить, что на 30-е сутки исследований уровень сегментоядерных нейтрофилов у мышей контрольной группы находился на верхней границе нормы, количество юных и палочкоядерных нейтрофилов – в пределах физиологической нормы. Анализ хронобиологических особенностей влияния ветома 3 на уровень нейтрофилов на 30-е сутки опыта не позволяет сделать однозначных выводов (табл. 6).
Таким образом, у мышей опытных групп содержание нейтрофилов за весь период опыта оставалось в пределах физиологических норм, тогда как у животных контрольной группы – уровень палочкоядерных нейтрофилов на 6-е сутки исследований превышал пределы нормы, а уровень сегментоядерных нейтрофилов на 15-е и 30-е сутки опыта находился на верхней границе физиологической нормы. Ветом 3 стимулировал нейтрофилопоэз юных нейтрофилов. Анализ влияния циркадианных ритмов действия ветома 3 на уровень нейтрофилов не позволяет сделать однозначных выводов.
Уровень эозинофилов у мышей всех групп во время опыта снизился. Так, если перед началом опыта эозинофильные клетки были обнаружены у мышей всех групп, то на 6-е сут. исследований эозинофилы были отмечены только у животных 3-й опытной группы (1,3±0,88) %, на 15-е сут. – у мышей 3 и 5-й опытных групп ((0,7±0,33) и (1,0±0,58) % соответственно), а на 30-е сут. – у мышей из контроля (0,7±0,33) %. При проведении исследований базофилов в мазках крови обнаружено не было (табл. 3-6).
Таким образом, полученные результаты свидетельствуют о позитивном влиянии ветома 3 на эритро- и лейкопоэз, в т. ч. лимфоцитопоэз и нейтрофилопоэз у мышей опытных групп в пределах физиологических норм, как во время применения препарата, так и в период его последействия. Выраженность данного влияния зависела от биоритмологической организации физиологических функций мышей. Оптимальные влияние ветома 3 на эритропоэз отмечено при применении препарата в 12 и 22 ч, при этом показатели содержания эритроцитов и гемоглобина на 6, 15 и 30-е сутки исследований превышали мезор на 2,3 и 3,3; 2,9 и 4,1; 2,6 и 5,2 % соответственно. Максимальное увеличение уровня лейкоцитов отмечено при применении ветома 3 в 9 и 21, и 12 и 22 ч, при этом показатели содержания лейкоцитов на 6, 15 и 30-е сутки превышали мезор на 6,8 и 5,5; 5,8 и 6,3; 5,2 и 5,2% соответственно.
Таким образом, действие ветома 3 на организм белых находится в зависимости от времени применения препарата. Полученные результаты согласуется с мнением ряда авторов о том, что действие любого лекарственного вещества на организм, равно как и восприимчивость фармакологического воздействия структурными единицами индивидуума, зависят от биоритмологической структуры живого организма, в частности ритмов активности его клеток, органов и систем (Зидермане А.А., 1988; Арушанян Э.Б., 1998; Комаров Ф.И., Рапопорт С.И., 2000).
У подопытных мышей до применения препарата изучаемые гематологические показатели были в пределах нормы.
По окончании опыта у мышей, получавших пробиотик, в крови увеличивалось количество, эритроцитов, лейкоцитов и гемоглобина по сравнению с контролем. Оптимальные результаты получены при применении ветома 3 в 12 и 22 ч. Так, мыши, получавшие препарат в указанное время, превышали мезор по содержанию эритроцитов – на 3,3, 4,1 и 5,2 %, лейкоцитов – на 6,9, 11,9 и 15,2 %, гемоглобина – на 2,3, 2,9 и 2,6 % на 6, 15 и 30-е сутки соответственно.
Оптимальное увеличение гематологических показателей крови и живой массы мышей при применении ветома 3 в 12 и 22 ч, по-видимому, связаны с низкой активностью энергетического обмена в эпителии структурно-функциональной единицы тонкой кишки «крипта-ворсинка» в эти временные рамки (Романов Ю.А. и соавт., 1981, Комаров Ф.И., Рапопорт С.И., 2000), что согласно закону J. Wilder (1962), по которому та или иная функция тем слабее стимулируется и легче угнетается, чем исходно она сильнее активирована, является обязательным условием применения лекарственных средств для стимуляции тех или иных показателей у здоровых животных при биоритмологическом подходе. Кроме того, по данным Р.М. Заславской (1996), Ф.И. Комарова, С.И. Рапопорта (2000) при профилактическом применении лекарств максимальный фармакологический эффект совпадает с акрофазой показателей.
Хронобиологические особенности ростостимулирующего действия ветома 3 на здоровых мышей
Живой организм – единое целое, живущее по принципам саморегуляции. Любое воздействие извне может нарушать внутреннюю регуляцию организма, обуславливая уменьшение или полное блокирование компенсаторных реакций, механизмов адаптации, неполный или некачественный фармакологический ответ на лечебные или профилактические мероприятия, что в конечном итоге приводит к развитию патологических реакций.
Животные постоянно подвергаются воздействию неблагоприятных факторов внешней среды, что способствует возникновению массовых заболеваний, особенно у молодняка (Иванова А.Б., 2002), а также снижению скорости роста, что, безусловно, сказывается на экономических показателях сельскохозяйственного производства.
Нами были проведены научно-производственные опыты по изучению хронофармакологических особенностей ростостимулирующего действия пробиотического препарата.
Нами установлено, что ветом 3 обладает выраженным ростостимулирующим действием на организм белых мышей. Однако выраженность эффекта зависела от времени введения препарата.
На 6-е сутки исследований живая масса мышей 1, 3, 4 и 5-й опытных групп была выше по сравнению с аналогами из контроля на 3,68; 3,68; 8,95; 8,95 %, среднесуточный прирост и скорость роста – в 2,4; 2,4; 4,4; 4,4 раза соответственно. Тогда как у животных 2-й опытной группы по сравнению с контролем живая масса была ниже на 1,5 %, среднесуточный прирост живой массы – на 60,0 %. По сравнению с исходными данными живая масса мышей 1–5-й опытных и контрольной групп увеличилась на 6,49; 1,08; 6,49; 11,89; 11,89 и 2,7 % соответственно (табл. 7-9).
Живая масса мышей 1–5-й опытных групп на 15-е сутки исследований была выше по сравнению с аналогами из контроля на 3,0; 3,0; 5,1; 11,7; 10,2% соответственно. По сравнению с исходными данными живая масса мышей 1–5-й опытных и контрольной групп увеличилась на 9,7; 9,7; 11,9; 18,9; 17,3 и 6,5 % соответственно (табл. 7).
Таблица 7. Динамика живой массы мышей опытных групп, г
| Группа |
Исходные данные |
6-е сутки |
15-е сутки |
30-е сутки |
|
1-я опытная |
18,5±0,29 Cv=2,7 |
19,7±0,33 Cv=2,94 |
20,3±0,33 Cv=2,84 |
20,7±0,33 Cv=2,79 |
|
2-я опытная |
18,5±0,29 Cv=2,7 |
18,7±0,67 Cv=6,49 |
20,3±0,33 Cv=2,84 |
21,3±1,2 Cv=9,76 |
|
3-я опытная |
18,5±0,29 Cv=2,7 |
19,7±0,88 Cv=7,77 |
20,7±0,67 Cv=5,59 |
21,3±0,33* Cv=2,71 |
|
4-я опытная |
18,5±0,29 Cv=2,7 |
20,7±0,88 Cv=7,39 |
22,0±1,15 Cv=9,09 |
22,7±0,88* Cv=6,74 |
|
5-я опытная |
18,5±0,29 Cv=2,7 |
20,7±0,88 Cv=7,39 |
21,7±0,88 Cv=7,05 |
21,8±1,2 Cv=9,61 |
|
Контрольная |
18,5±0,29 Cv=2,7 |
19,0±0,58 Cv=5,26 |
19,7±0,33 Cv=2,94 |
20,3±0,33 Cv=2,84 |
Среднесуточный прирост и скорость роста у животных 2, 3, 4 и 5-й опытных групп на 15-е сутки исследований были выше по сравнению с контролем в 2,3; 1,4; 1,8; 1,4 раза соответственно, тогда как у мышей 1-й опытной группы данные показатели были ниже аналогов из контроля на 14,1 %. (табл. 8-9).
Таблица 8. Динамика среднесуточных приростов мышей опытных групп, г
| Группа |
6-е сутки |
15-е сутки |
30-е сутки |
За опытный период |
|
1-я опытная |
0,240±0,003 |
0,067±0,033 |
0,027±0,007 |
0,111±0,086 |
|
2-я опытная |
0,040±0,007 |
0,178±0,083 |
0,067±0,003 |
0,095±0,055 |
|
3-я опытная |
0,240±0,033 |
0,111±0,033 |
0,040±0,007 |
0,130±0,073 |
|
4-я опытная |
0,440±0,133 |
0,144±0,033 |
0,047±0,007 |
0,210±0,153 |
|
5-я опытная |
0,440±0,167 |
0,111±0,003 |
0,007±0,001 |
0,186±0,169 |
|
Контрольная |
0,100±0,133 |
0,078±0,007 |
0,040±0,003 |
0,073±0,022 |
Таблица 9. Динамика скорости роста мышей опытных групп, %
| Группа |
6-е сутки |
15-е сутки |
30-е сутки |
За опытный период |
|
1-я опытная |
6,28±0,67 |
3,0±0,67 |
1,95±0,67 |
3,74±1,69 |
|
2-я опытная |
1,08±0,83 |
8,21±0,83 |
4,81±0,33 |
4,7±2,41 |
|
3-я опытная |
6,28±1,33 |
4,95±0,67 |
2,86±0,33 |
4,7±1,23 |
|
4-я опытная |
11,22±0,67 |
6,09±0,83 |
3,13±0,67 |
6,82±2,94 |
|
5-я опытная |
11,22±0,83 |
4,72±0,33 |
0,46±0,67 |
5,47±3,84 |
|
Контрольная |
2,67±0,83 |
3,62±0,67 |
3,0±0,33 |
3,09±0,35 |
На 30-е сутки исследований живая масса мышей 1–5-й опытных групп была выше по сравнению с аналогами из контроля на 2,0; 5,0; 5,0 (P<0,1); 11,8 (P<0,1); 7,4 % соответственно. По сравнению с исходными данными живая масса мышей 1–5-й опытных и контрольной групп увеличилась на 11,9; 15,1; 15,1; 22,7; 17,8 и 9,7 % соответственно (табл. 7). Среднесуточный прирост и скорость роста у животных 2 и 4-й опытных групп на 30-е сутки исследований были выше по сравнению с контролем на 67,5 и 17,5 %, у мышей 1 и 5-й опытных групп – ниже на 32,5 и 82,5 %, а у аналогов из 3-й опытной группы – на уровне мышей из контроля (табл. 8-9).
В активной фазе влияния ветома 3 на скорость роста мышей опытных групп за весь период исследований находились показатели 4 и 5-й опытных групп, которые превышали мезор (5,08±0,85%) на 34,3 и 7,7 % соответственно, в пассивной фазе находились показатели 1, 2 и 3-й опытных групп, которые были ниже мезора на 26,4, 7,5 и 7,5 % соответственно. Акрофаза влияния ветома 3 на скорость роста мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям скорости роста мышей 4-й опытной группы (рис. 4).
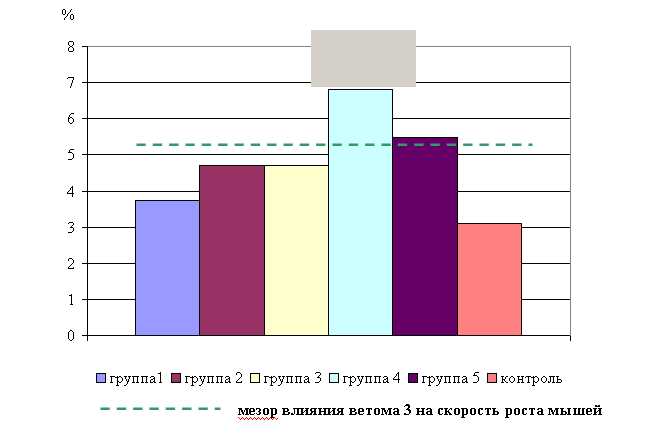
Рис. 4. Скорость роста мышей опытных групп
Таким образом, ветом 3 обладает выраженным ростостимулирующим действием на организм мышей, как при применении препарата, так и в период его последействия.
При изучении ростостимулирующего действия ветома 3 на организм белых мышей установлено выраженное влияние препарата на интенсивность роста, зависящее от биоритмологической организации физиологических функций организма. Так, у животных, получавших пробиотик в 12 и 22 часа среднесуточный прирост живой массы мышей за опытный период был выше мезора на 34,4 %. Полученные результаты согласуются с данными ряда авторов о позитивном влиянии ветома 3 на динамику привесов живой массы животных (Ноздрин Г.А. и соавт, 1997, 2001, 2003, Ноздрин А.Г., 2003).
А.И. Шевченко (2003) указывает на сохранение тенденции по увеличению живой массы цыплят спустя 20 и 40 дней по истечении введения ветома 1.1, что согласуется с полученными нами результатами о том, что после завершения введения препарата, у мышей, получавших ветом 3 в 12 и 22 ч, отмечалась наибольшая скорость роста.







