Испытательная лаборатория биотехнологического контроля
|
Аттестат аккредитации |
Лицензия на осуществление |
Юридический и фактический адрес: Телефон/факс: 8 (383) 325-70-30. |
Информация о повышении квалификации сотрудников ЛБТК, ответственных за производство лекарственных средств для ветеринарного применения и кормов для животных в соответствии с требованиями Федерального Закона № 61-ФЗ от 12.04.2010.
№ п/п |
Наименование исследования |
Стоимость, руб. |
Биохимия крови |
||
1. |
Альбумин |
30 |
2. |
Амилаза |
50 |
3. |
АЛТ |
30 |
4. |
АСТ |
30 |
5. |
ГГТ |
30 |
6. |
ЛДГ |
30 |
7. |
Билирубин общий |
30 |
8. |
Билирубин прямой |
30 |
9. |
Глюкоза |
30 |
10. |
Железо |
65 |
11. |
Кальций |
30 |
12. |
Калий |
85 |
13. |
Креатинин |
30 |
14. |
Магний |
50 |
15. |
Мочевая кислота |
40 |
16. |
Мочевина |
40 |
17. |
Протеин |
30 |
18. |
Триглицериды |
58 |
19. |
Фосфатаза щелочная |
30 |
20. |
Фосфатаза кислая |
30 |
21. |
Фосфор |
30 |
22. |
Хлориды |
30 |
23. |
Холестерин |
40 |
24. |
Гемоглобин |
30 |
25. |
Холинэстераза |
30 |
26. |
Натрий |
40 |
|
||
27. |
Сокращенный (определение количества эритроцитов, лейкоцитов, гемоглобина) |
100 |
28. |
Развернутый |
170 |
№ п/п |
Наименование исследования |
Стоимость, руб. |
Анализ биологических материалов и образцов |
||
29. |
Анализ кала на дисбактериоз |
450 |
30. |
Бактериологический анализ мочи |
200 |
31. |
Бактериологический анализ биоматериала для выявления возбудителя инфекционного заболевания III – IV групп патогенности без видовой идентификации |
300 |
32. |
Определение чувствительности к антибиотикам |
200 |
Бактериологический анализ кормов, лекарственных препаратов |
||
33. |
Бактериологическое исследование комбикормов, премиксов, белкововитаминных добавок, кормов растительного происхождения (комплексное) |
1200 |
34. |
Бактериологическое исследование средств, применяемых при воспроизводстве животных и птицы на: |
|
35. |
- бакобсеменение |
140 |
36. |
- Ps. aeruginosa |
200 |
37. |
- анаэробы |
470 |
38. |
- плесени, дрожжи |
350 |
39. |
- БГКП |
150 |
40. |
Исследование смывов на: |
|
41. |
- БГКП |
100 |
42. |
- КМАФАнМ |
200 |
43. |
- патогенные энтеробактерии, в т.ч. сальмонеллы |
300 |
44. |
- протей |
60 |
45. |
- стафилококк |
250 |
|
||
46. |
- E. coli; | 200 |
47. |
- КМАФАнМ; |
250 |
48. |
- БГКП; |
150 |
49. |
- сульфитредуцирующие клостридии; |
220 |
50. |
- Clostridium perfringens |
200 |
51. |
- Clostridium botulinum |
200 |
52. |
- патогеные в т.ч. сальмонеллы; |
500 |
53. |
- плесени, дрожжи; |
350 |
54. |
- листерия (L.monocytogenes); |
460 |
55. |
- протей |
150 |
56. |
- энтерококки |
150 |
57. |
- парагемолитический вибрион (V.parahaemolyticus) |
150 |
58. |
- лактобактерии |
300 |
59. |
- бифидобактерии |
400 |
60. |
- молочнокислые микроорганизмы |
150 |
61. |
- ацидофильные микроорганизмы |
150 |
62. |
- B. cereus |
250 |
63. |
- стафилококк золотистый (S. aureus) |
250 |
64. |
- бактерии семейства Enterobacteriaceae |
150 |
65. |
Исследование на промышленную стерильность. |
510 |
№ п/п |
Наименование исследования |
Стоимость, руб. |
|
||
66. |
- общее микробное число (ОМЧ) |
250 |
67. |
- термотолерантные колиформные бактерии (ТКБ) |
250 |
68. |
- общие колиформные бактерии (ОКБ) |
250 |
69. |
- сульфитредуцирующие клостридии |
250 |
70. |
- колифаги |
150 |
VII. Зерно на кормовые цели |
||
71. |
- E. coli; | 200 |
72. |
- Ps. aeruginosa |
200 |
73. |
- патогенные энтеробактерии, в т.ч. сальмонеллы |
300 |
74. |
- анаэробы |
470 |
75. |
- пастереллы |
300 |
76. |
- энтерококки |
150 |
77. |
- плесени, дрожжи; |
350 |
78. |
- B. cereus |
250 |
Почва, грунты, удобрения. |
||
VIII. Почвы территорий населенных мест, сельскохозяйственных зон, орошаемые почвы, грунты тепличные, грунты питательные |
||
79. |
Индекс БГКП |
150 |
80. |
Индекс энтерококков |
150 |
81. |
Наличие патогенных и болезнетворных микроорганизмов, клеток/г, в том числе энтеробактерий (патогенных вариантов кишечной палочки, сальмонелл, протеи), энтерококков (стафилококков, клостридий, бацилл), энтеровирусов |
500 |
82. |
Наличие жизнеспособных яиц и личинок гельминтов |
160 |
83. |
Цисты кишечных патогенных простейших |
160 |
IX. Удобрения органические и тепличные грунты, помет птицы |
||
84. |
Индекс БГКП |
150 |
85. |
Индекс энтерококков |
150 |
86. |
Наличие патогенных и болезнетворных микроорганизмов, клеток/г, в том числе энтеробактерий (патогенных вариантов кишечной палочки, сальмонелл, протеи), энтерококков (стафилококков, клостридий, бацилл), энтеровирусов |
500 |
87. |
Наличие жизнеспособных яиц и личинок гельминтов |
160 |
88. |
Цисты кишечных патогенных простейших |
160 |
X. Кормовые продукты перерабатывающих предприятий (жмыхи, шроты и пр.), комбикорма, корма животного происхождения |
||
89. |
- E. coli; |
200 |
90. |
- патогеные в т.ч. сальмонеллы; |
500 |
91. |
- анаэробы |
470 |
92. |
- Ps. aeruginosa |
200 |
93. |
- пастереллы |
300 |
94. |
- энтерококки |
150 |
95. |
- плесени, дрожжи; |
350 |
96. |
- B. cereus |
250 |
№ п/п |
Наименование исследования |
Стоимость, руб. |
XI. Сырье лекарственное животного и растительного происхождения.
|
||
97. |
Показатели зависят от вида продукции, стоимость исчисляется исходя из номенклатуры показателей |
- |
Парфюмерно-косметическая продукция |
||
XII. 1 группа (косметика детская, косметика вокруг глаз, для губ, интимная косметика, средства гигиены полости рта) |
||
98. |
КМАФАнМ |
250 |
99. |
C. albicans |
250 |
100. |
E. coli |
200 |
101. |
S. aureus |
250 |
102. |
Ps. aeruginosа |
200 |
XIII. 2 группа (остальная косметика) |
||
103. |
КМАФАнМ |
250 |
104. |
C. albicans |
250 |
105. |
E. coli |
200 |
106. |
S. aureus |
250 |
107. |
Ps. aeruginosа |
200 |
XIV. 3 группа (ампульная косметика) |
||
108. |
Исследование на стерильность |
510 |
XV. Факторы среды обитания промышленных объектов (рабочие места, производственная зона), в т.ч. воздух помещений, смывы.
|
||
109. |
Показатели зависят от назначения и вида исследований, стоимость исчисляется исходя из номенклатуры показателей |
- |
XVI. Исследования на стерильность лекарственных средств, медицинских инструментов и материалов, |
||
110. |
Исследование на стерильность |
510 |
XVII. Грудное молоко |
||
111. |
- КМАФАнМ; |
250 |
112. |
- БГКП; |
150 |
113. |
- S.aureus; |
250 |
114. |
- бактерии рода Salmonella; |
500 |
115. |
- дрожжи и плесневые грибы; |
350 |
116. |
- E.coli; |
200 |
117. |
- P. aeruginosa; |
200 |
118. |
- бактерии семейства Enterobacteriaceae |
150 |
№ п/п |
Наименование исследования |
Стоимость, руб. |
XVIII. Биологический материал для выделения и идентификации микроорганизмов и возбудителей инфекций: |
||
119. |
- шигелл (Shigella) |
300 |
120. |
- сальмонелл (Salmonella) |
500 |
121. |
- иерсиний (Yersinia) |
450 |
122. |
- условно – патогенных энтеробактерий |
300 |
123. |
- микроорганизмы рода коринебактерий (Corynebacterium) |
600 |
124. |
- микроорганизмы рода стафилококка (Staphylococcus) |
300 |
125. |
- микроорганизмы семейства стрептококковых (Streptococcaceae) |
300 |
126. |
- микроорганизмы семейства нейссериевых (Neisseriaceae) |
600 |
127. |
- микроорганизмы рода гемофилус (Haemophilus) |
400 |
128. |
- микроорганизмы рода псевдомонас (Pseudomonas) |
200 |
129. |
- микробиоценоз кишечника |
450 |
130. |
- возбудители холеры (в том числе Vibrio cholerae 01 не токсигенный, Vibrio cholerae non 01 не токсигенный, Vibrio spp.) | 400 |
* Цены указаны с учетом НДС.
** Перечень показателей зависит от вида продукции.
*** Стоимость анализа может увеличиваться в зависимости от вида микроорганизма
Действует скидка 3% при биохимическом анализе на сумму от 5000 рублей.
При отсутствии какой-либо позиции в прайс-листе стоимость анализа можно уточнить в лаборатории.
По всем вопросам, связанным с деятельностью лаборатории и проведением анализов, Вы можете обратиться к нашим специалистам:
Леляк Анастасия Александровна, зав. лабораторией – 8-961-875-6175.
Ревков Николай Викторович, ветеринарный врач – 8-961-875-6145.
Научно – производственная фирма «Исследовательский центр»
Испытательная лаборатория биотехнологического контроля
Область аккредитации
 |
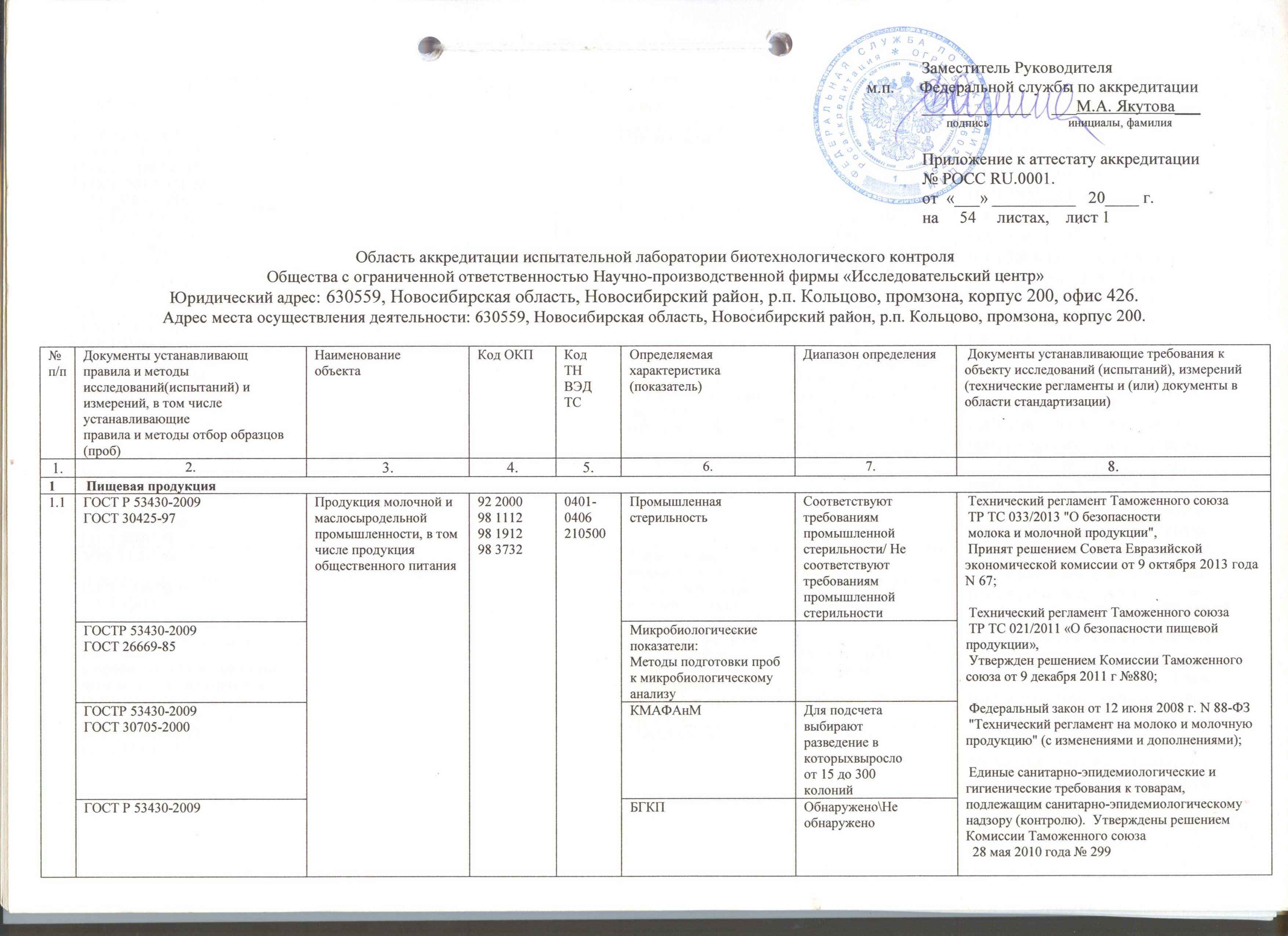 |
Область аккредитации (pdf) |
Процедура государственной регистрации БАД
на территории Российской Федерации
Рассмотрим порядок действий юридического лица (изготовителя или продавца), принявшего решение производить и/или поставлять на рынок Биологически активную добавку (далее – БАД).
Стоит сразу отметить, что ни организация, уполномоченная осуществлять розничную продажу БАД (согласно п. 7.4. СанПиН 2.3.2.1290-03: розничная торговля БАД осуществляется через аптечные учреждения (аптеки, аптечные магазины, аптечные киоски и другие), ни специализированные магазины по продаже диетических продуктов, продовольственные магазины (специальные отделы, секции, киоски), не возьмет БАД на реализацию без соответствующих разрешающих документов, а именно:
- свидетельства о государственной регистрации на территории Российской Федерации;
- декларации соответствия;
- качественного удостоверения на БАД от Изготовителя.
Первый документ, с которым сталкивается Изготовитель – это СанПиН 2.3.2.1290 – 03 «Гигиенические требования производства и оборота биологически активных добавок к пище (БАД)». Он определяет ряд основных моментов, закладывающих основу дальнейшей судьбы БАД, а именно:
- требования к технической документации по производству БАД (раздел III СанПиН 2.3.2.1290 – 03). Здесь стоит остановиться и сделать акцент на том, что нельзя взять сахарную пудру и лимонную кислоту, смешать и зарегистрировать как БАД. Подобный продукт будет остановлен еще на стадии экспертизы технической документации: технических условий (ТУ) и технологической инструкции (ТИ);
- требования к упаковке БАД и информации, нанесенной на этикетки (раздел IV СанПиН 2.3.2.1290 – 03). При подаче БАД на экспертизу потребительская упаковка должна быть снабжена этикетой, на которую нанесена регламентированная законодательством информация, в дальнейшем, если БАД пройдет успешную регистрацию, Изготовитель будет обязан наносить на каждую этикетку номер свидетельства о государственной регистрации и дату его выдачи;
- санитарно – эпидемиологические требования к производству БАД. Этот пункт имеет отношение прежде всего к Изготовителю. Без получения санитарно – эпидемиологического заключения, в котором территориальный орган Роспотребнадзора (приложение № 2 к Административному регламенту) даст положительную оценку условиям (проще говоря, назовет их «соответствующими»), производство и регистрация БАД невозможны.
Итак, Изготовитель разработал ТУ, ТИ, разработал и изготовил макет этикетки, получил санитарно – эпидемиологическое заключение на производство.
Теперь он может приступить к следующей стадии регистрации БАД: изготовить партию БАД, упаковать ее в потребительскую упаковку, соответствующую СанПиН 2.3.2.1290 – 03, наклеить этикетки в соответствии с этим же нормативным документом, и начать процедуру регистрации.
Согласно Административному регламенту Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека исполнения государственной функции по государственной регистрации впервые внедряемых в производство и ранее не использовавшихся химических, биологических веществ и изготовляемых на их основе препаратов, потенциально опасных для человека (кроме лекарственных средств); отдельных видов продукции, в том числе пищевых продуктов, впервые ввозимых на территорию РФ, утвержденному Приказом Министерства здравоохранения и социального развития № 657 от 19 октября 2007 года, Изготовитель (и/или продавец) предоставляет в
Регистрирующий орган (центр «Экспертиза» Роспотребнадзора www.crc.ru ) следующие документы (Приложение № 5 к Административному регламенту):
- заявление, оформленное в соответствии с Приложением 4 к Административному регламенту;- ТУ, ТИ, рецептуру на БАД, по которым предполагается осуществлять промышленное изготовление продукции, заверенные в установленном законодательством Российской Федерации порядке;
- если ТУ и ТИ Изготовителя уже прошли ранее экспертизы, необходимо предоставить санитарно – эпидемиологическое заключение о подтверждении, заверенное в установленном законодательством Российской Федерации порядке;
- санитарно – эпидемиологическое заключение о соответствии условий производства требованиям государственных санитарно-эпидемиологических правил и нормативов, заверенное в установленном законодательством Российской Федерации порядке;
- инструкцию по применению (листок-вкладыш, аннотация) (в случае, если вся необходимая информация не может быть размещена на этикетке), заверенную подписью уполномоченного лица и печатью Изготовителя;
- потребительскую (или тарную) этикетку или ее проект, заверенный подписью уполномоченного лица и печатью Изготовителя;
- протоколы испытаний аккредитованных испытательных лабораторий (центров), заключения аккредитованных организаций (органолептические, физико-химические, микробиологические, радиологические исследования (испытания), исследования допустимого содержания химических, радиологических, биологических объектов, запрещенных компонентов и их соединений, микроорганизмов и других биологических агентов, представляющих опасность для здоровья человека в соответствии с государственными санитарно-эпидемиологическими правилами и нормативами);
- акт отбора образцов (проб) установленной формы;- при наличии товарного знака – копия свидетельства на товарный знак, заверенная в установленном порядке
- в случае, если Изготовитель и Заявитель являются разными юридическими лицами (либо Изготовителя представляет в регистрирующем органе физическое лицо), при подаче заявления и комплекта документов необходима доверенность Изготовителя о том, что он доверяет заявителю представлять свои интересы на территории Российской Федерации по осуществлению государственной регистрации продукции изготовителя, а также доверенность на право получения свидетельства о государственной регистрации БАД.
Возвращаясь немного назад, отметим, что на руках у нас имеются все документы из списка, кроме одного: протокола испытаний аккредитованного испытательного центра (лаборатории).
Экспертизы (санитарно-эпидемиологические экспертизы, а также исследования, испытания, токсикологические, гигиенические и иные виды оценок), необходимые для государственной регистрации, осуществляются федеральными государственными учреждениями – центрами гигиены и эпидемиологии (перечень учреждений размещается на официальном сайте в сети Интернет Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека: www.rospotrebnadzor.ru ), другими организациями, аккредитованными в установленном порядке (перечень организаций размещается на официальном сайте в сети Интернет Федерального агентства по техническому регулированию и метрологии: www.gost.ru ).
Однако, согласно приложению к Приказу от 12.11.2007 г. № 319 «О перечне организаций, осуществляющих санитарно-эпидемиологические экспертизы» Роспотребнадзором утвержден Примерный перечень организаций, которые могут осуществлять санитарно-эпидемиологические экспертизы, гигиенические, токсикологические и иные виды оценок для целей выдачи санитарно-эпидемиологических заключений :
-
ФГУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора.
-
ФГУЗ «Центр гигиены и эпидемиологии в г. Москве» Роспотребнадзора.
-
ГУ НИИ медицины труда РАМН (по согласованию).
-
ГУ НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина РАМН (по согласованию).
-
Федеральный научный центр гигиены им. Ф.Ф.Эрисмана Роспотребнадзора.
-
ГУ НИИ питания РАМН (по согласованию).
-
Научно-исследовательский институт гигиены и охраны здоровья детей и подростков РАМН (по согласованию).
-
НИИ физико-химической медицины Росздрава (по согласованию).
-
Российская медицинская академия последипломного образования Росздрава (по согласованию).
-
ФГУН «Санкт-Петербургский научно-исследовательский институт радиационной гигиены имени профессора П.В. Рамзаева» Роспотребнадзора.
Разумеется, это не отменяет право Изготовителя обратиться для получения протоколов испытаний в любой другой аккредитованный на такие исследования центр или лабораторию, однако указанные в перечне лабораторные центры легитимны и выданные ими протоколы безусловно будут приняты органом государственной регистрации БАД.
Таким образом, Изготовитель собрал все необходимые документы и подал их в регистрирующий орган. Регистрирующий орган регистрирует заявление, проводит экспертизу документов и в случае отсутствия нареканий, выносит решение о государственной регистрации БАД. Изготовитель оплачивает госпошлину за выдачу свидетельства, запись о зарегистрированной БАД вносится в Федеральный реестр БАД http://fp.crc.ru/gosregfr /, свидетельство о государственной регистрации выдается заявителю.
Процедура регистрации завершена.
Далее Изготовитель должен оформить на зарегистрированный БАД согласно Постановлению Правительства РФ № 982 от 01.12. 2009 «Об утверждении единого перечня продукции, подлежащей обязательной сертификации и единого перечня продукции, подтверждение соответствия которой осуществляется в форме принятия декларации и соответствии» декларацию соответствия и БАД, сопровождаемый свидетельством о государственной регистрации, декларацией соответствия и качественным удостоверением Изготовителя, имеет законное основание поступить на прилавки уполномоченных организация для реализации населению.
Документы:
2. СанПиН 2.3.2.1078-01.doc (документ MS Word 3 448 КБ).
3. СанПиН 2.3.2.1290-03.doc (документ MS Word 249 КБ).











