3. Общая фармакологическая характеристика пробиотиков
3.1. Классификация пробиотиков
В последнее десятилетие для практической ветеринарии и медицины предложено большое количество пробиотических препаратов, отличающихся по происхождению и имеющих характерные особенности в механизме действия.
В зависимости от природы составляющих пробиотики компонентов их можно разделить на следующие группы:
1. Имеющие в составе живые микроорганизмы (монокультуры или их комплексы);
2. Имеющие в составе структурные компоненты микроорганизмов - представителей нормальной микрофлоры - или их метаболиты;
3. Препараты микробного или иного происхождения, стимулирующие рост и активность микроорганизмов - представителей нормальной микрофлоры;
4. Содержащие комплекс живых микроорганизмов, их структурные компоненты и метаболиты в различных сочетаниях и соединениях, стимулирующих рост представителей нормальной микрофлоры;
5. Имеющие в составе живые генно-инженерные штаммы микроорганизмов, их структурные компоненты и метаболиты с заданными характеристиками;
6. Продукты функционального питания на основе живых микроорганизмов, их метаболитов, других соединений микробного, растительного или животного происхождения, способных поддерживать и восстанавливать здоровье через коррекцию микробной экологии организма хозяина.
С учетом действующего начала, содержащегося в пробиотиках, их подразделяют на ряд групп: аутопробиотики - действующим началом являются штаммы нормальной микрофлоры. Выделенные от конкретного животного, которые используются для обеспечения нормального микробиоценоза только животного этого вида.
Гомобиотики – действующим началом являются штаммы, выделенные от конкретного вида животных, и для них использующиеся.
Гетеропробиотики – предназначены для животных и человека без учета видовой принадлежности хозяина, первоначального носителя штамма пробиотических бактерий.
Существуют определенные требования при приготовлении пробиотиков (Тараканов, 2001), которые необходимо соблюдать:
- использовать непатогенные и нетоксичные бактерии, которые являются нормальными обитателями желудочно-кишечного тракта здоровых животных;
- пробиотики должны быть метаболически активными в преджелудках жвачных животных; без значительных потерь переносить пассаж через желудок и метаболизировать в кишечнике животных, увеличивая их рост и повышая неспецифическую резистентность организма;
- иметь высокую способность к адгезии на эпителии органов пищеварительного тракта;
- должны быть стойкими при хранении.
Микроорганизмы, используемые в качестве пробиотиков, классифицируют на 4 группы:
- аэробы - спорообразующие бактерии рода Bacillus;
- анаэробы - спорообразующие бактерии рода Clostridium;
- бактерии, продуцирующие молочную кислоту (Bifidobacterium, Lactobacillus, Enterococcus, неспорообразующие);
- дрожжи - используются в качестве сырья при изготовлении пробиотиков.
С учетом направленности действия мы предлагаем классифицировать пробиотики на следующие группы:
- используемые для обеспечения функционального питания животных;
- используемые для реабилитационной терапии и нормализации микробиоценоза после длительного применения антимикробных средств (антибиотики, сульфаниламиды, нитрофураны и др.);
- применяемые для коррекции иммунитета, стимуляции роста и развития молодняка, повышения качества продукции;
- применяемые для терапии при заболеваниях бактериальной и вирусной этиологии.
12. Терапевтическая эффективность ветома 1.1 при колибактериозе у цыплят-бройлеров
Несмотря на усилия ветеринарной службы по проведению массовой вакцинации животных против кишечных инфекций, усовершенствованию схем применения известных и поиска новых антибиотиков, заболеваемость и падеж молодняка, вызванные болезнями желудочно-кишечного тракта, остаются высокими (Малик и соавт., 2001).
Многочисленные литературные данные свидетельствуют о том, что диарею у новорожденных не всегда вызывают патогенные штаммы эшерихий, сальмонелл и других известных возбудителей пищевых токсикоинфекций. Во многих случаях болезнь ассоциирована с непатогенными микроорганизмами либо возбудителя не выявляют. Доказано, что антибиотики нарушают кишечный микробиоценоз, и после их применения очень часто развивается диарея (Микельсаар, 1990; Карпуть, 1996; Хапугин и соавт., 1999).
Сдвиги в количественном и качественном составе условно-патогенной и нормальной кишечной микрофлоры, обозначаемые как дисбактериоз, – один из факторов развития диарейного синдрома. Наличие связи между соматическими болезнями матери и потомства, кишечным дисбактериозом и повышением вирулентных свойств у условно-патогенных микроорганизмов подтверждено клиническими и экспериментальными исследованиями (Nurmi et al., 1973; Uoid et al., 1977; Антипов, 1981; Wren, 1987; Мурашова и соавт., 1999; Панин и соавт., 2000).
Профилактика желудочно-кишечных болезней приобретает социальную значимость, поскольку параллельно с увеличением потребления говядины, свинины и мяса птицы возрастает контаминация возбудителями пищевых токсикоинфекций человека, а именно сальмонеллами, иерсиниями, эшерихиями и другими микроорганизмами.
Это обстоятельство потребовало пересмотра сложившихся методологических подходов к профилактике и лечению желудочно-кишечных болезней и необходимости разработки нового поколения экологически безопасных препаратов, направленных на коррекцию кишечного биоценоза животных и повышение колонизационной резистентности слизистой кишечника к контаминации условно-патогенной микрофлорой.
Как указывают исследователи многих стран, в профилактике и лечении желудочно-кишечных болезней молодняка велико значение заместительной терапии, направленной на восстановление кишечного биоценоза путем регуляторного введения живых бактерий – представителей нормальной кишечной микрофлоры (Fox, 1988; Fuller, 1989; Bariram et al., 1994; Лагуткин, 1995; Gallaher et al., 1996; Воробьев и соавт., 1999; Мурашова и соавт., 1999; Коршунов и соавт., 1995,2000; Ноздрин и соавт., 2001). Препараты, в состав которых они входят, называют пробиотиками (Gilliland et al., 1977; Антипов, 1991; Придыбайло, 1991; Krause et al., 1995).
В числе фармакологических средств, применяемых с лечебно-профилактической целью при бактериальных инфекциях, необходимо шире использовать пробиотики. Это подтверждают данные H.P. Barirama et al. (1994), Н.И. Лагуткина (1995), D.D. Gallaher et al. (1996), А.А. Воробьева и соавт. (1999), А.О. Мурашовой и соавт. (1999), В.М. Коршунова и соавт. (2000), Г.А. Ноздрина и соавт. (2001).
Многокомпонентный состав и разностороннее фармакологическое действие позволяют применять пробиотики с высоким эффектом для профилактики и лечения желудочно-кишечных болезней и дисбактериозов, нарушений обмена веществ (анемии, гиповитаминозы и др.), регуляции постстрессовых состояний, особенно в период технологически обязательных мероприятий, коррегирования антимикробной терапии, предупреждения рецидивов болезней.
Новым направлением в применении пробиотиков является разработка препаратов, основу которых составляют бациллы – бактерии рода Bacillus. Привлекательность этих микроорганизмов объясняется исследователями их безвредностью для организма животного, даже в концентрациях, значительно превышающих те, что рекомендуются для применения, за исключением B. cereus и B. anthracis. Микроорганизмы, содержащиеся в пробиотических препаратах, способны повышать неспецифическую резистентность организма, подавлять развитие многих патогенных и условно-патогенных микроорганизмов, обладают противоаллергенным и антитоксическим действием, имеют ферментные системы, способные регулировать и стимулировать пищеварение (Гончарова, 1986; Лянная и соавт., 1986; Гончарова и соавт., 1987; Шендеров и соавт., 1997; Veld et al., 1998).
Т.А. Кашперова и соавт. (2000) при изучении эффективности субалина в промышленном производстве цыплят-бройлеров установили, что пробиотик обладает лечебно-профилактическим действием, антистрессовыми качествами, приводит к нормализации кишечной микрофлоры и улучшению обменных процессов у птицы, повышает сохранность молодняка.
R. Miles et al. (1981) установили, что добавление в рационы кур ацидофильной палочки положительно влияет на яйценоскость, качество яиц и микрофлору пищеварительного тракта.
В.Ф. Оркин и соавт. (1986), применяя бифидумбактерин для нормализации кишечной микрофлоры, установили, что пероральное введение бифидумбактерина с профилактической целью в течение 4 дней подряд через каждые 24 ч снижает заболеваемость цыплят энтеритом в 3 раза. Использование пробиотика для лечения энтерита у цыплят однократно в сутки в течение 8 дней уменьшает падеж более чем в 2 раза по сравнению с контролем.
Приведенные данные свидетельствуют о том, что создание пробиотиков и их широкое применение являются сегодня стратегическим направлением в профилактике и борьбе со многими инфекционными и неинфекционными заболеваниями.
Ветом 1.1 – препарат сравнительно новой группы пробиотиков, действие которого в отношении птиц изучено еще не достаточно.
Исследования по определению терапевтической эффективности проводили на 30-дневных цыплятах-бройлерах кросса «Смена-2», больных колибактериозом. Колибактериоз (колисептицемия, колиинфекция, колиэнтерит, колиперитонит, эшерихиоз) – инфекционное заболевание птиц, вызываемое патогенной кишечной палочкой, относящейся к различным серологическим – антигенным вариантам (01, 02, 078, 0111 и др.). Колибактериозом болеют сельскохозяйственные птицы всех возрастов, наиболее восприимчив молодняк кур 1-120-дневного возраста, у которого болезнь протекает остро и подостро в септической и токсико-септической форме (Радчук, 1990).
Диагноз был установлен на основании эпизоотологических данных, анализа клинических признаков болезни, патолого-анатомических изменений и результатов бактериологического исследования. По принципу аналогов были сформированы две опытных и одна контрольная группы по 18 цыплят в каждой. При подборе учитывали: возраст, живую массу, выраженность и стадию заболевания.
Цыплят-бройлеров 1-й опытной группы лечили ветомом 1.1 в дозе 100 мг/кг массы 2 раза в сутки до выздоровления, молодняку 2-й опытной группы ветом 1.1 назначали 3 раза в сутки в дозе 100 мг/кг массы до выздоровления; в обоих случаях препарат давали с кормом. Птицу контрольной группы лечили неомицина сульфатом (традиционный метод лечения, применяемый в хозяйстве).
При колибактериозе исследования крови проводили до лечения, через 5 и 15 суток после выздоровления. Кровь у цыплят брали из крыловой вены, стабилизировали 1 %-м раствором гепарина на дистиллированной воде (2 капли на 5 мл крови).
У больных цыплят отмечали общую слабость, отсутствие аппетита, жажду, снижение подвижности, замедленную реакцию на внешние раздражители, слезотечение, затрудненное дыхание, понос, повышение температуры тела на (1-2) 0С.
При вскрытии трупов цыплят зафиксированы следующие изменения: подкожная клетчатка в области подгрудка содержит инфильтрат розово-желтого цвета, студенистой консистенции; сердце увеличено, сердечная сорочка тусклая с пленками фибрина, на эндокарде кровоизлияния; легкие отечные, ярко-красные; в брюшной полости небольшое количество кровянистой жидкости; грудные и брюшные воздухоносные мешки местами покрыты пленками фибрина серо-белого цвета; сосуды кишечника и брыжейки кровенаполнены; слизистая оболочка тонкого и толстого отделов кишечника почти на всем протяжении набухшая, гиперемирована, пропитана серозным экссудатом; печень увеличена, капсула шероховатая с налетом фибрина; селезенка кровенаполнена, незначительно увеличена; почки увеличены, темно-вишневого цвета, кровенаполнены.
Успешная терапия и профилактика инфекционных болезней во многом зависят от правильного выбора как самого препарата, так и метода его применения. При этом следует помнить, что многие препараты, кроме специфического действия на патогенный агент, оказывают влияние и на организм птиц (на витаминный баланс, иммунобиологическую реактивность и т.д.). Это необходимо учитывать при их назначении.
Под влиянием ветома 1.1 у подопытных цыплят-бройлеров 1-й и 2-й групп отмечали улучшение общего состояния, прекращение слезотечения на (2-3)-й день, повышение аппетита, снижение температуры тела, нормализацию дыхания и акта дефекации – на 4-й день. Каловые массы приобретали естественный вид и консистенцию соответственно на 4-й и 5-й день, а у цыплят контрольной группы - на (4-5)-й; 6-й и (7-8)-й день после начала лечения соответственно. Выздоровление наступало у цыплят 1-й и 2-й групп в среднем на 5-й и 6-7-й день, а у цыплят контрольной группы на 8-9-й день после начала лечения.
За опытный период в 1-й группе пали 2 цыпленка, во второй – 3, а в контрольной – 5 (табл. 58).
Таблица 58. Показатели эффективности терапии при колибактериозе у подопытных цыплят-бройлеров
|
Группа |
Количество цыплят |
Терапевтическая эффективность, % |
|
|
на начало опыта |
на конец опыта |
||
|
Контрольная |
18 |
13 |
72,2 |
|
1-я опытная |
18 |
16 |
88,8 |
|
2-я опытная |
18 |
15 |
83,3 |
Результаты нашего опыта показали, что использование ветома 1.1 для лечения цыплят-бройлеров 1-й и 2-й опытных групп, больных колибактериозом, позволило сократить продолжительность лечения на 2-4 дня, повысить терапевтическую эффективность по сравнению с контролем соответственно на 23 и 15,4 %.
Максимальный эффект получен при применении препарата в дозе 100 мг/кг массы 2 раза в сутки до выздоровления, которое наступало у цыплят-бройлеров 1-й опытной группы раньше на 1-2 дня. Терапевтическая эффективность также была выше на 5,6 % по сравнению с аналогами из 2-й группы.
У 30-суточных цыплят при колибактериозе отмечали увеличение в крови количества лейкоцитов, общего белка, b-, g-глобулинов, эозинофилов, лимфоцитов и снижение количества эритроцитов, гемоглобина и гематокрита.
Через 5 суток после выздоровления у 40-суточных цыплят 1-й и 2-й опытных групп содержание лейкоцитов в крови было ниже исходных данных соответственно на 42,8 и 51,9 %, эритроцитов выше на 33,7 и 24,2 %, концентрация гемоглобина возросла на 17,9 и 6,9 %, уровень гематокрита - на 11,6 и 10,9 %. У цыплят контрольной группы содержание лейкоцитов в крови было ниже исходных данных на 83 %, эритроцитов выше на 21,7 %, концентрация гемоглобина возросла на 10,2 %, а уровень гематокрита снизился на 20,9 %.
Таблица 59. Динамика морфологических показателей крови цыплят-бройлеров при колибактериозе
|
Группа |
До лечения |
Через 5 суток после выздоровления |
Через 15 суток после выздоровления |
|
Лейкоциты, 109/л |
|||
|
Контрольная |
34,94±0,11 |
19,08±0,09 |
16,28±0,16 |
|
1-я опытная |
34,86±0,26 |
24,42±0,28*** |
21,74±0,35*** |
|
2-я опытная |
34,46±0,46 |
22,68±0,23*** |
22,10±0,70*** |
|
Эритроциты, 1012/л |
|||
|
Контрольная |
1,66±0,14 |
2,02±0,23 |
1,52±0,07 |
|
1-я опытная |
1,78±0,09 |
2,38±0,19 |
2,18±0,11*** |
|
2-я опытная |
1,90±0,11 |
2,36±0,13 |
2,06±0,14** |
|
Гемоглобин, г/л |
|||
|
Контрольная |
70,52±3,99 |
77,70±3,56 |
66,88±3,28 |
|
1-я опытная |
71,44±3,40 |
84,22±2,42 |
82,06±2,66** |
|
2-я опытная |
79,24±1,72# |
84,72±2,07 |
79,14±3,27* |
|
Гематокрит, % |
|||
|
Контрольная |
20,8±1,59 |
17,2±1,20 |
20,2±1,24 |
|
1-я опытная |
22,4±1,94 |
25,0±0,71*** |
26,2±1,32* |
|
2-я опытная |
20,2±2,15 |
22,4±1,57*** |
24,6±1,81# |
По сравнению с аналогами из контроля у птицы 1-й и 2-й опытных групп содержание лейкоцитов в крови было выше соответственно на 27,9 и 18,9 % (P<0,001), эритроцитов – на 17,8 и 16,8 % (Р>0,1), гемоглобина - на 8,3 и 9,0 % (Р>0,1) и уровень гематокрита - на 45,3 и 30,2 % (P<0,001).
Через 15 суток после выздоровления у 50-суточных цыплят-бройлеров 1-й и 2-й опытных групп по сравнению с аналогами из контроля содержание лейкоцитов в крови было выше соответственно на 33,5 и 35,7 %, эритроцитов - на 43,4 и 34,5 % (P<0,001), гемоглобина - на 22,6 (P<0,001) и 18,3 % (P<0,05), уровень гематокрита - на 29,7 (P<0 ,05) и 21,7 % (P<0,1) (табл. 59).
Увеличение количества лейкоцитов, эритроцитов, гемоглобина и гематокритной величины в крови цыплят-бройлеров опытных групп в ходе эксперимента находилось в пределах физиологических норм.
Влияние ветома 1.1 на динамику общего белка и белковых фракций в сыворотке крови подопытной птицы при колибактериозе отражено в табл. 60.
Через 5 суток после выздоровления у 40-суточных цыплят контрольной и 2-й опытной групп количество общего белка в крови было ниже исходных данных соответственно на 2 и 1,1 %, а у птицы 1-й опытной группы оставалось на прежнем уровне. Содержание альбуминов в крови цыплят контрольной, 1-й и 2-й опытных групп относительно исходных данных снижалось соответственно на 12; 6,9 и 10,8 %, a-глобулинов увеличивалось у птицы контрольной группы на 13,4 %, а в 1-й и 2-й снижалось соответственно на 21,2 и 6,4 %. Содержание b-глобулинов в крови цыплят контрольной, 1-й и 2-й групп снижалось соответственно на 51; 8,9 и 12 %, а g-глобулинов увеличивалось на 25,9; 43,2 и 32,6 %. По сравнению с аналогами из контроля в крови подопытных цыплят 1-й и 2-й групп количество общего белка было выше соответственно на 2 и 0,9 % (P>0,1), альбуминов - на 7,7 и 5,7 % (P>0,1), b-глобулинов - на 43 (P<0,001) и 35,2 % (Р<0,05), g-глобулинов - на 11,5 и 7 % (P>0,1). Количество a-глобулинов в крови у цыплят 1-й и 2-й опытных групп было ниже аналогов из контроля соответственно на 42 (Р<0,1) и 28,3 % (P>0,1).
Таблица 60. Динамика общего белка и белковых фракций в сыворотке крови цыплят-бройлеров при колибактериозе
|
Группа |
До лечения |
Через 5 суток после выздоровления |
Через 15 суток после выздоровления |
|
Общий белок, г/л |
|||
|
Контрольная |
45,1±0,16 |
44,2±0,21 |
45,1±0,16 |
|
1-я опытная |
45,1±0,16 |
45,1±0,09 |
45,5±0,11 |
|
2-я опытная |
45,1±0,16 |
44,6±0,09 |
45,5±0,04 |
|
Альбумины, % |
|||
|
Контрольная |
34,08±11,41 |
30,41±10,92 |
41,39±1,78 |
|
1-я опытная |
35,01±12,79 |
32,75±1,76 |
34,88±1,32# |
|
2-я опытная |
35,61±11,36 |
32,14±2,93 |
35,3±1,21# |
|
a-глобулины, % |
|||
|
Контрольная |
29,30±14,70 |
33,23±2,69 |
24,28±3,71 |
|
1-я опытная |
28,28±12,02 |
23,33±1,75# |
21,58±1,80 |
|
2-я опытная |
27,55±16,05 |
25,90±1,65 |
22,59±1,22 |
|
b-глобулины, % |
|||
|
Контрольная |
16,21±4,59 |
10,72±0,67 |
10,03±1,07 |
|
1-я опытная |
16,70±4,74 |
15,33±0,32*** |
14,04±1,16 |
|
2-я опытная |
16,24±10,18 |
14,49±0,52* |
12,26±0,92 |
|
g-глобулины, % |
|||
|
Контрольная |
20,36±5,30 |
25,64±1,62 |
24,29±1,67 |
|
1-я опытная |
19,97±5,92 |
28,59±0,68 |
29,50±0,75# |
|
2-я опытная |
20,72±8,57 |
27,47±0,24 |
29,85±1,08 |
Через 15 суток после выздоровления у 50-суточных цыплят-бройлеров 1-й и 2-й опытных групп по сравнению с аналогами из контроля количество общего белка в крови было выше на 0,9 % (P>0,1). Альбуминов и a-глобулинов в крови цыплят 1-й и 2-й групп было меньше, чем у аналогов из контроля, соответственно на 18,7 и 17,3 % (P<0,1) и на 12,5 и 7,5 % (Р>0,1). Содержание b- и g-глобулинов в крови цыплят 1-й и 2-й групп по сравнению с контролем было выше соответственно на 40 и 22 % (P>0,1) и 21,4 % (Р<0,1) и 22,9 % (Р>0,1).
У 30-суточных цыплят при колибактериозе отмечали снижение в крови бактерицидной активности, количества Т-лимфоцитов и повышение количества В-лимфоцитов (табл. 61, 63).
Бактерицидная активность сыворотки крови цыплят опытных групп на протяжении всего опыта с различной степенью достоверности была выше, чем у контрольной группы (табл. 61).
Таблица 61. Динамика бактерицидной активности сыворотки крови подопытных цыплят при колибактериозе, %
|
Группа |
До лечения |
Через 5 суток после лечения |
Через 15 суток после лечения |
|
Контрольная |
49,85±0,61 |
47,99±0,47 |
49,19±0,35 |
|
1-я опытная |
49,89±0,65 |
51,49±1,47* |
53,41±0,61*** |
|
2-я опытная |
49,85±0,61 |
49,80±0,32# |
51,59±0,53** |
Через 5 суток после выздоровления у 40-суточных цыплят 1-й группы уровень бактерицидной активности сыворотки крови (БАСК) по сравнению с исходными данными увеличивался на 3,2 %, а во 2-й и контрольной группах снижался соответственно на 0,1 и 3,9 %. По сравнению с аналогами из контроля у птицы 1-й и 2-й групп исследуемый показатель был выше соответственно на 7,3 (P<0,05) и 3,8 % (P<0,1).
Через 15 суток после выздоровления у 50-суточных цыплят-бройлеров 1-й и 2-й групп уровень БАСК превышал контроль соответственно на 8,6 (Р<0,001) и 4,9 % (P<0,01) (рис.13 ).
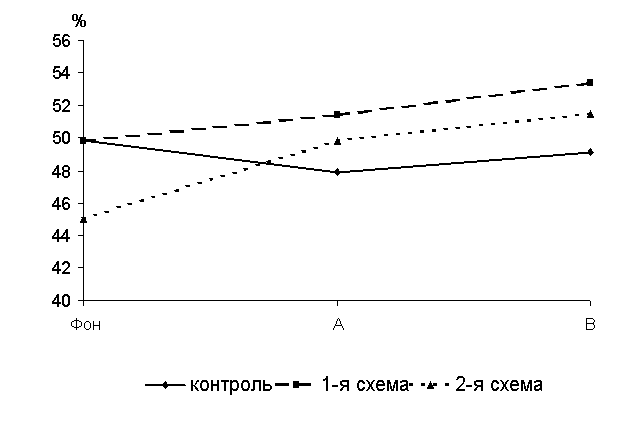 Рис.13 Динамика бактерицидной активности сыворотки крови цыплят, больных колибактериозом, при применении ветома 1.1, %: А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Рис.13 Динамика бактерицидной активности сыворотки крови цыплят, больных колибактериозом, при применении ветома 1.1, %: А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Лизоцимная активность сыворотки крови цыплят-бройлеров опытных групп также на протяжении всего опыта с различной степенью достоверности была выше, чем у птиц контрольной группы (табл. 62).
Через 5 суток после выздоровления у 40-суточных цыплят 1-й, 2-й опытных и контрольной групп уровень лизоцимной активности сыворотки крови (ЛАСК) по сравнению с исходными данными увеличивался соответственно на 23,6; 11 и 11, 2 %. По сравнению с аналогами из контроля у птицы 1-й и 2-й опытных групп исследуемый показатель был выше на 14 (P<0,05) и 5,8 % (рис.14).
Через 15 суток после выздоровления у 50-суточных цыплят-бройлеров 1-й и 2-й опытных групп по сравнению с аналогами из контроля уровень ЛАСК превышал соответственно на 23 (Р<0,01) и 13,5% (P<0,05).
Таблица 62. Динамика лизоцимной активности сыворотки крови подопытных цыплят при колибактериозе, %
|
Группа |
До лечения |
Через 5 суток после выздоровления |
Через 15 суток после выздоровления |
|
Контрольная |
25,77±1,61 |
28,67±1,51 |
31,28±1,65 |
|
1-я опытная |
26,44±1,56 |
32,69±0,99* |
38,48±1,10** |
|
2-я опытная |
27,32±0,98 |
30,33±0,89 |
35,49±0,89* |
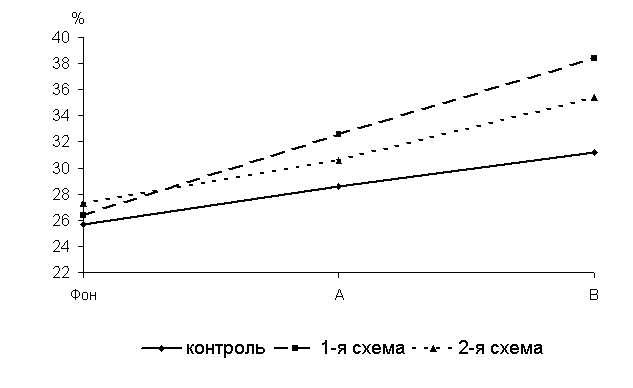
Рис.14 Динамика лизоцимной активности сыворотки крови цыплят, больных колибактериозом, при применении ветома 1.1, % : А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Влияние ветома 1.1 на динамику В-лимфоцитов в крови подопытной птицы отражено в табл. 63.
Таблица 63. Количество В-лимфоцитов в крови подопытных цыплят при колибактериозе, 109/л
|
Группа |
До лечения |
Через 5 суток после выздоровления |
Через 15 суток после выздоровления |
|
Контрольная |
3,6±0,97 |
2,2±0,22 |
3,4±1,03 |
|
1-я опытная |
3,4±0,84 |
3,2±0,22** |
4,8±0,84* |
|
2-я опытная |
3,8±0,55 |
3,0±0,00** |
4,6±0,27 |
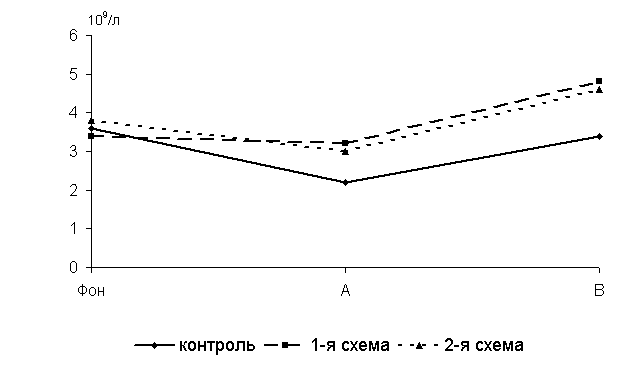 Рис.15 Динамика количества В-лимфоцитов у цыплят, больных колибактериозом, при применении ветома 1.1, 109/л: А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Рис.15 Динамика количества В-лимфоцитов у цыплят, больных колибактериозом, при применении ветома 1.1, 109/л: А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Через 5 суток после выздоровления у 40-суточных цыплят 1-й, 2-й опытных и контрольной групп количество В-лимфоцитов в крови по сравнению с исходными данными уменьшалось соответственно на 6,3; 26,7 и 63,6%. По сравнению с аналогами из контроля у птицы 1-й и 2-й групп исследуемый показатель был выше соответственно на 45,5 и 36,3 % (P<0,01) (рис.15).
Через 15 суток после выздоровления у 50-суточных цыплят-бройлеров 1-й и 2-й групп по сравнению с аналогами из контроля исследуемый показатель был выше на 41,2 (P<0,05) и 35,3 %.
Динамика Т-лимфоцитов в крови подопытных цыплят при колибактериозе отражена в табл. 64.
Таблица 64. Количество Т-лимфоцитов в крови подопытных цыплят при колибактериозе, 109/л
|
Группа |
До лечения |
Через 5 суток после выздоровления |
Через 15 суток после выздоровления |
|
Контрольная |
8,2±1,78 |
11,4±0,91 |
9,0±0,79 |
|
1-я опытная |
9,8±2,16 |
15,6±0,45** |
12,4±0,27** |
|
2-я опытная |
9,8±1,43 |
14,2±0,22* |
11,6±0,27** |
Через 5 суток после выздоровления у 40-суточных цыплят 1-й, 2-й опытных и контрольной групп количество Т-лимфоцитов в крови по сравнению с исходными данными увеличивалось соответственно на 59; 44,9 и 39 % (рис.16).
По сравнению с аналогами из контроля у птицы 1-й и 2-й групп исследуемый показатель был выше на 36,8 (P<0,01) и 24,6 % (P<0,05).
Через 15 суток после выздоровления у 50-суточных цыплят 1-й и 2-й групп по сравнению с аналогами из контроля исследуемый показатель был выше соответственно на 37,7 и 28,8 % (P<0,01). У цыплят-бройлеров при колибактериозе под влиянием ветома 1.1 происходит значительное увеличение биосинтеза в организме Т-лимфоцитов, что свидетельствует о выраженной стимуляции клеточных факторов иммунитета.
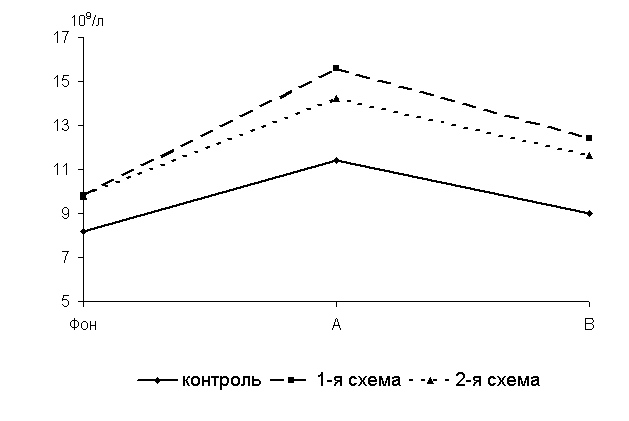 Рис.16. Динамика количества Т-лимфоцитов у цыплят, больных колибактериозом, при применении ветома 1.1, 109/л: А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Рис.16. Динамика количества Т-лимфоцитов у цыплят, больных колибактериозом, при применении ветома 1.1, 109/л: А – через 5 суток после выздоровления, B – через 15 суток после выздоровления
Влияние ветома 1.1 на динамику видового состава лейкоцитов в крови цыплят, больных колибактериозом, отражено в табл. 65.
Через 5 суток после выздоровления у 40-суточных цыплят опытных групп по сравнению с исходными данными количество базофилов в крови оставалось на прежнем уровне, а в контрольной уменьшалось на 9%. Количество псевдоэозинофилов, моноцитов в крови цыплят 1-й, 2-й опытных и контрольной групп было выше соответственно на 3,4; 1,7 и 2,6; 25; 45,5 и 16,6 %, а число эозинофилов, лимфоцитов уменьшилось на 9,1; 8,8; и 2,6; 1,3; 1,3 и 0,9 %.
Таблица 65. Динамика лейкограммы подопытных цыплят при колибактериозе, %
|
Время исследования |
Группа |
Виды лейкоцитов |
||||
|
Б |
Э |
П |
Л |
М |
||
|
Фоновые показатели |
Контрольная |
2,4±0,27 |
7,8±0,22 |
23,4±0,27 |
64,0±1,27 |
2,4±0,27 |
|
1-я группа |
2,4±0,45 |
7,2±0,22 |
23,6±0,45 |
64,4±1,04 |
2,4±0,27 |
|
|
2-я группа |
2,4±0,27 |
7,4±0,27 |
23,8±0,42 |
64,2±0,96 |
2,2±0,22 |
|
|
Через 5 суток после выздоровления |
Контрольная |
2,2±0,22 |
7,6±0,27 |
24,0±1,12 |
63,4±0,27 |
2,8±0,22 |
|
1-я группа |
2,4±0,27 |
6,6±0,27 |
24,4±0,67 |
63,6±0,27 |
3,0±0,00 |
|
|
2-я группа |
2,4±0,45 |
6,8±0,22 |
24,2±0,74 |
63,4±0,27 |
3,2±0,22 |
|
|
Через 15 суток после выздоровления |
Контрольная |
2,2±0,22 |
7,4±0,91 |
24,2±0,22 |
64,0±0,00 |
2,2 ±0,22 |
|
1-я группа |
2,4±0,27 |
5,6±0,45 |
24,6±0,27 |
64,4±0,27 |
3,0±0,00** |
|
|
2-я группа |
2,4±0,27 |
5,8±0,45 |
24,4±0,27 |
64,4±0,45 |
3,0±0,00** |
|
** Р<0,01.
По сравнению с аналогами из контроля у цыплят-бройлеров 1-й опытной группы количество базофилов, псевдоэозинофилов, лимфоцитов и моноцитов в крови было выше аналогов из контроля соответственно на 9, 1,7, 0,3 и 7%, а число эозинофилов уменьшилось на 15 % (P>0,1).
У цыплят 2-й группы число базофилов, псевдоэозинофилов, моноцитов также было выше аналогов из контроля соответственно на 9, 0,8, и 14 %, количество лимфоцитов было одинаковым, а число эозинофилов уменьшилось на 12 % (P>0,1).
Через 15 суток после выздоровления количество базофилов в крови цыплят 1-й и 2-й групп превышало аналогов из контроля на 9 %, а число псевдоэозинофилов, лимфоцитов и моноцитов возрастало соответственно на 1,7 и 0,8; 0,6 и 0,6 % (P>0,1) и 36 и 36 % (P<0,01), количество эозинофилов уменьшилось на 32 и 28 % (P>0,1).
Анализ лейкограммы показал: применение ветома 1.1 при колибактериозе цыплят-бройлеров вызывало умеренное повышение числа лимфоцитов, моноцитов, псевдоэозинофилов, что свидетельствует о стимулировании препаратом реакций клеточного иммунитета.
Относительно влияния пробиотиков на гематологические показатели молодняка сельскохозяйственных животных при терапии желудочно-кишечных патологий данные в научной литературе разноречивы. Так, В.И. Мозжерин и соавт. (2000) существенных изменений морфобиохимических показателей крови телят при использовании бактиспорина не выявили. Нами установлено, что ветом 1.1 оказывал положительное влияние на гематологические показатели цыплят-бройлеров, больных колибактериозом. Выраженные изменения исследуемых показателей отмечали при применении препарата по оптимальной схеме на 40-е сутки исследования. Так, в крови подопытных цыплят-бройлеров достоверно увеличивалось количество лейкоцитов, эритроцитов, гемоглобина, Т- и В-лимфоцитов и гематокритной величины соответственно на 27,9; 17,8; 8,3; 36,8 и 45,4 и 45,3 %; нормализовалась лейкоцитарная формула крови, увеличивалось количество лимфоцитов, псевдоэзинофилов, моноцитов и снижалось число эозинофилов соответственно на 0,3, 1,7, 7 и 15 %; в сыворотке крови возрастали бактерицидная и лизоцимная активность, содержание общего белка, альбуминов, b- и g- глобулинов соответственно на 2; 7,7; 43 и 11,5 % по сравнению с аналогами из контроля.
Наши данные соответствуют результатам, полученным В.П. Иноземцевым и соавт. (1998), которые изучали терапевтическую эффективность ветома 1.1 у телят с синдромом диареи. Г.А. Ноздрин и соавт. (2001) наблюдали у подопытных ягнят при гастроэнтеритах увеличение количества гемоглобина на 5 %, эритроцитов - на 20,5 %, лейкоцитов на 21,1 % по сравнению с контролем при применении препарата ноздрин.
Установлено, что препарат оказывает позитивное влияние на интенсивность роста подопытных цыплят-бройлеров после выздоровления.
Средняя масса цыплят, больных колибактериозом, до лечения равнялась 431 г, а согласно нормативам по кроссу «Смена», она должна составлять в 4-недельном возрасте 730 г (табл. 66).
После выздоровления масса цыплят во всех группах постепенно увеличивалась, но имелись некоторые различия в интенсивности роста. У цыплят-бройлеров 1-й и 2-й опытных групп в 40-суточном возрасте, через 5 суток после выздоровления, прирост живой массы относительно исходных данных составлял 49 и 46,5 %, а у аналогов из контрольной – 31,6 %. Следовательно, при применении препарата прирост массы тела был выше аналогов из контроля в среднем на 12,7 % (табл. 66).
Таблица 66. Динамика абсолютной массы тела подопытных цыплят после выздоровления, г
|
Группа |
До лечения |
Через 5 суток после выздоровления |
Через 15 суток после выздоровления |
|
Контрольная |
430,0±20,24 |
565,7±13,78 |
811,4±14,87 |
|
1-я опытная |
435,7±19,86 |
649,3±16,13** |
1000,0±10,00*** |
|
2-я опытная |
427,1±19,11 |
625,7±18,11* |
965,7±13,07*** |
В 40-суточном возрасте, через 5 суток после выздоровления, цыплята 1-й и 2-й групп по абсолютной массе превышали аналогов из контроля соответственно на 14,7 (Р<0,01) и 10,6 % (Р<0,05).
В 50-суточном возрасте, через 15 суток после выздоровления, цыплята-бройлеры 1-й и 2-й групп по абсолютной массе превышали аналогов из контроля соответственно на 23 и 19% (Р<0,001).
Аналогичные нашим результаты при пробиотикотерапии желудочно-кишечных заболеваний поросят, ягнят, телят, цыплят получены В.В. Субботиным и соавт. (1991), П.И. Ждановым (1994), А.Н. Паниным и соавт. (1996), В.И. Мозжериным и соавт. (2000), О.Ю. Леденевой и соавт. (2001), Н.И. Маликом и соавт. (2001).
Из литературных источников известно, что бифидобактерии способствуют более полному гидролизу как растительных, так и животных белков. Это приводит к нескольким положительным эффектам. Во-первых, повышается усвояемость кормов. Во вторых, снижается вероятность развития кормовой непереносимости и связанных с ней кожных заболеваний из-за накопления в толстом отделе кишечника частично не переваренных белков, поскольку бифидобактерии проявляют в отношении их протеолитическую активность. Кроме того, в результате более полного гидролиза, а также превращений продуктов метаболизма увеличивается обеспеченность организма незаменимыми аминокислотами.
Следовательно, можно предполагать, что ветом 1.1 обладает подобным действием и оказывает позитивное влияние на обменные процессы в организме, а также способствует купированию воспалительного процесса, восстановлению нормальной функции желудочно-кишечного тракта и улучшению усвоения кормов за счет стимулирующего влияния на макроорганизм.
Экономическую эффективность применения ветома 1.1 устанавливали путем определения ущерба от падежа, снижения продуктивности, затрат на проведение ветеринарных мероприятий.
За период опыта ущерб от падежа составил в 1-й и 2-й опытных группах соответственно 67,3 и 100,95 руб., а в контрольной – 168,25 руб.
Ущерб от снижения продуктивности цыплят 1-й и 2-й групп составил соответственно 671,90 и 656,96 руб.
Затраты на проведение ветеринарных мероприятий составили в 1-й и 2-й группах соответственно 702,70 и 704,67 руб.
Экономическая эффективность на 1 руб. затрат в 1-й и 2-й группах составила 19,25 и 13,23 руб.
Таким образом, ветом 1.1 оказывает выраженное терапевтическое действие при колибактериозе. У цыплят 1-й и 2-й опытной группы по сравнению с аналогами из контроля сохранность была выше соответственно на 23 и 6,7 %, терапевтическая эффективность - на 4,5 и 1,5 дня, интенсивность роста выше на 12,7 и 3,6 %. После выздоровления в крови цыплят-бройлеров опытных групп регистрируется более высокое содержание эритроцитов, гемоглобина, общего белка, b- и g-глобулинов, В- и Т-лимфоцитов, псевдоэзинофилов, моноцитов и уровня гематокрита, БАСК, ЛАСК. Обобщая полученные данные, можно сделать вывод, что ветом 1.1 оказывает стимулирующее влияние на лимфоцитопоэз и, следовательно, на гуморальный и тканевый иммунитет, так как происходит одновременное повышение количества В- и Т-лимфоцитов, возрастает бактерицидная и лизоцимная активность сыворотки крови. В результате позитивных изменений, происходящих в организме под влиянием ветома 1.1, происходит повышение неспецифической резистентности организма цыплят-бройлеров при колибактериозе в пределах физиологических возможностей. Выраженность этих изменений зависит от терапевтических схем применения препарата. Максимальный эффект достигнут при применении пробиотика в дозе 100 мг/кг массы 2 раза в сутки до выздоровления. Применение ветома 1.1 при колибактериозе цыплят-бройлеров экономически оправдано.
Общество с ограниченной ответственностью Торговый дом «Исследовательский центр-23»
Адрес: Россия, 630559, Новосибирская область, Новосибирский район, р.п. Кольцово, промзона, корпус 200
Адрес для переписки: Россия, 630559, Новосибирская область, Новосибирский район, р.п. Кольцово, а/я 247
Телефон/факс: (383) 204-92-68, 20496-14, 325-30-76, 204-96-36, 325-30-73, 363-47-23, 204-91-62.
E-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Для возврата в оглавление нажмите стрелку в левом вехнем углу браузера.
Розничный прайс-лист продукции НПФ Исследовательский центр от
08 декабря 2017 г
| Сокращения: | |
|---|---|
| 1) капс. - капсулы; 2) № - количество доз в единице товара; 3) пор. - порошок; 4) пак. пакет из ламинированной бумаги; 5) п/б - пластиковая банка; |
6) п/ф - пенициллиновый флакон; 7) с/п флакон из пластика с пипеткой; 8) спрей - флакон из пластика с распылителем; 9) 1 мл=1 см3. |
Препараты в стадии испытаний.
Утверждаю:
Заместитель Руководителя
Россельхознадзора
Е.А. Непоклонов
3 марта 2008г.
Инструкция
по применению Ветома 4 для профилактики и лечения дисбактериозов,
повышения естественной резистентности организма животных, птиц, пушных зверей
(организация - производитель: ООО НПФ «Исследовательский центр», г. Новосибирск)
I Общие сведения
1. Ветом 4 (Vetom 4).
2. Ветом 4 содержит иммобилизованную высушенную споровую биомассу бактерий Bacillus licheniformis штамм ВКПМ В 7038 и наполнитель - сахар или сахарную пудру и крахмал. В 1 грамме Ветома 4 содержится не менее 1х106 КОЕ (колониеобразующих единиц) живых микробных клеток. Не содержит ГМО.
3. Ветом 4 представляет собой однородный сыпучий порошок белого цвета, сладкого вкуса, без запаха, растворимый в воде с образованием осадка белого цвета.
4. Ветом 4 расфасовывают по 2, 5, 10, 50, 100, 200, 500, 1000 г в пакеты из ламинированной бумаги или банки из полимерных материалов. Пакеты герметично запаивают, банки запаивают металлической фольгой и закрывают пластмассовыми крышками. Каждую единицу фасовки снабжают инструкцией по применению и этикеткой с указанием: наименования организации - производителя; наименования - препарата; количества препарата; номера партии; номера контроля; даты изготовления (месяц, год); срока годности; условий хранения; обозначения ТУ, надписи «Для животных».
5. Хранят Ветом 4 в сухом, чистом, защищенном от света и хорошо вентилируемом
помещении при температуре не выше 20 С.
Срок годности Ветома 4-48 месяцев со дня изготовления. Ветом 4 после истечения срока годности применяться не должен.
II Биологические свойства
6. Бактерии Bacillus licheniformis штамм ВКПМ В 7038, используемые для изготовления препарата, отличаются высокой устойчивостью к пищеварительным сокам и ферментам желудочно-кишечного тракта (ЖКТ) млекопитающих и способностью к быстрому его заселению. В кишечнике споры бактерии трансформируются в вегетативные формы и выделяют в окружающую среду специфические антибиотики, ферменты, другие биологически активные вещества, под воздействием которых:
- стенки кишечника очищаются от неперевариваемых остатков пищи;
- нормализуется микробный состав до видоспецифического, кислотность среды,
пищеварение, всасывание и метаболизм железа, кальция, жиров, белков, углеводов, триглицеридов, аминокислот, дипептидов, Сахаров, солей желчных кислот.
7. Бактерии Bacillus licheniformis штамм ВКПМ В 7038 накапливаются преимущественно на границе тонкого и толстого отдела кишечника. Они не являются элементом нормофлоры желудочно-кишечного тракта животных и через определенное время полностью выводятся из организма. Ветом 4 стимулирует клеточные и гуморальные факторы иммунитета.
III Порядок применения
8. Ветом 4 применяют для профилактики и лечения дисбактериозов, повышения естественной резистентности организма животных, птиц и пушных зверей. Ветом 4 также применяют при диспепсиях, гастроэнтеритах, для коррекции иммунодефицитных состояний, увеличения сохранности и продуктивности, стимуляции роста и развития молодняка, получения дополнительных привесов.
9. Препарат назначают животным индивидуально или групповым методом с питьём (молоком, кипяченой остуженной водой) и кормом. При даче с питьём раствор готовят непосредственно перед употреблением.
10. Индивидуально Ветом 4 применяют перорально и ректально после проведения очистительной клизмы.
Ветом 4 назначают животным перорально в дозе 50 мг/кг живого веса:
- для профилактики дисбактериозов, диспепсий, гастроэнтеритов - 1 раз в сутки в
течении 15 дней; для коррекции иммунодефицитных состояний 2 раза в сутки в течение 20 дней;
- с лечебной целью - 2 раза в сутки до исчезновения клинических признаков болезни. При тяжелом течении болезни допускается увеличить кратность введения до 4 раз в сутки с интервалом в 6 часов.
11. При использовании Ветома 4 в процессе комплексного назначения препарат может быть задан с кормом, водой (не хлорированной и не содержащей антисептических препаратов).
При добавлении Ветома 4 в комбикорма, премиксы, минерально-витаминные добавки и другие кормовые смеси, на комбикормовых заводах или в кормоцехах животноводческих и птицеводческих предприятий должно быть использовано оборудование, обеспечивающее равномерное смешивание препарата с комбикормом. В 1 тонну корма добавляют 1,5 кг Ветома 4.
12. Побочных явлений и осложнений при применении препарата в рекомендуемых дозах не выявлено. Противопоказаний к применению Ветом 4 не установлено.
13. Продукты животноводства и птицеводства в пищевых целях используются без ограничений.
14. Применять Ветом 4 совместно с антибиотиками, сульфаниламидными и другими антимикробными препаратами запрещается.
IV Меры личной профилактики
15. Специальных мер для личной профилактики при работе с препаратом не предусматривается.
16. Ветом 4 следует хранить в местах недоступных для детей.
Инструкция по применению разработана ФГУ «ВГНКИ» (г. Москва), ООО НПФ «Исследовательский центр» (Новосибирская область, пос. Кольцово), ФГУ ВПО НГАУ (г. Новосибирск).
Организация - производитель: ООО НПФ «Исследовательский центр» (630559, Новосибирская область, Новосибирский район, пос. Кольцово, ФГУН ГНЦ ВБ «Вектор», корпус 200).
Рекомендовано к регистрации в Российской Федерации ФГУ «ВГНКИ».
Регистрационный № ПВР-1-4,7/02080


















































































