При изучении хронобиологических особенностей влияния ветома 3 на организм телят было отмечено выраженное терапевтическое действие препарата при гастроэнтерите, зависящее от хронобиологической организации физиологических функций организма. Выраженный терапевтический эффект пробиотика связан, по нашему мнению, с антагонистическими свойствами Bacillus subtilis по отношению к широкому спектру патогенных и условно-патогенных микроорганизмов, оптимизации микробиоценозов в кишечнике и нормализации обменных процессов в организме животного (Семенов В.В., 1998, Ноздрин Г.А. и соавт., 2003). Полученные результаты согласуются с данными ряда авторов, которые указывают на положительный эффект ветома 3 у телят и поросят при болезнях желудочно-кишечеого тракта. (Ноздрин Г.А. и соавт., 1997, 2001; Фещенко В.М., 2003).
Оптимальный терапевтический эффект получен при применении ветома 3 в 7 и 19 ч – в летний период (продолжительность лечения суток) и в 8 и 20 ч – осенью (продолжительность лечения суток). У аналогов из контроля продолжительность лечения в среднем составляла суток. При введении препарата в эти временные рамки продолжительность лечения телят была достоверно ниже по сравнению с мезором показателя летом – на 26,5 %, осенью – на 14,4 %, а по сравнению с аналогами из контроля – на 52,3 и 41,8 % соответственно летом и осенью.
Кроме того, при применении ветома 3 в 7 и 19 ч – в летний период, и в 8 и 20 ч – осенью отмечается наиболее быстрая стабилизация уровня температуры тела телят. При применении препарата в указанное время температура тела животных была ниже мезора на 0,9 % - летом, и на 0,6 % - осенью, а по сравнению с контролем данный показатель был ниже на 2,3 и 1,8 % соответственно в летний и осенний периоды.
При применении ветома 3 у телят отмечено влияние препарата на морфологические показатели крови.
Отмечено повышение уровня эритроцитов и гемоглобина после выздоровления животных опытных групп. Оптимальные результаты получены при применении препарата в 7 и 19 ч – летом, и в 8 и 20 ч – осенью, при этом содержание эритроцитов превышало мезор показателя на 3,5 и 3,3 %, а аналогов из контроля – на 8,24 и 11,97 % летом и осенью соответственно. При применении ветома 3 в указанное время уровень гемоглобина превышал мезор показателя на 2,6 и 1,4 %, а аналогичный показатель телят из контроля – на 9,5 и 3,9 % в летний и осенний периоды соответственно.
По данным А.И. Леляка (2001) при введении в организм пробиотических препаратов на основе B. subtilis, у животных нормализуется микробиоценоз кишечника за счет заселения полезной микрофлорой, которая, помимо антагонистических свойств, синтезирует ряд биологически активных веществ, в частности витаминов группы В.
Цианкобаламин является одним из антианемических факторов (фактор Касла), обеспечивающего нормальный эритропоэз (Лютинский С.И., 2001). В связи с этим представляется закономерным, что нормализация синтеза микрофлорой кишечника данного фактора способствует стимуляции эритропоэза, а снижение токсического воздействия из кишечника, за счет нормализации микробиоценоза и антогонистического действия B. subtilis по отношения к патогенам, влечет за собой уменьшение токсического распада гемоглобина.
Полученные результаты согласуются с данными Г.А. Ноздрина и соавт. (2001), А.Б. Ивановой (2002), А.И. Шевченко (2003), которые указывают на стимуляцию эритропоэза у животных под влиянием пробиотиков на основе B. subtilis.
При проведении опыта уровень лейкоцитов у телят опытных групп также повышался в переделах физиологических норм.
Оптимальное увеличение содержания лейкоцитов отмечено при применении ветома 3 в 7 и 19 ч – летом, и в 8 и 20 ч – осенью. Количество лейкоцитов при применении пробиотика в данные временные рамки превышал мезор показателей на 5,4 и 3,3 %, аналогов из контроля – на 5,4 и 8,2 % соответственно летом и осенью.
Полученные результаты согласуются с данными Б.В. Тараканова и соавт. (2000), В.В. Семенова (1998), Г.А. Ноздрина и соавт. (2003), которые указывают на стимуляцию лейкопоэза у животных под влиянием пробиотических препаратов.
Результаты исследований свидетельствуют о влиянии ветома 3 на качественный состав лейкоцитов у телят опытных групп. В крови животных повышался уровень лимфоцитов, моноцитов, юных и палочкоядерных нейтрофилов в пределах физиологических норм.
Оптимальные результаты влияния препарата на качественный состав лейкоцитов отмечен при применении препарата в 7 и 19 ч – летом, и в 8 и 20 ч – осенью. При применении ветома 3 в указанное время уровень лимфоцитов был выше по сравнению с мезором в летнее время – на 2,0 %, в осеннее время – 0,5 %. По сравнению с аналогами из контроля данный показатель были выше на 6,7 и 2,4 % в летнее и осеннее время соответственно.
Увеличение уровня лимфоцитов и моноцитов в пределах физиологических норм может свидетельствовать об улучшении фагоцитарной функции и иммунного ответа у животных (Лютинский С.И., 2001).
Повышение уровня юных и палочкоядерных нейтрофилов по отношению к сегментоядерным клеткам в пределах физиологической нормы, скорее всего, носит перераспределительный характер, связанный с активизацией нейтрофилопоэза после разрешения воспалительного процесса.
Результаты исследований свидетельствуют о выраженном влиянии препарата на белковый обмен.
Отмечено повышение уровня общего белка у телят опытных групп. Оптимальные результаты получены при применении препарата в 7 и 19 ч – летом и в 8 и 20 ч – осенью, при этом содержание общего белка было выше мезора – на 0,7 и 1,8 %, а по сравнению с контролем – на 4,1 и 3,9 % летом и осенью соответственно.
Мы предполагаем, что снижение токсического воздействия из кишечника способствует активизации белковообразовательной функции печени, кроме того, снижается величина потерь белков вследствие купирования воспалительного процесса и прекращения выхода белковых элементов с экссудатом.
В крови животных отмечены изменения и в процентном содержании белковых фракций. У телят опытных групп отмечено увеличение уровня альбуминов и g-глобулинов, и понижение количества a- и b-глобулиновых фракций.
Снижение уровня a-глобулинов в пределах физиологических норм подтверждает мнение о выраженном терапевтическом действии ветома 3, поскольку увеличение данного показателя обычно наблюдается в острую фазу воспалительного процесса (Лютинский С.И., 2001).
Уменьшение уровня b-глобулинов, скорее всего, носило перераспределительный характер и не сказывалось на качестве иммунного ответа, поскольку сопровождалось увеличением количества общего белка и других белковых фракций, а значит, по-видимому, снижение было относительное вследствие увеличения количества других белковых компонентов.
Повышение уровня g-глобулинов в пределах физиологических норм свидетельствует о стимуляции иммунного ответа у животных (Козинец Г.И., 1998).
Увеличение уровня альбуминов подтверждается и снижением скорости оседания эритроцитов, т.к. альбуминовая фракция белков участвует в поддержании осмотического давления и потенциалов на оболочке эритроцита. Скорее всего, повышение уровня альбуминов обуславливает в определенной степени и снижение уровня холестерина.
Отмечено снижение уровня холестерина под влиянием ветома 3 у телят опытных групп в пределах физиологической нормы. При применении препарата в 7 и 19 ч – в летнее время, и в 8 и 20 ч – осенью, уровень холестерина был достоверно ниже мезора на 2,7 и 0,3 %, а по сравнению с аналогами из контроля – на 5,2 и 1,5 % соответственно. Полученные результаты согласуются с мнением S. Gilliland et al. (1990), согласно которому пробиотические препараты обладают антихолистеринемическим действием. По данным С.И. Лютинского (2001), под влиянием полезной микрофлоры активизируется кругооборот желчи и снижается уровень холестерина и билирубина, которые, вероятно, более полноценно будут входить в состав самой желчи.
При применении ветома 3 отмечены изменения в уровне небелковых азотистых компонентов крови телят опытных групп, что может свидетельствовать об улучшении детоксицирующей функции печени, а также разрешении воспалительного процесса в желудочно-кишечном тракте.
Уровень мочевины крови до лечения животных был выше границ физиологической нормы, что, по-видимому, обусловлено дегидратацией организма и усиленным распадом тканевых белков вследствие воспалительной реакции в кишечнике (Козинец Г.И., 1998; Комаров Ф.И., 2001).
Оптимальное снижение уровня мочевины и креатинина отмечены при применении ветома 3 в 7 и 19 ч – летом, и в 8 и 20 ч – осенью. При применении препарата в указанное время уровень мочевины и креатинина был ниже значений мезора на 7,5 и 7,6 % – летом, и на 1,5 и 9,7 % – осенью, а по сравнению с аналогами из контрольной группы – на 13,4 и 27,1 % – в летний, и на 9,4 и 25,6 % – в осенний периоды соответственно.
Полученные результаты согласуются с данными В.М. Фещенко (2003), согласно которым ветом 4 способствовал снижению уровня небелковых азотистых компонентов крови поросят при воспалительном процессе.
При проведении исследований отмечено влияние препарата на некоторые показатели пигментного обмена.
У телят опытных групп отмечено снижение уровня общего билирубина, а также его фракций. До лечения уровень конъюгированного и неконъюгированного билирубина у телят был значительно выше физиологической нормы, что, по-видимому, обусловлено повышенным распадом гемоглобина и согласуется с низким уровнем последнего до лечения животных.
Оптимальное снижение уровня общего билирубина отмечено при применении ветома 3 в 7 и 19 ч – летом, и в 8 и 20 ч – осенью, при этом данный показатель был ниже мезора на 15,0 и 11,1 %, а по сравнению с аналогами из контроля – на 24,4 и 19,57 % летом и осенью соответственно.
Снижение уровня неконъюгированной и конъюгированной фракций билирубина может свидетельствовать о том, что изначально высокий уровень общего билирубина был связан как с повышенным распадом гемоглобина, так и с нарушением функции печени.
Мы предполагаем, что уменьшение распада гемоглобина и, как следствие – повышение его уровня в крови, повлекло за собой снижение уровня неконъюгированного билирубина, т.к. последний является продуктом его распада, а на фоне улучшения функции печени закономерным представляется и снижение уровня конъюгированного билирубина.
Мочевина, креатинин и билирубин являются эндогенными токсинами организма, следовательно, уменьшение их уровня в периферической крови телят, кроме всего прочего, подтверждает предположение о позитивном влиянии пробиотика на детоксицирующую функцию печени.
При применении ветома 3 отмечены изменения в уровне аминотрансфераз в крови животных опытных групп.
Аланинаминотрансфераза и аспартатаминотрансфераза являются ферментами, катализирующими межмолекулярный перенос аминогруппы между аминокислотами (аланином и аспарагиновой кислотой соответственно) и кетокислотами.
У телят опытных групп отмечено достоверное снижение уровня аланинаминотрансферазы, что также может указывать на улучшении функции печени.
До лечения животных уровень аспартатаминотранферазы был значительно понижен, поэтому повышение уровня последней после выздоровления опытных животных свидетельствует о позитивном влиянии ветома 3 на обмен веществ.
Необходимо отметить, что переаминирование аминокислот происходит в присутствии кофермента – фосфопиридоксаля, который является производным витамина В6.
По данным Б.В. Тараканова (2000) под влиянием пробиотических препаратов в кишечнике стимулируется синтез витаминов группы В. Поэтому выраженное действие ветома 3 на обмен веществ, в т.ч. на уровень аминотрансфераз, может быть обусловлен увеличением уровня пиридоксина и других витаминов группы В.
До лечения животных коэффициент де Ритиса был значительно ниже физиологической нормы, после применения препарата отмечена тенденция к повышения данного показателя у телят опытных групп, что также подтверждает мнение о позитивном влиянии препарата на функцию печени.
Оптимальное влияние ветома 3 на коэффициент де Ритиса отмечено при применении препарата в 7 и 19 ч – летом, и в 8 и 20 ч – осенью, при этом данный показатель был выше мезора на 18,6 и 25,0 %, а по сравнению с аналогами из контроля – в 4,6 и 3,1 раза в летний и осенний периоды соответственно.
Полученные оптимальные результаты по действию ветома 3 на организм телят в 7 и 19 ч – в летнее время, и в 8 и 20 ч – осенью, по-видимому, связаны с активизацией обмена веществ в эти временные рамки, в частности усилению активности ферментов, гормонов и других биологически активных веществ (Зидермане А.А., 1988; Арушанян Э.Б., 2000), что обуславливает более полное вхождение продуктов жизнедеятельности бактерий в обменные реакции.
Кроме того, в 6-7 ч утра отмечается минимальный уровень гастрина и соляной кислоты в желудке (Комаров Ф.И. и соавт., 2001). B. subtilis является некислотоустойчивой бактерией и, хотя, конечно, концентрация соляной кислоты сычуге невысока, однако жизнедеятельность бактерий активизируется уже в преджелудках, а значит в сычуг попадают и неспоровые формы, для которых кислотная среда является неблагорпиятным фактором. Возможно, бактерии под влиянием соляной кислоты желудка вновь переходят в споровую форму, а значит, активизация их в кишечнике займет определенное время и фармакологический эффект будет не столь полноценным. Следовательно, при низкой концентрации соляной кислоты и пониженной активности гастрина в 6-7 ч, фармакологический эффект наступает быстрее.
Различия в оптимальном эффекте ветома 3 в летний и осенний периоды, по-видимому, обусловлены внешними сезонными факторами, такими как, наступление светового дня, время кормления, температурные условия и т.д.
По данным Ю.А. Романова (1989) в наибольшей степени зависимость того или иного показателя от временного отражает построение хронограммы с вычислением показателей акрофазы, активной и пассивной фазы, абсолютной и относительной амплитуды и, в особенности, коэффициента синхронизации хронограммы.
Согласно этим показателям, при применении ветома 3 у телят, больных гастроэнтеритом, наиболее выраженное влияние циркадианных ритмов отмечено на показатели уровня эритроцитов – в летний и осенний периоды (коэффициент синхронизации (КС) 1,08 и 0,55 ед./ч соответственно), лейкоцитов – в летний период (КС 1,1 ед./ч), гемоглобина – летом и осенью (КС 0,52 и 1,03 ед./ч), общего белка – летом и осенью (КС 0,51 и 0,52 ед./ч соответственно), холестерина – осенью (КС 1,01 ед./ч), мочевины – летом и осенью (КС 0,57 и 0,52 ед./ч соответственно), а также показатели температуры – летом (КС 0,51 ед./ч) и среднесуточного прироста живой массы – летом и осенью (КС 0,34 и 0,6 ед./ч соответственно). Остальные изученные показатели также находились в зависимости от времени введения препарата, но в менее выраженной степени, что может быть связано с большими амплитудами значений.
Таким образом, ветом 3 оказывает выраженное терапевтическое действие при гастроэнтерите телят, стимулирует эритро- и лейкопоэз, клеточные и гуморальные факторы иммунного ответа, о чем свидетельствует повышение уровня общего белка, g-глобулиновой фракции, лимфоцитов и моноцитов в организме мышей и телят. Кроме того, препарат позитивно влияет на белковообразовательную и детоксицирующую функцию печени, снижает уровень холестерина и эндотоксинов в организме, повышает интенсивность роста животных.
Действие ветома 3 находится в зависимости от циркадианных и сезонных биологических ритмов, о чем свидетельствуют показатели коэффициента синхронизации хронограмм показателей, а также величины относительных амплитуд значений и продолжительности активной фазы. Акрофаза влияния препарата на организм мышей отмечена – в 12 и 22 часа, на организм телят – в 7 и 19 часов – летом, и в 8 и 20 часов – осенью. Активная фаза действия препарата приходится на 7–8-30 и 19–20-30 часов – летом и на 7–9 и 19-21 час – осенью.
3. Хронофармакология пробиотиков при гастроэнтерите у телят
3.1. Влияние циркадианных и сезонных биологических ритмов на терапевтическую эффективность ветома 3 при гастроэнтерите у телят
Реакция на вещество во времени должна непременно варьировать в прямой зависимости от того, на какую фазу биоритма она приходится. По мнению Э.Б. Арушаняна (2000), это вынуждает к пересмотру существующих в экспериментальной практике и клинике количественной оценки фармакологического эффекта. В частности, резонно распространить на существующие сегодня экспериментальные подходы предложенный F. Halberg et al. (1962) критерий хронодесмы, под которым подразумеваются доверительные колебания какого-либо функционального показателя во времени.
В преимуществе такого приема перед существующими стационарными методами оценки убеждает тот факт, фармакологический ответ может быть выше или ниже средней величины, рассчитанной для стационарных условий, хотя он и не выходит за пределы физиологических колебаний той или иной функции. Напротив, реакция может ошибочно приниматься за адекватную, тогда как на самом деле оказывается ниже или выше нормальной величины, находясь при этом в зоне стационарной нормы (Арушанян Э.Б., 2000).
Согласно концепции F. Halberg и A. Reinberg (1967), при обычной терапии равномерно повторяемое одинаковое лекарственное воздействие каждый раз вызывает разный эффект вплоть до развития побочных реакций. При хронотерапии, когда препарат назначается в разных дозах на протяжении суток в зависимости от фаз биоритмов, чувствительности к нему, можно получить одинаковую желаемую реакцию без риска развития побочных эффектов.
Хронотерапия включает следующие методологические приемы: превентивные, имитационные, метод «навязывания ритма» (Комаров Ф.И., 1988) и метод учета хроночувствительности заинтересованных систем (функций) к фармакологическим веществам (Заславская Р.М., 1991, 1996).
Имитационный метод хронотерапии основывается на уже установленных закономерностях изменений концентрации определенных веществ в крови и тканях в соответствии с характерным для здорового индивидуума биоритмом (Заславская Р.М., 1991).
Метод «навязывания ритма» основан на использовании лекарственных и нелекарственных средств, для задания организму больного животного определенных ритмов, приближающихся к нормальным ритмам определенного вида.
Метод учета основан на выявлении хроночувствительности заинтересованных систем, в частности сердечно-сосудистой, к фармакологическим препаратам разных классов. Р.М. Заславская (1991, 1996), К.Ж. Ахметов (1993) применяли метод учета хроночувствительности заинтересованных систем в группах больных гипертонической болезнью. Используя данный метод, Ж.Ж. Кулкаева (1997) выявила времязависимые эффекты и суточный ритм чувствительности показателей гемодинамики к пропранополу, метопрололу, верапамилу, кордипину при лечении ишемической болезни сердца.
Изучению сезонных особенностей фармакологической чувствительности живых организмов посвящены работы А.П. Голикова и П.П. Голикова (1973); С.И. Рапопорта и соавт. (1987) и многих других. Так, по данным С.А. Лужновой и Н.Г. Урляповой (2004), степень влияния диаминодифинилсульфона на гематологические показатели мышей сопряжена с сезоном года. В работе О.Ю. Леденевой (2003) указывается на наличие сезонных особенностей фармакологического эффекта пробиотического препарата ветомгин при эндометрите у коров. В.М. Фещенко (2003) отмечает, что терапевтический эффект пробиотического препарата ветом 4 и низкоинтенсивного лазерного излучения при бронхопневмонии у поросят также зависит от сезона года.
Период биоритма любого функционального или структурного процесса регулируется ритмами его энергообеспечения. Присутствие в пространственной организации биологической системы градиентов протекающих в ней процессов должно учитываться при исследовании механизмов регуляции деятельности системы в качестве основы возникновения в ней различных реакций на влияние регулирующих факторов в зависимости от точки приложения их действия в градиенте, а также дает возможность избирательного пространственного градиентного воздействия на систему внешними факторами, в том числе лекарственными средствами (Комаров Ф.И., Рапопорт С.И., 2000).
Наличие существенных суточных колебаний эффективности терапевтического воздействия известно уже для многих классов лекарственных веществ, в частности для гипотензивных средств, противогистаминных, цитостатических, гормональных препаратов, наркотических средств, для многих из этих препаратов изучена хронотоксикология, а также сезонные колебания их действия (Зидермане А.А., 1988; Арушанян Э.Б., 1988, 2000).
Однако все вышеперечисленные данные в основном представлены из опытов на лабораторных животных, либо путем простого наблюдения за больными людьми, Сельскохозяйственные и домашние животные как объект биоритмологии, хронофармакологических исследований остаются «белым пятном» до сих пор.
С целью выявления зависимости терапевтической эффективности ветома 3 у телят, больных гастроэнтеритом, от хронобиологических факторов изучали особенности течения болезни при применении препарата в различное время суток, его влияние на морфологические и биохимические показатели периферической крови и интенсивность роста больных животных.
Для определения сезонных особенностей терапевтической эффективности ветома 3 провели две аналогичные серии опытов летом и осенью (табл. 2).
Исследования проводились на двухмесячных телятах черно-пестрой породы с характерными признаками гастроэнтерита. Диагноз был установлен на основании анамнеза и клинических признаков. Животных по принципу аналогов разделили на 5 опытных и контрольную группы животных по 5 телят в каждой. Животным опытных групп назначали ветом 3 в дозе 50 мг/кг массы дважды в сутки с водой в различное время: в 1-й группе – в 7 и 19 ч, 2-й – в 8 и 20 ч, 3-й – в 9 и 21 ч, 4-й – в 10 и 22 ч, 5-й – в 11 и 23 ч. Пробиотик назначали до полного клинического выздоровления. Телятам из контроля ветом 3 не применяли, животных лечили по схеме, традиционно применяемой в данном хозяйстве: в качестве антибактериального средства назначали гентамицина сульфат в дозе 2 мг/кг массы внутримышечно 2 раза в день. Кроме того, животным всех групп проводили регидратационную и восстановительную терапии (табл. 2).
Таблица 2. Схема опыта
| № гр. |
Тип Группы |
Препараты |
Путь введения |
Дозы и кратность применения |
Время назначения |
|
1 |
Опытные |
Ветом |
Внутрь |
мгкг рвдень |
7 и 19 ч. |
|
2 |
8 и 20 ч. |
||||
|
3 |
9 и 21 ч. |
||||
|
4 |
10 и 22 ч. |
||||
|
5 |
11 и 23 ч. |
||||
|
6 |
Контроль |
Гентамицина сульфат |
В/м |
2 мг/кг 2 р. в день |
Утро, вечер |
|
Для всех групп |
Глюкоза 40% Аскорб. к-та 5% NaCl изотонич. |
В/в |
15 мл 3 мл ad 50 мл |
Утро |
|
|
Тиамина хлорид 5% Пиридоксина гидрохлорид 5% Цианкобаламин |
П/к |
По 2 мл, чередовать |
Утро |
||
|
Тривит |
В/м |
5 мл |
Однократно |
||
Взятие крови проводили из яремной вены перед началом и по окончанию исследований.
Для изучения хронофармакологических особенностей влияния препарата на состояние неспецифической резистентности и обмена веществ, проводили гематологические и биохимические исследования крови.
Морфологические исследования крови включали определение уровня эритроцитов и лейкоцитов (меланжерным способом с использованием камеры Горяева), гемоглобина (по Сали), скорости оседания эритроцитов (по Панчекову). Кроме того, в мазках, окрашенных по Романовскому-Гимза, определяли лейкограмму (по Болотникову И.А., 1980).
Биохимические исследования крови включали определение уровня общего белка и белковых фракций (рефрактометрический метод), холестерина (ферментативный колориметрический метод), мочевины (фотометрический метод по реакции с диацетилмонооксимом), креатинина (реакция Яффе с последовательной фотометрией по Слоту), билирубина и его фракций (фотометрический модифицированный метод Йендрашека-Грофа), аланинаминотрансферазы и аспартатаминотрансферазы (фотометрический метод Райтмана-Френкеля), кальция (фотометрическое определение по реакции с арсеназо-III) и фосфора (фотометрическое определение по реакции с молибденовокислым аммонием), рассчитывали коэффициент де Ритиса и показатель фосфорно-кальциевого отношения (Комаров Ф.И. и соавт., 2001). Для проведения биохимических исследований использовали реактивы ЗАО «Вектор-Бест» (для определения мочевины – реактивы фирмы Lachema).
Временную организацию действия ветома 3 на показатели крови и живой массы животных изучали с помощью графически-параметрического метода анализа биологических ритмов (Романов Ю.А., 1979) и определяли следующие параметры: мезор – среднее значение показателей (фазы) за промежуток времени; акрофазу – момент крайнего отклонения фазы; активную (пассивную) фазы – значения фазы, лежащие выше (ниже) мезора; абсолютную амплитуду – разность между максимальным и минимальным значениями фазы; относительную амплитуду – отношение максимального к минимальному значению фазы; коэффициент синхронизации – отношение относительной амплитуды к промежутку времени между максимальным и минимальным значениями фазы (Комаров Ф.И., Рапопорт С.И., 2000).
Обработку данных проводили методами вариационной статистики с использованием программы «PGN-1.4». Достоверность результатов определяли с помощью критерия Стьюдента.
Установлено, что препарат обладает выраженным терапевтическим действием при гастроэнтерите. Улучшение состояния животных 1–5-й опытных групп, как в летний, так и в осенний периоды, отмечалось уже на 2-3-и сутки после начала лечения. У животных появлялся аппетит, нормализовались температура, пульс и частота дыхания; дефекация отмечалась реже, кал приобретал кашицеобразную консистенцию, уменьшалось количество не переваренных остатков корма. В то время как у животных контрольной группы заметных изменений в течение болезни не отмечали.
Температура тела у телят 1–5-й опытных групп после выздоровления в летний период была ниже по сравнению с контролем на 2,31; 1,29; 1,03; 1,54; 1,03 %, а по сравнению с исходными данными – на 2,56; 1,79; 1,53; 1,29; 1,03% соответственно, тогда как у животных из контроля температура тела по сравнению с исходными данными не изменилась. Необходимо отметить, что, если в 1-й и 2-й опытных группах отмечается плавное стабильной снижение температуры за весь период лечения, то в контрольной группе отмечается даже некоторый подъем температуры в первые 3-е суток лечения. В 3–5-й опытных группах также отмечалось снижение температуры, но более медленное с редкими периодами подъема (рис. 5).
В активной фазе (в данном случае ниже мезора, т.к. изначально вследствие воспалительной реакции, обусловленной гастроэнтеритом, температура была повышена) влияния ветома 3 на уровень температуры у телят в летний период находились показатели 1-й и 4-й опытных групп, которые были ниже мезора (38,34±0,15 °С) на 0,9 (P<0,05) и 0,3 %, в пассивной фазе – показатели 2, 3 и 5-й опытных групп, которые превышали мезор на 0,2; 0,4 и 0,4 % соответственно. Продолжительность активной фазы была в 4 раза короче пассивной фазы. Абсолютная амплитуда показателей температуры телят составила 0,5 °С, относительная амплитуда – 1,01 ед. Коэффициент синхронизации влияния ветома 3 на уровень температуры телят составил 0,51 ед/ч. Акрофаза (в данном случае минимальное значение) влияния ветома 3 на уровень температуры телят приходилась на 7 и 19 ч, что соответствует показателям телят 1-й опытной группы (рис. 5).
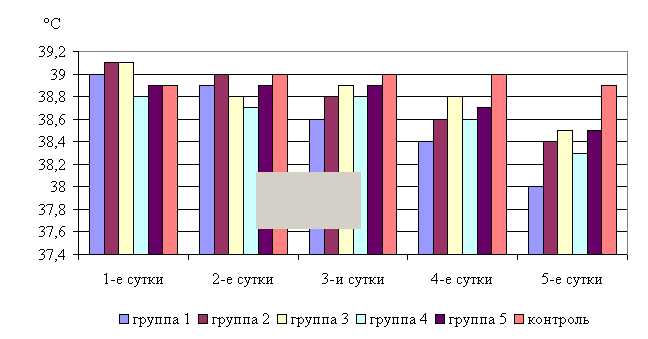
Рис. 5. Динамика показателей температуры телят в летний период
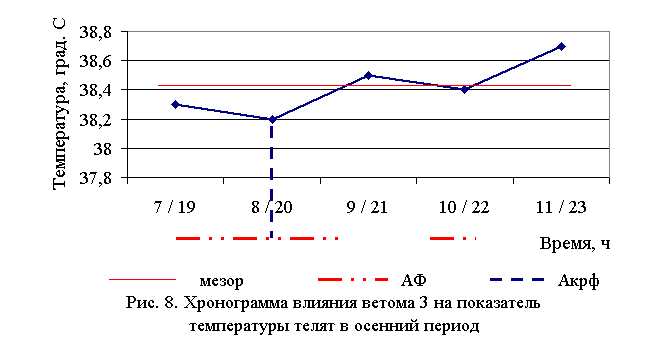
Температура тела у телят 1–5-й опытных групп после выздоровления осенью была ниже по сравнению с контролем на 1,54 (P<0,1); 1,8 (P<0,05); 1,03; 1,29 (P<0,01); 0,51 % соответственно. По сравнению с исходными данными температура тела у телят 1–5-й опытных и контрольной групп была ниже на 2,29; 2,3; 1,03; 2,29; 0,77 и 0,26 % соответственно. Необходимо отметить, что если во 2-й и 4-й опытных группах отмечается плавное и стабильное снижение температуры за весь период лечения, то в контрольной группе отмечается даже некоторый подъем температуры на 3-4-е сутки лечения. В 1, 3 и 5-й опытных группах также отмечалось снижение температуры, но более медленное с редкими периодами подъема (рис. 7).
Примечание: здесь и далее АФ – активная фаза, Акрф – акрофаза
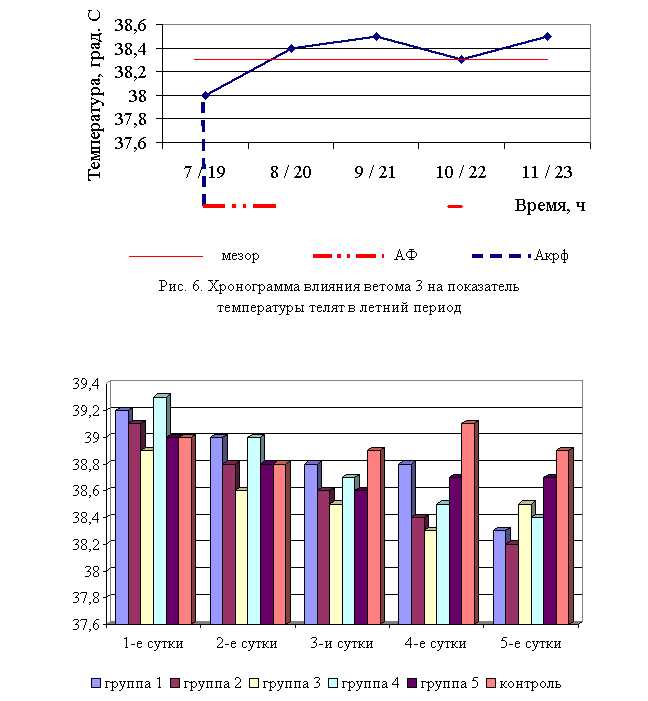
Рис. 7. Динамика показателей температуры телят в осенний период
В активной фазе (в данном случае ниже мезора, т. к. изначально вследствие воспалительной реакции, обусловленной гастроэнтеритом, температура была повышена) влияния ветома 3 на уровень температуры телят в осенний период находились показатели 1, 2 и 4-й опытных групп, которые были ниже мезора (38,42±0,08 °С) на 0,3, 0,6 (P<0,1) и 0,1 %, в пассивной фазе – показатели 3 и 5-й опытных групп, которые превышали мезор на 0,2 и 0,7 % соответственно. Продолжительность активной фазы была на 28,6 % длиннее пассивной фазы. Абсолютная амплитуда показателей температуры телят составила 0,5 °С, относительная амплитуда – 1,01 ед. Коэффициент синхронизации влияния ветома 3 на уровень температуры телят составил 0,34 ед/ч. Акрофаза (в данном случае минимальное значение) влияния ветома 3 на уровень температуры телят приходилась на 8 и 20 ч, что соответствует показателям телят 2-й опытной группы (рис. 8).
Таким образом, под влиянием ветома 3 происходило стабильное снижение температуры у подопытных телят. Выраженность фармакологического эффекта пробиотика находилась в зависимости от времени применения препарата: коэффициент синхронизации хронограмм в летний и осенний периоды составил 0,51 и 0,34 ед./ч. Оптимальное снижение температуры при применении препарата в летний период отмечено в 7 и 19 ч, осенью – в 8 и 20 ч, при этом показатели температуры были достоверно ниже мезора на 0,9 и 0,6 % соответственно.
При проведении опыта отмечены также изменения частоты пульса у подопытных телят.
У телят 1, 2 и 4-й опытных групп после выздоровления в летний период частота пульса была недостоверно ниже по сравнению с контролем на 1,56 % соответственно, тогда как у животных 3-й и 5-й опытных групп данный показатель находился на уровне контроля. По сравнению с исходными данными частота пульса у телят 1-й опытной и контрольной групп недостоверно снизилась на 3,1 и 1,5 % соответственно, тогда как у животных 2-й и 5-й опытных групп – увеличилась на 1,6 и 3,2 %, а у аналогов 3-й и 5-й опытных групп – не изменилась по сравнению с исходными данными (рис. 9).
Анализ хронобиологических особенностей влияния ветома 3 на частоту пульса в летний период не позволяет сделать однозначных выводов.
Рис. 9. Динамика частоты пульса у подопытных телят в летний период
У телят 1, 2, 3 и 4-й опытных групп после выздоровления в осенний период частота пульса была недостоверно ниже по сравнению с контролем на 1,56; 1,56; 3,12 и 1,56 % соответственно, тогда как у животных 5-й опытной группы данный показатель находился на уровне контроля. По сравнению с исходными данными частота пульса у телят 1, 2, 3 и 4-й опытных групп недостоверно снизилась на 3,08; 3,08; 1,59; 1,56 % соответственно, тогда как у животных 5-й опытной группы – увеличилась на 1,59 %, а у аналогов из контроля – не изменилась по сравнению с исходными данными. Необходимо отметить, что в течение опыта стабильно понижалась частота пульса только у телят 2-й опытной группы, тогда как у животных 1, 3, 4, 5-й опытных и контрольной групп снижение частоты пульса чередовалось с периодами подъема (рис. 10).
Анализ хронобиологических особенностей влияния ветома 3 на частоту пульса в осенний период также не позволяет сделать однозначных выводов.
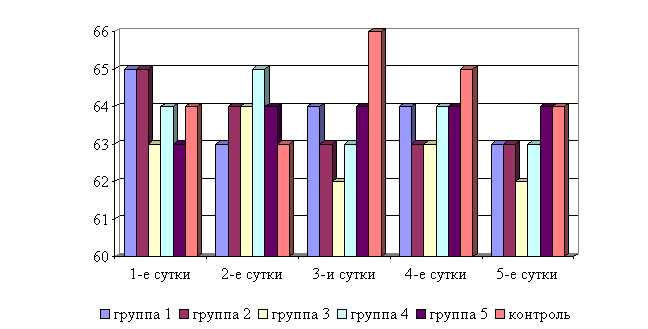
Рис. 10. Динамика частоты пульса у подопытных телят в осенний период
При проведении опыта отмечены также изменения частоты дыхательных движений у подопытных телят.
У телят 1, 2 и 3-й опытных групп после выздоровления в летний период частота дыхательных движений была недостоверно ниже по сравнению с контролем на 5,6; 5,6 и 11,1 % соответственно, тогда как у животных 4-й и 5-й опытной группы данный показатель находился на уровне контроля. По сравнению с исходными данными, частота дыхательных движений у телят 1–5-й опытных групп недостоверно снизилась на 5,6; 10,5; 15,8; 10,0; 5,3 % соответственно, тогда как у животных контрольной группы данный показатель не изменился по сравнению с исходными данными (рис. 11).
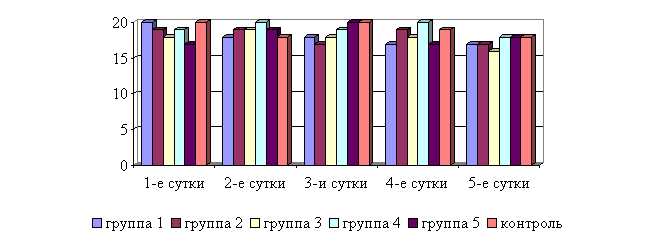
Рис. 11. Динамика частоты дыхательных движений у подопытных телят в летний период
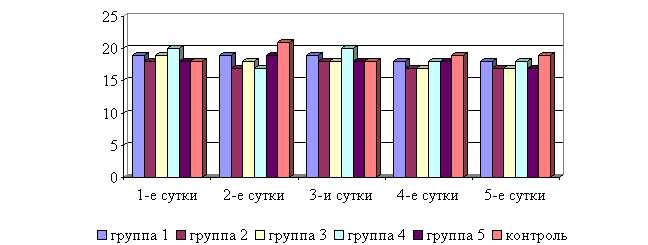
Рис. 12. Динамика частоты дыхательных движений у подопытных телят в осенний период
У животных 1–5-й опытных групп после выздоровления в осенний период частота дыхательных движений была недостоверно ниже по сравнению с контролем на 5,3; 10,5; 10,5; 5,3; 10,5 % соответственно. По сравнению с исходными данными частота дыхательных движений у телят 1–5-й опытных групп недостоверно снизилась на 5,3; 5,6; 10,5; 10,0; 5,6 % соответственно, тогда как у животных контрольной группы – увеличилась на 5,6 % (рис.12).
Таким образом, при применении ветома 3 как в летний, так и осенний периоды, отмечена тенденция к снижению частоты пульса и дыхательных движений, однако, анализ хронобиологических особенностей влияния препарата на данные показатели не позволяет сделать однозначных выводов.
При применении ветома 3 отмечено снижение продолжительности лечения телят опытных групп.
В летний период продолжительность лечения телят 1–5-й опытных групп была достоверно ниже по сравнению с аналогами из контроля на 52,25 (P<0,01); 40,93 (P<0,05); 29,6; 29,6; 22,65 (P<0,1) % соответственно (табл. 10).
Наименьшая продолжительность лечения телят была отмечена в 1-й опытной группе, где уже на 3-и сутки опыта половина животных была клинически здорова, и средняя продолжительность лечения составила 3,5±0,42 суток. В контрольной группе показатель продолжительности лечения составил 7,33±0,61 суток и на 3-и сутки лечения не было ни одного выздоровевшего животного (табл. 10).
В активной фазе (в данном случае ниже мезора) влияния ветома 3 на продолжительность лечения телят в летний период находились показатели 1-й и 2-й опытных групп, которые были ниже мезора ((4,76±0,68) суток) на 26,5 и 9,0 %, в пассивной фазе – показатели 3, 4 и 5-й опытных групп, которые превышали мезор на 8,4; 8,4 и 19,1 % соответственно. Продолжительность активной фазы была на 40 % короче пассивной фазы. Абсолютная амплитуда показателей продолжительности лечения телят составила 2,17 суток, относительная амплитуда – 1,62 ед. Коэффициент синхронизации влияния ветома 3 на продолжительность лечения телят составил 0,41 ед./ч. Акрофаза (минимальное значение) влияния ветома 3 на продолжительность лечения телят летом приходилась на 7 и 19 ч, что соответствует показателям телят 1-й опытной группы (рис. 13).
Таблица 10
Продолжительность лечения телят в летний период
|
№ группы |
Время назначения ветома 3 |
Количество животных, выздоровевших на3 / 5 сутки опыта |
Средняя продолжительность лечения в группе, сут. |
|
1-я |
7 и 19 ч. |
3 / 2 |
3,5±0,42*** |
|
2-я |
8 и 20 ч. |
2 / 3 |
4,33±0,49** |
|
3-я |
9 и 21 ч. |
1 / 3 |
5,16±0,54* |
|
4-я |
10 и 22 ч. |
1 / 2 |
5,16±0,60* |
|
5-я |
11 и 23 ч. |
0 / 3 |
5,67±0,49* |
|
Контроль |
пробиотики не назначали |
0 / 1 |
7,33±0,61 |
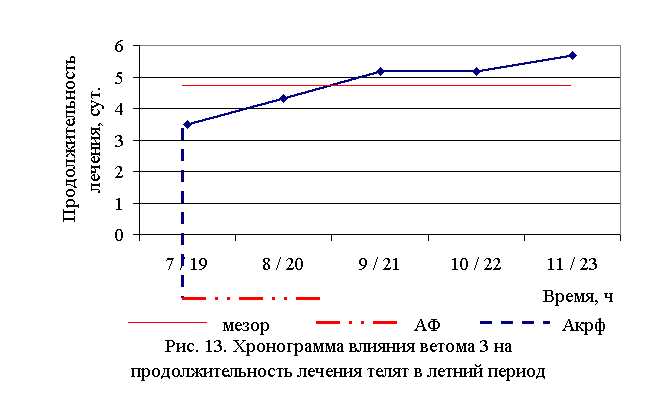
В осенний период продолжительность лечения телят 1–5-й опытных групп была достоверно ниже, по сравнению с аналогами из контроля на 37,24 (P<0,05); 41,84 (P<0,01); 32,64 (P<0,05); 25,66 (P<0,1); 23,29 (P<0,1) % соответственно.
Наименьшая продолжительность лечения была отмечена во 2-й группе и составила 4,17±0,4 суток, тогда как в контрольной группе продолжительность лечения составила 7,17±0,4 суток (P<0,05). В 1, 2 и 3-й опытных группах уже на 3-и сутки опыта 2 из 5-ти животных были клинически здоровы, в контрольной группе на 3-и сутки лечения не было ни одного выздоровевшего животного (табл. 11) Таблица 11
Продолжительность лечения телят в осенний период
|
№ группы |
Время назначения ветома 3 |
Количество животных, выздоровевших на3 / 5 день лечения |
Средняя продолжительность лечения в группе |
|
1-я |
7 и 19 ч. |
2 / 3 |
4,5±0,50** |
|
2-я |
8 и 20 ч. |
2 / 4 |
4,17±0,40*** |
|
3-я |
9 и 21 ч. |
2 / 2 |
4,83±0,65** |
|
4-я |
10 и 22 ч. |
1 / 2 |
5,33±0,56* |
|
5-я |
11 и 23 ч. |
1 / 2 |
5,5±0,62* |
|
контроль |
Пробиотики не назначали |
0 / 0 |
7,17±0,40 |
В активной фазе (в данном случае ниже мезора) влияния ветома 3 на продолжительность лечения телят в осенний период находились показатели 1, 2 и 3-й опытных групп, которые были ниже мезора ((4,87±0,25) суток) на 7,6; 14,4 и 0,8 %, в пассивной фазе – показатели 4 и 5-й опытных групп, которые превышали мезор на 9,4 и 12,9 % соответственно. Продолжительность активной и пассивной фаз были равными. Абсолютная амплитуда показателей продолжительности лечения телят составила 1,33 суток, относительная амплитуда – 1,32 ед. Коэффициент синхронизации влияния ветома 3 на продолжительность лечения телят составил 0,44 ед./ч. Акрофаза (минимальное значение) влияния ветома 3 на продолжительность лечения телят осенью приходилась на 8 и 20 ч, что соответствует показателям телят 2-й опытной группы (рис. 14).
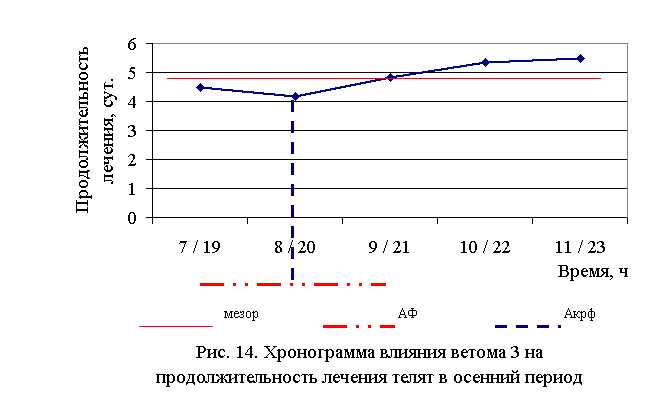
Таким образом, ветом 3 обладает выраженным терапевтическим эффектом при гастроэнтерите у телят, который находится в прямой зависимости от времени введения препарата и сезона года – коэффициент синхронизации влияния пробиотика на продолжительность лечения в летний и осенний периоды составлял 0,41 и 0,44 ед./ч соответственно. Оптимальный терапевтический эффект получен при применении препарата в 7 и 19 ч в летний период, и в 8 и 20 ч – осенью, при этом продолжительность лечения телят была ниже мезора на 26,5 и 14,4 % соответственно. Ветом 3 при применении в указанные временные рамки вызывал стабильное снижение температуры, причем акрофаза показателя была ниже мезора на 0,9 и 0,6 % в летний и осенний периоды соответственно.
Полученные результаты согласуются с данными ряда авторов о зависимости физиологических показателей живых организмов от фазы биологического ритма. Такие ритмы называют физиологическими. Влияние биологических ритмов на физиологические показатели закреплено эволюционно и основано на различной восприимчивости нейрогуморальных структур к внешним воздействиям (свет, температура окружающей среды и т.д.) в разные периоды суток. Соответвенно, терапевтическое воздействие на живой организм в различные периоды активности физиологических систем вызывает различный эффект. По нашим данным, оптимальное влияние ветома 3 на физиологические показатели телят, больных гастроэнтеритом, различно в летний и осенний периоды, что в свою очередь согласуется с концепцией сезонной организации биологических систем (сезонные биологические ритмы).
3.2. Хронобиологические особенности действия ветома 3 на морфологические показатели крови у телят после выздоровления при гастроэнтерите
В результате проведенных исследований установлено, что до применения ветома 3 количество эритроцитов, лейкоцитов и гемоглобина у телят опытных и контрольной групп не имело достоверных различий и находилось в пределах физиологических норм.
Анализ лабораторных исследований свидетельствует о повышении уровня эритроцитов в крови телят опытных групп после проведения лечения в летний и осенний периоды (табл. 12).
Количество эритроцитов у телят 1–5-й опытных групп после выздоровления в летний период было выше, по сравнению с аналогами из контроля на 8,24; 0,33; 1,81; 7,99 (P<0,1); 4,12 % соответственно. По сравнению с исходными данными уровень эритроцитов повысился у животных 1–5-й опытных групп на 3,63; 1,42; 1,23; 2,34; 0,24 % соответственно, а у аналогов из контроля – снизился на 1,62 % (табл. 12).
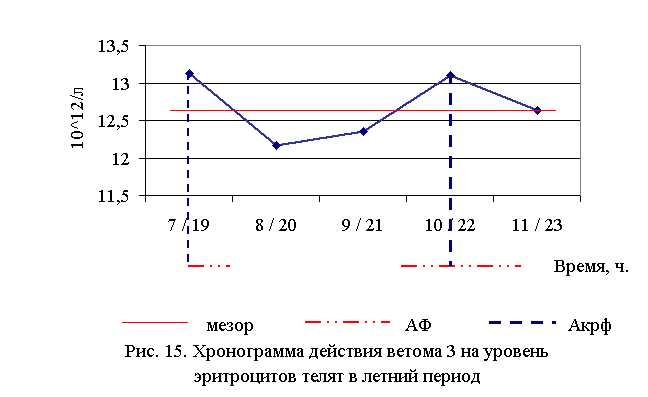
В активной фазе влияния ветома 3 на уровень эритроцитов у телят в летний период находились показатели 1-й и 4-й опытных групп, которые превышали мезор ((12,68±0,19), 1012/л) на 3,5 и 3,3 % соответственно, в пассивной фазе – показатели 2, 3 и 5-й опытных групп, которые были ниже мезора на 4,0; 2,6 и 0,4% соответственно. Продолжительность активной и пассивной фаз были равными. Абсолютная амплитуда была равной 0,96 1012/л, относительная амплитуда – 1,08 ед. Коэффициент синхронизации влияния ветома 3 на уровень эритроцитов у телят составил 1,08 ед./ч. Акрофаза влияния ветома 3 на количество эритроцитов у телят приходилась на 7 и 19, 10 и 22 ч, что соответствует показателям телят 1-й и 4-й опытных групп (рис. 15).
Количество эритроцитов у телят 1–5-й опытных групп после выздоровления в осенний период было выше по сравнению с аналогами из контроля на 11,11 (P<0,05); 11,97 (P<0,05); 9,15 (P<0,05); 1,71; 2,31 %, а по сравнению с исходными данными – на 3,42; 10,74 (P<0,05); 4,93; 1,45; 3,19 % соответственно. Тогда как у аналогов из контроля уровень эритроцитов по сравнению с исходными данными снизился на 1,62 % (табл. 12).
Таблица 12. Динамика уровня эритроцитов у телят, 1012/л
| Группа |
Лето |
Осень |
||
|
До лечения |
После выздоровления |
До лечения |
После выздоровления |
|
|
1-я опытная |
12,67±0,37 Cv=5,08 |
13,13±0,33 Cv=4,40 |
12,57±0,44 Cv=6,03 |
13,0±0,42** Cv=5,55 |
|
2-я опытная |
12,0±0,7 Cv=10,1 |
12,17±0,34 Cv=4,82 |
11,83±0,09 Cv=1,29 |
13,1±0,4** Cv=5,18 |
|
3-я опытная |
12,2±0,53 Cv=7,51 |
12,35±0,41 Cv=5,96 |
12,17±0,44 Cv=6,28 |
12,77±0,29** Cv=3,86 |
|
4-я опытная |
12,8±1,1 Cv=14,91 |
13,1±0,24* Cv=3,17 |
11,73±0,44 Cv=6,51 |
11,9±0,44 Cv=6,34 |
|
5-я опытная |
12,6±0,5 Cv=6,92 |
12,63±0,43 Cv=5,85 |
11,6±0,57 Cv=8,49 |
11,97±0,29 Cv=4,21 |
|
контроль |
12,33±0,29 Cv=4,08 |
12,13±0,43 Cv=6,24 |
11,37±0,29 Cv=4,43 |
11,7±0,17 Cv=2,5 |
В активной фазе влияния ветома 3 на уровень эритроцитов телят в осенний период находились показатели 1, 2 и 3-й опытных групп, которые превышали мезор (12,68±0,19, 1012/л) на 2,5, 3,3 и 0,7% соответственно, в пассивной фазе – показатели 4-й и 5-й опытных групп, которые были ниже мезора на 6,2 и 5,6% соответственно. Продолжительность активной фазы была больше продолжительности пассивной на 40%. Абсолютная амплитуда была равной 1,2, 1012/л, относительная амплитуда – 1,1 ед. Коэффициент синхронизации влияния ветома 3 на уровень эритроцитов у телят составил 0,55 ед./ч. Акрофаза влияния ветома 3 на количество эритроцитов у телят приходилась на 8 и 20 ч, что соответствует показателям телят 2-й опытной группы (рис. 16).
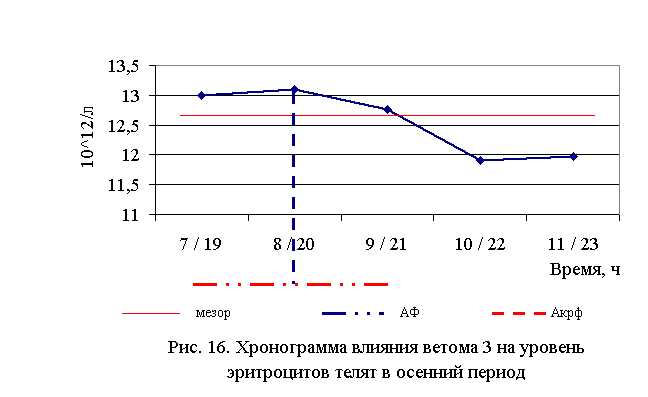
Таким образом, ветом 3 повышает уровень эритроцитов у телят в пределах физиологических норм. Выраженность влияния препарата на данный показатель находится в зависимости от времени введения пробиотика и сезона года. Оптимальный эффект получен при применении ветома 3 в 7 и 19, и 10 и 22 ч – летом, и в 8 и 20 ч – осенью. При применении препарата в эти временные рамки уровень эритроцитов был выше мезора на 3,5 и 3,3 % в летний и осенний периоды соответственно. Под влиянием ветома 3 содержание гемоглобина у телят опытных групп также изменялось (табл. 13). Содержание гемоглобина у телят 1–5-й опытных групп после выздоровления в летний период было достоверно выше по сравнению с аналогами из контроля на 9,5; 6,4; 5,2; 6,1; 6,2 % соответственно. По сравнению с исходными данными уровень гемоглобина повысился у телят 1–5-й опытных и контрольной групп на 11,8; 9,6; 7,8; 8,2; 7,7 и 2,3 % соответственно (табл. 13)
Таблица 13. Динамика содержания гемоглобина у телят, г/л
Группа |
Лето |
Осень |
||
|
До |
После выздоровления |
До |
После выздоровления |
|
|
1-я опытная |
121,6±1,03 |
136,0±1,82 # |
121,2±2,42 |
125,6+1,21* |
|
2-я опытная |
120,6±1,08 |
132,2±2,01*** |
124,2±1,42 |
127,6±0,93*** |
|
3-я опытная |
121,2±1,69 |
130,6±1,25*** |
122,0±1,82 |
124,4±0,6 |
|
4-я опытная |
121,8±1,5 |
131,8±1,52*** |
122,2±1,59 |
125,0±0,77* |
|
5-я опытная |
122,6±1,66 |
132,0±1,0 # |
121,8±1,71 |
126,6±2,99 |
|
контроль |
121,4±1,03 |
124,2±0,74 |
122,2±1,43 |
122,8±0,66 |
Примечание: здесь и далее # - P<0,001
В активной фазе влияния ветома 3 на уровень гемоглобина телят в летний период находились показатели 1-й опытной группы, которые превышали мезор ((132,52±0,91) г/л) на 2,6 % соответственно, в пассивной фазе – показатели 2–5-й опытных групп, которые были ниже мезора на 0,2; 1,4; 0,5; 0,4 % соответственно. Продолжительность активной фазы была короче пассивной на 76,9 %. Абсолютная амплитуда была равной 5,4 г/л, относительная амплитуда – 1,04 ед. Коэффициент синхронизации влияния ветома 3 на уровень гемоглобина у телят в летний период составил 0,52 ед./ч. Акрофаза влияния ветома 3 на содержание гемоглобина у телят приходилась на 7 и 19 ч, что соответствует показателям телят 1-й опытной группы (рис. 17).
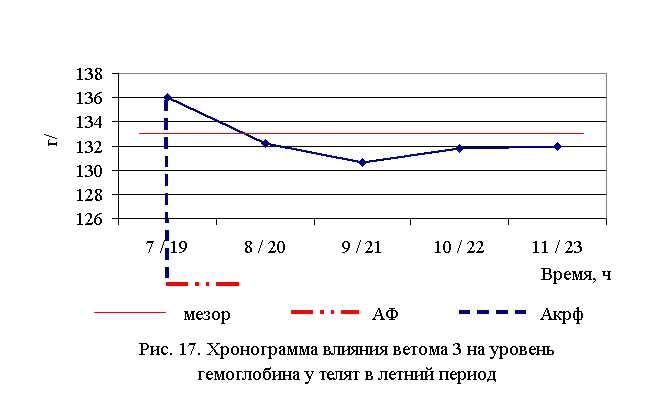
Содержание гемоглобина у телят 1–5-й опытных групп после выздоровления в осенний период было выше по сравнению с аналогами из контроля на 2,3 (P<0,1); 3,9 (P<0,01); 1,3; 1,8 (P<0,1); 3,1 % соответственно. По сравнению с исходными данными уровень гемоглобина повысился у телят 1–5-й опытных и контрольной групп на 3,6; 2,7; 2,0; 2,3; 3,9 и 0,5 % соответственно (табл. 14).
В активной фазе влияния ветома 3 на уровень гемоглобина телят в осенний период находились показатели 2-й и 5-й опытной группы, которые превышали мезор ((132,52±0,91) г/л) на 1,4 и 0,6 % соответственно, в пассивной фазе – показатели 1, 3 и 4-й опытных групп, которые были ниже мезора на 0,2; 0,8 и 0,7 % соответственно. Продолжительность активной фазы была длиннее пассивной на 28,6 %. Абсолютная амплитуда была равной 3,2 г/л, относительная амплитуда – 1,03 ед. Коэффициент синхронизации влияния ветома 3 на уровень гемоглобина у телят в летний период составил 1,03 ед./ч. Акрофаза влияния ветома 3 на содержание гемоглобина у телят приходилась на 8 и 20 ч, что соответствует показателям телят 2-й опытной группы (рис. 18).
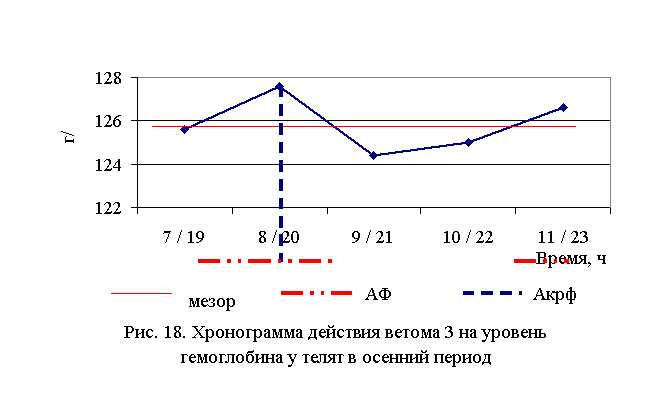
Таким образом, ветом 3 повышает уровень гемоглобина у телят в пределах физиологических норм. Выраженность влияния препарата на данный показатель находится в зависимости от времени введения и сезона. Оптимальный эффект получен при применении пробиотика в 7 и 19 ч – летом и в 8 и 20 ч – осенью, при применении препарата в эти временные рамки уровень эритроцитов был выше мезора на 2,6 и 1,4 % соответственно.
Под влиянием ветома 3 уровень лейкоцитов в крови телят опытных групп также изменялся (табл. 14).
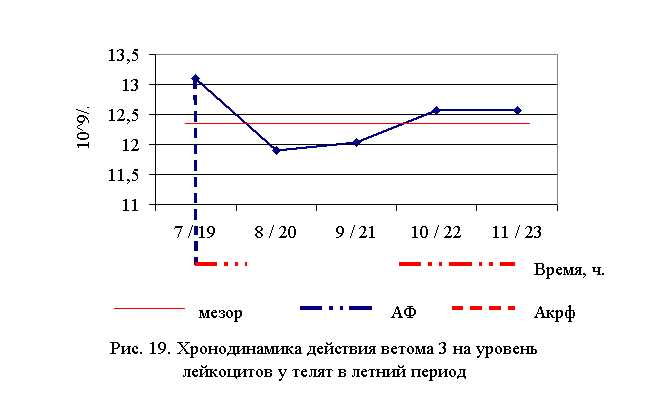
Количество лейкоцитов у телят 1, 4 и 5-й опытных групп после выздоровления в летний период было выше по сравнению с аналогами из контроля на 5,39; 1,13; 1,13 %, а у животных 2-й и 3-й опытных групп – ниже на 4,26 и 3,22 % соответственно. По сравнению с исходными данными уровень лейкоцитов повысился у телят 1–5-й опытных групп на 14,91 (P<0,001); 8,48; 2,21; 3,88; 9,02 % соответственно, а у аналогов из контроля – снизился на 1,11 % (табл. 14)
Таблица 14. Динамика уровня лейкоцитов у телят, 109/л
Группа |
Лето |
Осень |
||
|
До |
После выздоровления |
До |
После выздоровления |
|
|
1-я опытная |
11,4±0,15 |
13,1±0,12 |
12,2±0,08 |
13,17±0,07** |
|
2-я опытная |
10,97±0,87 |
11,9±0,42 |
11,93±0,47 |
13,0±0,15* |
|
3-я опытная |
11,77±0,27 |
12,03±0,06 |
12,5±0,69 |
12,63±0,63 |
|
4-я опытная |
12,1±0,11 |
12,57±0,24 |
12,7±0,8 |
12,77±0,35 |
|
5-я опытная |
11,53±1,33 |
12,57±0,67 |
11,77±0,77 |
12,17±0,57 |
|
контроль |
12,57±0,73 |
12,43±0,75 |
11,9±0,31 |
12,17±0,35 |
В активной фазе влияния ветома 3 на уровень лейкоцитов у телят в летний период находились показатели 1, 4 и 5-й опытных групп, которые превышали мезор ((12,43±0,38) 109/л) на 5,4; 1,1 и 1,1 % соответственно, в пассивной фазе – показатели 2-й и 3-й опытных групп, которые были ниже мезора на 4,3 и 3,2 % соответственно. Продолжительность активной фазы была больше пассивной на 28,6 %. Абсолютная амплитуда была равной 1,2* 109/л, относительная амплитуда – 1,1 ед. Коэффициент синхронизации влияния ветома 3 на уровень лейкоцитов у телят составил 1,1 ед./ч. Акрофаза влияния ветома 3 на количество лейкоцитов у телят приходилась на 7 и 19 ч, что соответствует показателям телят 1-й опытной группы (рис. 19).
Количество лейкоцитов у телят 1–4-й опытных групп после выздоровления в осенний период было выше по сравнению с аналогами из контроля на 8,22 (P<0,05), 6,82 (P<0,1), 3,78, 4,93%, а у животных 5-й опытных групп – на уровне показателей контрольной группы. По сравнению с исходными данными уровень лейкоцитов повысился у телят 1–5-й опытных и контрольной групп на 7,95 (P<0,001), 8,97 (P<0,1), 1,04, 0,55, 3,40 и 2,27% соответственно (табл. 14).
В активной фазе влияния ветома 3 на уровень лейкоцитов телят в осенний период находились показатели 1, 2 и 4-й опытных групп, которые превышали мезор (12,75±0,17, 109/л) на 3,3 (P<0,1), 2,0 и 0,2% соответственно, в пассивной фазе – показатели 3-й и 5-й опытных групп, которые были ниже мезора на 0,9 и 4,5% соответственно. Продолжительность активной фазы была больше пассивной на 8,7%. Абсолютная амплитуда была равной 1,0, 109/л, относительная амплитуда – 1,1 ед. Коэффициент синхронизации влияния ветома 3 на уровень лейкоцитов
у телят составил 0,3 ед./ч. Акрофаза влияния ветома 3 на количество лейкоцитов у телят приходилась на 7 и 19 ч, что соответствует показателям телят 1-й опытной группы (рис. 20).
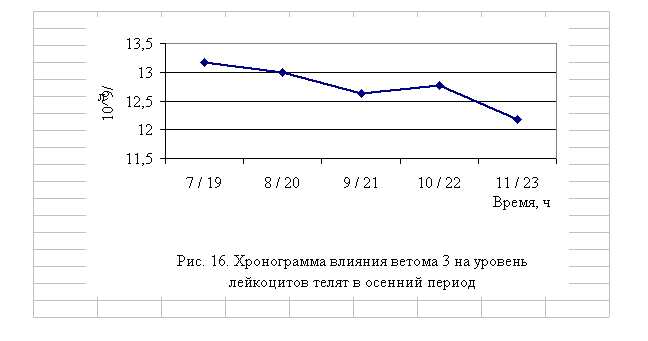
Таким образом, ветом 3 повышает уровень лейкоцитов у телят в пределах физиологических норм. Выраженность влияния препарата на данный показатель находится в зависимости от времени введения препарата и сезона года. Оптимальный эффект получен при применении пробиотика в 7 и 19 ч летом и осенью, при применении препарата в эти временные рамки уровень эритроцитов был выше мезора на 5,4 и 2,0 % соответственно.
Нами установлены изменения в показателе скорости оседания эритроцитов. Первоначально этот показатель по всем группам составлял в среднем в летний период 2,5 мм/ч, в осенний – 2,25 мм/ч. После выздоровления он значительно уменьшился и составил в летний период – 1,0 мм/ч в 1, 2 и 4-й группах, 1,5 мм/ч – в 3-й и 5-й группах, в контрольной группе данный показатель остался без изменений и составил 2 – 2,5 мм/ч у всех животных, в осенний период – у телят 1, 2 и 5-й групп – 1,0 мм/ч, 3-й и 4-й групп – 1,5 мм/ч, у телят из контроля данный показатель практически не изменился по сравнению с исходными данными.
При применении ветома 3 отмечены изменения в процентном соотношении лейкоцитарных клеток у телят.
Уровень лимфоцитов до применения препарата был ниже физиологической нормы (табл. 15).
Процентное содержание лимфоцитов после выздоровления в летний период у телят 1–5 опытных групп было выше по сравнению с аналогичным показателем животных из контроля на 6,7 (P<0,1); 5,3 (P<0,05); 4,6; 2,8; 3,5%. По сравнению с исходными данными содержание лимфоцитов увеличилось у телят 1–5-й опытных и контрольной групп на 5,2 (P<0,1); 8,3 (P<0,05); 1,7; 3,2; 3,5 и 1,8 % соответственно (табл. 15-16).
В активной фазе влияния ветома 3 на уровень лимфоцитов в летний период находились показатели 1-й и 2-й опытных групп, которые превышали мезор (59,4±0,38) % на 2,0 и 0,7 %, в пассивной фазе находились показатели 4-й и 5-й опытных групп, которые были ниже мезора на 1,7 и 1,0 % соответственно, уровень лимфоцитов 3-й опытной группы соответствовал мезору (рис. 19).
Таблица 15. Лейкоцитарный профиль телят до лечения в летний период, %
| Показатель |
Опытные группы |
Контроль |
||||
|
1-я |
2-я |
3-я |
4-я |
5-я |
||
|
Э |
0,4±0,24 Сv=136,93 |
0,8±0,2 Cv=55,9 |
0 |
0,4±0,24 Cv=136,93 |
0,6±0,4 Cv=149,07 |
1,2±0,2 Cv=37,27 |
|
Б |
0 |
0 |
0 |
0 |
0 |
0 |
|
Ю |
0,8±0,2 Cv=55,9 |
1,2±0,37 Cv=69,72 |
0,8±0,37 Cv=104,58 |
0,8±0,49 Cv=136,93 |
1,0±0,55 Cv=122,47 |
0,4±0,4 Cv=223,61 |
|
П |
6,2±0,2 Cv=7,21 |
7,2±0,37 Cv=11,62 |
6,6±0,51 Cv=17,28 |
5,8±0,37 Cv=14,43 |
6,2±0,58 Cv=21,03 |
7,4±0,24 Cv=7,4 |
|
С |
32,4±0,6 Cv=4,25 |
32,4±0,75 Cv=5,16 |
31,2±1,24 Cv=8,89 |
32,8±0,2 Cv=1,36 |
31,4±0,98 Cv=6,98 |
31,0±0,89 Cv=6,45 |
|
Л |
57,6±0,6 Cv=2,29 |
55,2±1,71 Cv=6,95 |
58,4±2,11 Cv=8,09 |
56,6±1,36 Cv=5,39 |
56,8±1,53 Cv=6,02 |
55,8±2,13 Cv=8,54 |
|
М |
2,6±0,6 Cv=51,6 |
3,2±0,37 Cv=26,15 |
3,0±0,77 Cv=57,74 |
3,6±0,6 Cv=37,27 |
4,0±1,06 Cv=58,63 |
4,2±0,92 Cv=48,8 |
Продолжительность активной и пассивной фаз при проведении опыта в летний период была равной. Абсолютная амплитуда показателей уровня лимфоцитов составила 2,2%, относительная амплитуда – 1,04 ед. Коэффициент синхронизации влияния ветома 3 на содержание лимфоцитов у телят в летний период составил 0,35 ед./ч. Акрофаза влияния ветома 3 на уровень лимфоцитов у телят приходилась на 7 и 19 ч, что соответствует показателям телят 1-й опытной группы (рис. 21).
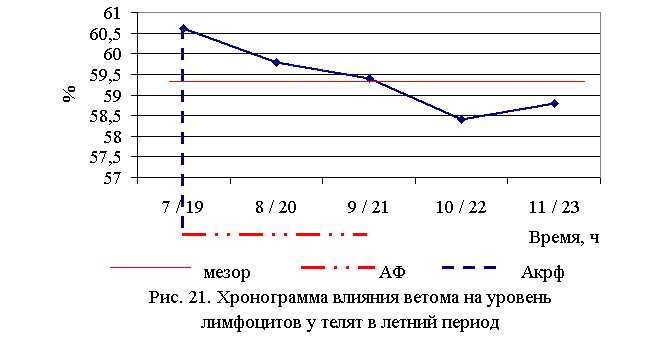
Таблица 16. Лейкоцитарный профиль телят после выздоровления в летний период, %
| Показатель |
Опытные группы |
Контроль |
||||
|
1-я |
2-я |
3-я |
4-я |
5-я |
||
|
Э |
0,6±0,24 Cv=31,29 |
0,4±0,24 Cv=136,93 |
0 |
0,8±0,37 Cv=37,27 |
1,2±0,58 Cv=108,65 |
1,6±0,4 Cv=89,07 |
|
Б |
0 |
0 |
0 |
0 |
0 |
0 |
|
Ю |
1,2±0,2 Cv=20,33 |
1,6±0,24 Cv=34,23 |
1,2±0,58 Cv=108,65 |
1,2±0,58 Cv=108,65 |
1,2±0,49 Cv=91,29 |
0,6±0,4 Cv=136,93 |
|
П |
5,4±0,24 Cv=7,40 |
6,2±0,2 Cv=7,21 |
6,4±0,51 Cv=17,82 |
6,4±0,24 Cv=8,56 |
6,6±0,4 Cv=13,55 |
7,6±0,4 Cv=13,55 |
|
С |
28,4±1,08 Cv=7,67 |
29,2±0,37 Cv=2,68 |
30,4±0,81 Cv=5,98 |
30,0±0,55 Cv=3,83 |
28,4±0,6 Cv=4,02 |
31,2±0,66 Cv=4,61 |
|
Л |
60,6±1,4* Cv=5,75 |
59,8±0,37** Cv=1,45 |
59,4±1,61 Cv=6,11 |
58,4±1,63 Cv=6,47 |
58,8±0,73 Cv=3,05 |
56,8±1,24 Cv=4,97 |
|
М |
3,8±0,37** Cv=22,02 |
2,8±0,49 Cv=39,12 |
2,6±0,4 Cv=34,4 |
3,2±0,8 Cv=55,9 |
3,8±0,49* Cv=28,83 |
2,2±0,58 Cv=40,75 |
При применении ветома 3 уровень моноцитов у телят в летний период также изменялся. В летний период процентное содержание моноцитов у телят 1–5-й опытных групп было выше после выздоровления по сравнению с аналогами из контроля на 72,7 (P<0,05); 27,3; 18,2; 45,5; 72,7 (P<0,1) % соответственно. По сравнению с исходными данными уровень моноцитов снизился у телят 2–5-й опытных и контрольной групп на 12,5; 13,3; 11,1; 5,0; 47,6 %, тогда как у животных 1-й опытной группы – увеличился на 46,2 %. Необходимо отметить, что все изменения в уровне моноцитов происходили в пределах физиологической нормы (табл. 15-16).
Под влиянием препарата происходили изменения в соотношении нейтрофилов у телят.
До лечения в летний период среди видового состава нейтрофилов преобладали сегментоядерные клетки, их количество соответствовало верхней границе нормы, как в опытных, так и в контрольной группе.
После выздоровления по сравнению с аналогами из контроля у телят 1–5-й групп уровень сегментоядерных нейтрофилов был ниже на 9,0; 6,4; 2,6; 3,8; 9,0 %, а количество палочкоядерных нейтрофилов – на 28,9; 18,4; 15,8; 15,8; 13,2 %. Процентное содержание юных форм у телят 1, 3, 4 и 5-й опытных групп превышало аналогов из контроля выше на 25,0 %, а у животных 2-й опытной группы – находилось на уровне контрольной группы.
По сравнению с исходными данными у телят 1–5-й опытных групп уровень сегментоядерных нейтрофилов уменьшился на 12,3; 9,9; 2,6; 8,5; 9,6% соответственно, тогда как у аналогов из контроля – увеличился на 0,6%. Количество палочкоядерных форм снизилось у телят 1, 2 и 3-й опытных групп на 12,9; 13,9 и 3,0 %, а у животных 4-й, 5-й опытных и контрольной групп – увеличилось на 10,3; 6,5 и 2,7 % соответственно. Содержание юных нейтрофилов увеличилось у телят 1–5-й опытных групп на 50,0; 33,3; 50,0; 50,0; 20,0 % соответственно, тогда как у аналогов из контроля – не изменилось по сравнению с исходными данными (табл. 15-16).
При проведении опыта в летний период отмечены изменения в уровне эозинофилов у телят.
Количество эозинофилов у телят 1, 2, 4 и 5-й опытных групп было выше по сравнению с аналогами из контроля на 62,3; 75,0; 50,0; 25,0 % соответственно, тогда как у телят 3-й опытной группы при анализе лейкограммы эозинофилов обнаружено не было. По сравнению с исходными данными уровень эозинофилов увеличился у телят 1, 4, 5-й опытных и контрольной групп в 1,5; 2,0; 2,0 и 1,3 раз, а у животных 2-й опытной группы – уменьшился в 0,5 раза. Анализ хронобиологических особенностей влияния ветома 3 на уровень эозинофилов не позволяет сделать однозначных выводов (табл. 15-16).
При проведении опыта в осенний период процентное соотношение лейкоцитарных клеток у телят также изменялось.
Процентное содержание лимфоцитов после выздоровления в осенний период у телят 1–5-й опытных групп было выше по сравнению с аналогичным показателем животных из контроля на 2,1; 2,4; 2,3; 1,7; 1,0 % соответственно. По сравнению с исходными данными содержание лимфоцитов увеличилось у телят 1–5-й опытных и контрольной групп на 1,7; 5,8; 4,4; 2,3; 1,4 и 0,7 % соответственно (табл. 17-18).
В активной фазе влияния ветома 3 на уровень лимфоцитов в осенний период находились показатели 1, 2 и 3-й опытных групп, которые превышали мезор (58,5±0,14%) на 0,2; 0,5 и 0,3 %, в пассивной фазе – показатели 4-й и 5-й опытных групп, которые были ниже мезора на 0,2 и 0,9 % соответственно. Продолжительность активной фазы в 2 раза превышала пассивную. Абсолютная амплитуда показателей уровня лимфоцитов составила 0,8 %, относительная амплитуда – 1,01 ед. Коэффициент синхронизации влияния ветома 3 на содержание лимфоцитов у телят в осенний период составил 0,34 ед./ч. Акрофаза влияния ветома 3 на уровень лимфоцитов у телят приходилась на 8 и 20 ч, что соответствует показателям телят 2-й опытной группы (рис. 22).
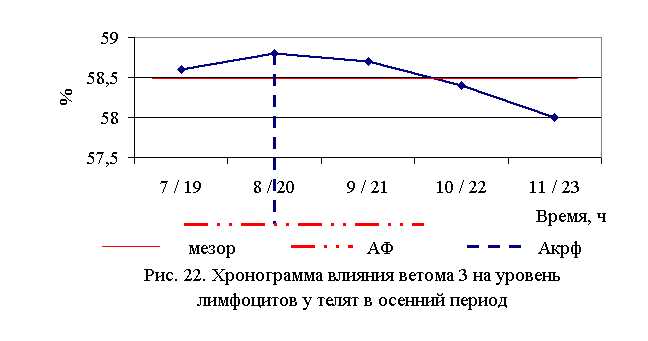
Таблица 17. Лейкоцитарный профиль телят до лечения в осенний период, %
| Показатель |
Опытные группы |
Контроль |
||||
|
1-я |
2-я |
3-я |
4-я |
5-я |
||
|
Э |
0,4±0,24 Cv=136,93 |
0,6±0,24 Cv=91,29 |
0,6±0,24 Cv=91,29 |
0,4±0,24 Cv=136,93 |
1,2±0,97 Cv=180,66 |
0,4±0,24 Cv=136,93 |
|
Б |
0 |
0 |
0 |
0 |
0 |
0 |
|
Ю |
1,8±0,37 Cv=104,58 |
1,8±0,37 Cv=104,58 |
2,0±0,45 Cv=100,0 |
1,0±0,32 Cv=70,71 |
1,0±0,45 Cv=100,0 |
0,8±0,58 Cv=162,98 |
|
П |
6,0±0,71 Cv=26,35 |
7,0±0,32 Cv=11,79 |
6,4±0,75 Cv=26,15 |
6,5±0,8 Cv=26,31 |
5,7±1,12 Cv=46,48 |
5,7±0,55 Cv=20,41 |
|
С |
31,6±1,07 Cv=7,51 |
32,0±0,71 Cv=4,94 |
31,8±0,93 Cv=6,56 |
32,1±0,97 Cv=6,82 |
31,4±5,23 Cv=44,3 |
32,2±1,02 Cv=7,08 |
|
Л |
57,6±1,75 Cv=6,79 |
55,6±1,03 Cv=4,14 |
56,2±1,79 Cv=7,14 |
57,1±1,71 Cv=6,75 |
57,2±5,24 Cv=22,44 |
57,0±0,89 Cv=3,51 |
|
М |
2,6±0,6 Cv=37,27 |
3,0±0,32 Cv=14,14 |
3,0±0,68 Cv=34,47 |
2,9±0,75 Cv=49,22 |
3,5±4,01 Cv=64,11 |
3,9±0,68 Cv=42,13 |
Таблица 18. Лейкоцитарный профиль телят после выздоровления в осенний период, %
| Показатель |
Опытные группы |
Контроль |
||||
|
1-я |
2-я |
3-я |
4-я |
5-я |
||
|
Э |
0,4±0,24 Cv=136,93 |
0,6±0,24 Cv=91,29 |
0,6±0,4 Cv=149,07 |
0 |
0,8±0,37 Cv=104,58 |
0 |
|
Б |
0 |
0 |
0 |
0 |
0 |
0 |
|
Ю |
2,6±0,51* Cv=24,79 |
2,0±0,37 Cv=26,15 |
2,1±0,49 Cv=34,23 |
1,8±0,58 Cv=46,57 |
1,2±0,58 Cv=59,27 |
1,2±0,4 Cv=34,4 |
|
П |
7,4±0,51* Cv=15,41 |
6,0±0,32 Cv=11,79 |
6,5±0,49 Cv=17,67 |
6,2±0,84 Cv=37,42 |
6,6±0,97 Cv=45,17 |
5,8±0,49 Cv=22,82 |
|
С |
28,0±0,55*** Cv=4,08 |
29,2±0,58** Cv=4,18 |
29,0±0,84** Cv=6,03 |
30,6±0,75 Cv=5,3 |
28,8±5,45 Cv=43,86 |
32,7±0,98 Cv=6,98 |
|
Л |
58,6±1,03 Cv=4,22 |
58,8±1,44 Cv=5,77 |
58,7±0,75 Cv=3,01 |
58,4±1,21 Cv=4,71 |
58,0±5,51 Cv=24,66 |
57,4±0,93 Cv=3,61 |
|
М |
3,0±0,55 Cv=40,82 |
3,4±0,8 Cv=55,9 |
3,1±0,4 Cv=26,31 |
3,0±0,84 Cv=62,36 |
4,6±3,1 Cv=82,54 |
2,9±0,37 Cv=26,15 |
В осенний период процентное содержание моноцитов у телят 1–5-й опытных групп было выше после выздоровления по сравнению с аналогами из контроля на 3,4; 17,2; 6,9; 3,4; 58,6 %, а по сравнению с исходными данными – на 15,4; 13,3; 3,3; 3,4; 31,4 % соответственно. Уровень моноцитов у телят контрольной группы снизился по сравнению с исходными данными на 25,6 %. Необходимо отметить, что все изменения в уровне моноцитов происходили в пределах физиологической нормы (табл. 17-18).
Под влиянием препарата происходили изменения в соотношении нейтрофилов у телят.
До лечения препаратом в осенний период среди видового состава нейтрофилов преобладали сегментоядерные клетки, их количество соответствовало верхней границе нормы, как в опытных, так и в контрольной группе.
После выздоровления по сравнению с аналогами из контроля у телят 1–5-й групп уровень сегментоядерных нейтрофилов был ниже на 14,4 (P<0,01); 10,7 (P<0,05); 11,3 (P<0,05); 6,4; 11,9 %, количество палочкоядерных нейтрофилов – выше на 27,6 (P<0,1); 3,4; 12,1; 6,9; 13,8 % соответственно. Содержание юных форм нейтрофилов у телят 1-й и 4-й опытных групп было выше аналогов из контроля на 18,2 (P<0,1) и 18,2 %, у животных 2-й и 3-й опытных групп – ниже на 9,1 и 4,5 % соответственно, а у аналогов из 5-й опытной группы – на уровне телят контрольной группы.
По сравнению с исходными данными у телят 1–5-й опытных групп уровень сегментоядерных нейтрофилов уменьшился на 11,4; 8,8; 8,8; 4,7; 8,3% соответственно, тогда как у аналогов из контроля – увеличился на 1,6%. Количество палочкоядерных форм у телят 1, 3, 5-й опытных и контрольной групп увеличилось на 23,3; 1,6; 15,8 и 1,8 %, а у животных 2-й и 5-й опытных групп – снизилось на 14,3 и 4,6 % соответственно. Содержание юных нейтрофилов увеличилось у телят 1–5-й опытных и контрольной групп на 44,4; 11,1; 5,0; 80,0; 20,0 и 50,0 % соответственно (табл. 17-18).
Изменения в уровне нейтрофилов, как летом, так и осенью происходили в пределах физиологической нормы и носили, скорее всего, перераспределительный характер, связанный с процессом выздоровления животных, поэтому анализ хронобиологических особенностей влияния ветома 3 на уровень нейтрофилов не позволяет сделать однозначных выводов.
Уровень эозинофилов у телят, при проведении опыта в осенний период, по сравнению с началом опыта изменился незначительно (табл. 17-18).
Таким образом, полученные результаты свидетельствуют о позитивном влиянии ветома 3 на эритро- и лейкопоэз, в т. ч. лимфоцитопоэз у телят опытных групп, как в летний, так и в осенний периоды исследований. Ветом 3 повышает уровень моноцитов и юных форм нейтрофилов в пределах физиологической нормы, что может свидетельствовать об усилении фагоцитарной функции у телят и разрешении воспалительного процесса. Установлена зависимость влияния ветома 3 на морфологические показатели крови телят от времени применения препарата и сезона. Оптимальное влияние ветома 3 на эритро- и лейкопоэз отмечено при применении препарата в 7 и 19 ч – летом и в 8 и 20 ч – осенью.
3.3. Хронобиологические особенности действия ветома 3 на биохимические показатели крови у телят при гастроэнтерите
При проведении исследований отмечено влияние препарата на белковый обмен у телят опытных групп.
Уровень общего белка его фракций до применения препарата находились в пределах физиологической нормы (табл. 19).
Содержание общего белка у телят 1–5-й опытных групп после выздоровления увеличилось по сравнению с аналогами из контроля на 4,14 (P<0,1); 3,44; 4,14 (P<0,1); 2,85; 2,33 % в летний период и на 1,84; 3,89 (P<0,1); 2,02; 0,71; 1,77 % в осенний период соответственно. По сравнению с исходными данными уровень общего белка у телят 1–5-й опытных и контрольной групп увеличился на 5,12; 4,45; 4,12; 3,16; 3,17 и 0,83 % в летний период и на 3,18; 4,83; 2,38; 1,25; 2,61 и 0,53 % в осенний период соответственно (табл. 19).
Таблица 19. Динамика уровня общего белка у телят, г/л
| Группа |
Лето |
Осень |
||
|
До лечения |
После выздоровления |
До лечения |
После выздоровления |
|
|
1-я опытная |
56,67±0,664 Cv=2,03 |
59,57±0,318* Cv=0,92 |
55,7±0,517 Cv=1,61 |
57,47±0,384 Cv=1,16 |
|
2-я опытная |
56,83±0,176 Cv=0,54 |
59,17±0,296 Cv=0,87 |
55,93±0,145 Cv=0,45 |
58,63±0,317* Cv=1,10 |
|
3-я опытная |
57,03±0,467 Cv=1,42 |
59,57±0,406* Cv=1,18 |
56,23±0,769 Cv=2,37 |
57,57±0,260 Cv=0,78 |
|
4-я опытная |
57,03±0,649 Cv=1,97 |
58,83±0,664 Cv=1,96 |
56,13±0,865 Cv=2,67 |
56,83±0,736 Cv=2,24 |
|
5-я опытная |
56,73±0,426 Cv=1,30 |
58,53±0,371 Cv=1,10 |
55,97±1,241 Cv=3,84 |
57,43±1,027 Cv=3,10 |
|
Контроль |
56,73±0,524 Cv=1,60 |
57,20±0,987 Cv=2,99 |
56,13±0,845 Cv=2,61 |
56,43±0,809 Cv=2,48 |
В активной фазе влияния ветома 3 на уровень общего белка в летний период находились показатели 1, 2 и 3-й опытных групп, которые превышали мезор ((59,13±0,2) г/л) на 0,7; 0,1 и 0,7 %, в пассивной фазе – показатели 4-й и 5-й опытных групп, которые были ниже мезора на 0,5 и 1,0 % соответственно. Продолжительность активной фазы превышала пассивную на 66,7 %. Абсолютная амплитуда показателей уровня общего белка составила 1,04 г/л, относительная амплитуда – 1,02 ед., коэффициент синхронизации – 0,51ед./ч. Акрофаза влияния ветома 3 на уровень общего белка у телят в летний период приходилась на 7 и 19, и 9 и 21 ч, что соответствует показателям телят 1-й и 3-й опытных групп (рис. 23).
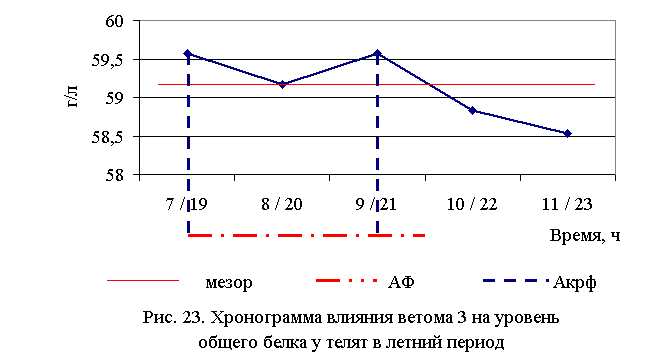
В активной фазе влияния ветома 3 на уровень общего белка в осенний период находились показатели 2-й опытной группы, которые превышали мезор ((57,59±0,29) г/л) на 1,8 %, в пассивной фазе – показатели 1, 3, 4 и 5-й опытных групп, которые были ниже мезора на 0,2; 0,03; 1,3 и 0,3 % соответственно. Продолжительность активной фазы была меньше пассивной на 28,6 %. Абсолютная амплитуда показателей уровня общего белка составила 1,8 г/л, относительная амплитуда – 1,03 ед., коэффициент синхронизации – 0,52 ед./ч. Акрофаза влияния ветома 3 на уровень общего белка у телят в осенний период приходилась на 8 и 20 ч, что соответствует показателям телят 2-й опытной группы (рис. 24). Анализ содержания белковых фракций свидетельствует о повышении процентного содержания уровня альбуминов у телят опытных групп (табл. 20-23).
Содержание альбуминов у телят 1–5-й опытных групп после выздоровления было выше аналогичного показателя животных из контроля на 7,5; 5,3; 6,5; 5,4; 2,6 % в летний, и на 5,3; 5,3; 3,5; 3,8; 6,2 % в осенний периоды соответственно. По сравнению с исходными данными уровень альбуминов увеличился у телят 1–5-й опытных и контрольной групп в летний период – на 11,33; 10,84; 10,22; 10,06; 1,85 и 2,56 %, осенью – на 7,1; 7,3; 6,3; 6,1; 9,7 и 5,1 % соответственно.
Уровень α-глобулинов у телят 1–5-й опытных групп после выздоровления был ниже по сравнению с показателями контрольной группы в летний период – на 31,0; 25,6; 28,7; 34,7; 19,3 %, осенью – на 35,6; 30,2; 26,3; 15,3; 18,8 % соответственно. По сравнению с исходными данными уровень α-глобулинов у телят 1–5-й опытных и контрольной групп снизился на 36,1; 36,7; 26,2; 39,0; 7,4 и 0,8 % – в летний и на 42,8; 33,8; 31,8; 17,5; 42,3 и 18,1 % – в осенний периоды соответственно (табл. 20-23).
Содержание β-глобулинов в крови телят 1–5-й опытных групп после выздоровления в летний период было ниже по сравнению с показателями контрольной группы на 11,9; 4,8; 5,4; 3,0; 4,2 % соответственно. При проведении исследований осенью уровень β-глобулинов у телят 1, 2 и 5-й опытных групп превышал показатели контрольной группы на 1,7, 1,2 и 4,3%, а у телят 3 и 4-й опытных групп – был ниже на 1,4 и 4,3% соответственно. По сравнению с исходными данными содержание β-глобулинов снизилось у телят 1–5-й опытных и контрольной групп на 17,4; 8,8; 17,5; 6,9; 10,9 и 8,6 % - в летний, и на 2,2; 6,9; 10,0; 16,5; 7,0 и 7,6 % - в осенний периоды соответственно (табл. 20-23).
Таблица 20. Фракции белка у телят до лечения в летний период, %
| Фракции белка |
Опытные |
контроль |
||||
|
1-я группа |
2-я группа |
3-я группа |
4-я группа |
5-я группа |
||
|
Альбу-мины |
51,83±0,79 Cv=2,63 |
51,0±0,96 Cv=3,28 |
51,87±0,92 Cv=3,07 |
51,4±1,93 Cv=6,50 |
54,07±0,27 Cv=0,87 |
52,33±1,12 Cv=3,71 |
|
α – гло-булины |
18,47±1,83 Cv=17,13 |
20,10±0,76 Cv=6,52 |
16,53±0,57 Cv=5,97 |
18,30±2,40 Cv=22,72 |
14,90±1,64 Cv=19,03 |
17,23±1,03 Cv=10,32 |
|
β – гло-булины |
17,67±0,85 Cv=8,34 |
17,3±0,12 Cv=1,16 |
19,0±1,07 Cv=9,75 |
17,27±0,54 Cv=5,38 |
17,83±1,54 Cv=14,97 |
18,13±0,38 Cv=3,59 |
|
γ – гло-булины |
12,03±0,35 Cv=5,01 |
11,27±0,65 Cv=9,98 |
12,6±0,53 Cv=7,27 |
13,03±0,84 Cv=11,10 |
13,2±0,53 Cv=6,94 |
12,30±1,00 Cv=14,11 |
Таблица 21. Фракции белка у телят после выздоровления в летний период, %
| Фракции белка |
Опытные |
контроль |
||||
|
1-я группа |
2-я группа |
3-я группа |
4-я группа |
5-я группа |
||
|
Альбу-мины |
57,70±1,12 Cv=3,35 |
56,53±0,67 Cv=2,05 |
57,17±0,84 Cv=2,55 |
56,57±0,71 Cv=2,18 |
55,07±0,72 Cv=2,27 |
53,67±0,78 Cv=2,52 |
|
α – гло-булины |
11,80±0,81 Cv=11,86 |
12,73±0,30 Cv=4,03 |
12,20±0,85 Cv=12,13 |
11,17±1,65 Cv=25,56 |
13,80±2,20 Cv=27,65 |
17,10±0,61 Cv=6,19 |
|
β – гло-булины |
14,6±0,40 Cv=4,79 |
15,77±0,64 Cv=6,99 |
15,67±0,52 Cv=5,79 |
16,07±1,26 Cv=13,53 |
15,87±0,35 Cv=3,80 |
16,57±0,32 Cv=3,32 |
|
γ – гло-булины |
15,9±0,47 Cv=5,15 |
14,97±0,74 Cv=8,59 |
14,97±0,38 Cv=4,45 |
16,20±0,44 Cv=4,66 |
15,27±1,82 Cv=20,65 |
12,67±0,20 Cv=2,77 |
Уровень γ-глобулинов у телят 1–5-й опытных групп после выздоровления превышал аналогичный показатель животных контрольной группы в летний период – на 25,5; 18,2; 18,2; 27,9; 20,5 %, осенью – на 16,5; 11,2; 22,2; 10,7; 13,9 % соответственно. По сравнению с исходными данными содержание γ-глобулинов увеличилось у телят 1–5-й опытных и контрольной групп на 32,2; 32,8; 18,8; 24,3; 15,7 и 3,0 % – в летний и на 32,8; 22,6; 35,4; 20,1; 9,9 и 18,2 % – в осенний периоды соответственно (табл. 20-23).
Таблица 22. Фракции белка у телят до лечения в осенний период, %
| Фракции Белка |
Опытные |
Контроль |
||||
|
1-я группа |
2-я группа |
3-я группа |
4-я группа |
5-я группа |
||
|
Альбу-мины |
53,83±0,96 Cv=3,09 |
53,77±0,27 Cv=0,88 |
53,3±1,27 Cv=4,11 |
53,57±0,38 Cv=1,21 |
53,03±0,63 Cv=2,07 |
52,1±0,64 Cv=2,11 |
|
α – гло-булины |
17,43±0,81 Cv=8,04 |
16,33±0,55 Cv=5,79 |
16,73±1,28 Cv=13,26 |
15,87±0,15 Cv=1,59 |
16,4±1,12 Cv=11,78 |
18,9±0,5 Cv=4,58 |
|
β – гло-булины |
16,73±0,84 Cv=8,67 |
17,5±0,46 Cv=4,54 |
17,63±0,45 Cv=4,40 |
17,97±1,02 Cv=9,80 |
18,07±0,27 Cv=2,62 |
17,43±0,24 Cv=2,39 |
|
γ – гло-булины |
12,0±0,99 Cv=14,22 |
12,4±0,25 Cv=3,52 |
12,33±0,81 Cv=11,39 |
12,6±0,66 Cv=9,01 |
14,17±2,07 Cv=25,28 |
11,57±0,55 Cv=8,22 |
Таблица 23. Фракции белка у телят после выздоровления в осенний период, %
| Фракции белка |
Опытные |
Контроль |
||||
|
1-я группа |
2-я группа |
3-я группа |
4-я группа |
5-я группа |
||
|
Альбу-мины |
57,67±0,22 Cv=0,66 |
57,7±0,85 Cv=2,56 |
56,67±0,47 Cv=1,44 |
56,83±0,82 Cv=2,49 |
58,17±0,32 Cv=0,95 |
54,77±1,62 Cv=5,11 |
|
α – гло-булины |
9,97±0,35 Cv=6,05 |
10,8±1,12 Cv=18,03 |
11,4±0,61 Cv=9,28 |
13,1±1,19 Cv=15,77 |
9,47±1,19 Cv=21,71 |
15,47±1,89 Cv=21,11 |
|
β – гло-булины |
16,37±0,54 Cv=5,68 |
16,3±0,31 Cv=3,25 |
15,87±0,54 Cv=5,86 |
15,0±0,25 Cv=2,91 |
16,8±0,23 Cv=2,38 |
16,1±1,32 Cv=14,23 |
|
γ – гло-булины |
15,93±0,24 Cv=2,61 |
15,2±0,55 Cv=6,24 |
16,7±0,67 Cv=7,21 |
15,13±0,91 Cv=10,46 |
15,57±0,81 Cv=9,02 |
13,67±1,50 Cv=19,04 |
При проведении опыта отмечены также изменения в уровне холестерина в крови телят опытных групп. Содержание холестерина у телят 1–5-й опытных групп по сравнению с аналогами из контроля было ниже в летний период – на 5,2 (P<0,001); 3,1 (P<0,01); 2,8 (P<0,05); 0,7; 2,1 (P<0,1) %, осенью – на 1,4 (P<0,1); 1,5; 1,0; 1,0; 1,0 % соответственно. По сравнению с исходными данными в летний период, уровень холестерина снизился у телят 1, 2, 3 и 5-й опытных групп на 4,3; 1,1; 2,0; 1,5 %, а у животных 4-й опытной и контрольной групп – увеличился на 0,5 и 0,4 % соответственно. В осенний период данный показатель снизился у телят 1–5-й опытных и контрольной групп на 1,0; 1,6; 0,9; 1,2; 0,7 и 0,3 % соответственно (табл. 24).
Таблица 24. Динамика уровня холестерина в крови подопытных телят, ммоль/л
| Группа |
Лето |
Осень |
||
|
До лечения |
После выздоровления |
До лечения |
После выздоровления |
|
|
1-я опытная |
4,642±0,037 Cv=1,78 |
4,444±0,021# Cv=1,07 |
4,649±0,027 Cv=1,28 |
4,601±0,011* Cv=0,52 |
|
2-я опытная |
4,596±0,069 Cv=3,37 |
4,544±0,026*** Cv=1,28 |
4,674±0,012 Cv=0,58 |
4,598±0,025 Cv=1,2 |
|
3-я опытная |
4,648±0,057 Cv=2,73 |
4,557±0,038** Cv=1,86 |
4,665±0,010 Cv=0,46 |
4,621±0,012 Cv=0,56 |
|
4-я опытная |
4,628±0,026 Cv=1,27 |
4,652±0,035 Cv=1,69 |
4,673±0,024 Cv=1,15 |
4,619±0,017 Cv=0,82 |
|
5-я опытная |
4,66±0,019 Cv=0,93 |
4,589±0,038* Cv=1,85 |
4,652±0,014 Cv=0,69 |
4,621±0,017 Cv=0,83 |
|
контроль |
4,654±0,012 Cv=0,57 |
4,635±0,028 Cv=1,34 |
4,655±0,011 Cv=0,52 |
4,633±0,014 Cv=0,65 |
В активной фазе (в данном случае – ниже мезора, т. к. отмечена тенденция к понижению уровня холестерина у телят всех групп) влияния ветома 3 на уровень холестерина в летний период находились показатели 1, 2 и 3-й опытных групп, которые были ниже мезора ((4,567±0,034) ммоль/л) на 2,7; 0,5 и 0,2 %, в пассивной фазе – показатели 4-й и 5-й опытных групп, которые были выше мезора на 1,9 и 0,5 % соответственно. Продолжительность активной фазы превышала пассивную на 18,2 %. Абсолютная амплитуда показателей уровня холестерина составила 0,21 ммоль/л, относительная амплитуда – 1,05 ед., коэффициент синхронизации – 0,35 ед./ч. Акрофаза влияния ветома 3 на уровень холестерина у телят в летний период приходилась на 7 и 19 ч, что соответствует показателям телят 1-й опытной группы (рис. 25).
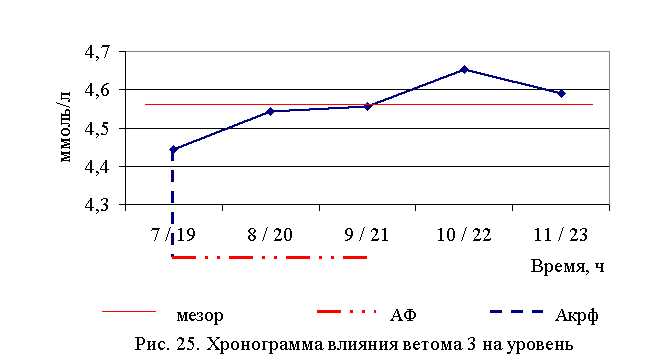
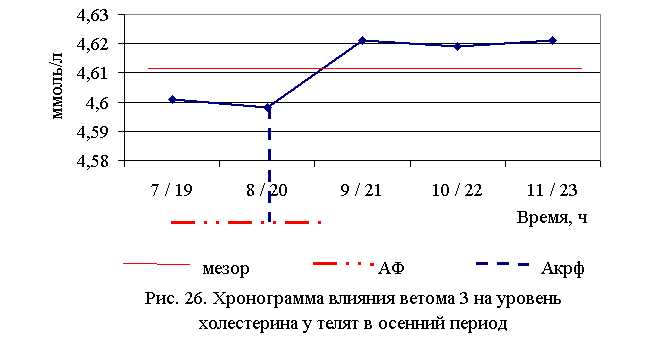
В активной фазе влияния ветома 3 на уровень холестерина в осенний период находились показатели 1-й и 2-й опытных групп, которые были ниже мезора ((4,612±0,005) ммоль/л) на 0,2 и 0,3 %, в пассивной фазе – показатели 3, 4 и 5-й опытных групп, которые были выше мезора на 0,2 % соответственно. Продолжительность активной фазы была меньше пассивной на 54,5 %. Абсолютная амплитуда показателей уровня холестерина составила 0,02 ммоль/л, относительная амплитуда – 1,01 ед., коэффициент синхронизации – 1,01 ед./ч. Акрофаза влияния ветома 3 на уровень холестерина у телят в осенний период приходилась на 8 и 20 ч, что соответствует показателям телят 2-й опытной группы (рис. 26). Таким образом, ветом 3 обладает выраженным влиянием на показатели белкового обмена, повышая уровень общего белка, альбуминов и g-глобулинов в пределах физиологических норм. При применении препарата также отмечено понижение уровня холестерина. Снижение показателей a- и b-глобулинов, скорее всего, связано с разрешением воспалительного процесса. Установлена зависимость влияния ветома 3 на показатели белкового обмена от временного фактора. Оптимальное повышение уровня общего белка и снижение уровня холестерина отмечено при применении препарата в 7 и 19 ч – в летний период, и в 8 и 20 ч – осенью.
При проведении исследований отмечены изменения в уровне небелковых азотистых компонентов крови телят опытных групп. Показатели уровня мочевины и креатинина в крови животных всех групп находились в пределах физиологической нормы.
Под влиянием ветома 3 уровень мочевины в крови телят опытных групп достоверно снижался (табл. 25).
Содержание мочевины в крови телят 1–5-й опытных групп по сравнению с аналогами из контроля было ниже в летний период – на 13,4 (P<0,001); 9,1 (P<0,1); 1,2; 5,2 (P<0,1); 2,8 %, осенью – на 2,8 (P<0,01); 4,4 (P<0,05); 3,8 (P<0,05); 1,8 (P<0,1); 1,8 % соответственно. По сравнению с исходными данными в летний период уровень мочевины снизился у телят 1–5-й опытных групп на 10,0; 9,4; 2,1; 5,7; 3,8 % соответственно, а у аналогов из контроля – увеличился на 0,8 %. В осенний период данный показатель снизился у телят 1–5-й опытных и контрольной групп на 6,0; 6,1; 4,9; 6,3; 3,6 и 1,8 % соответственно (табл. 25).
Таблица 25. Динамика уровня мочевины в крови подопытных телят, ммоль/л
| Группа |
Лето |
Осень |
||
|
До лечения |
После выздоровления |
До лечения |
После выздоровления |
|
|
1-я опытная |
12,841±0,188 Cv=3,27 |
11,551±0,267# Cv=5,17 |
13,594±0,237 Cv=3,89 |
12,771±0,012*** Cv=2,01 |
|
2-я опытная |
13,381±0,399 Cv=6,66 |
12,118±0,547* Cv=10,09 |
13,363±0,148 Cv=2,48 |
12,553±0,207** Cv=3,69 |
|
3-я опытная |
13,451±0,271 Cv=4,51 |
13,169±0,182 Cv=3,09 |
13,274±0,234 Cv=3,94 |
12,630±0,135** Cv=2,38 |
|
4-я опытная |
13,401±0,219 Cv=3,65 |
12,637±0,291* Cv=5,15 |
13,767±0,136 Cv=2,22 |
12,902±0,074* Cv=1,29 |
|
5-я опытная |
13,468±0,135 Cv=2,24 |
12,962±0,211 Cv=3,64 |
13,376±0,152 Cv=2,55 |
12,896±0,186 Cv=3,22 |
|
контроль |
13,711±0,254 Cv=4,14 |
12,944±0,255 Cv=4,41 |
13,202±0,285 Cv=4,82 |
12,754±0,229 Cv=4,01 |
В активной фазе (в данном случае – ниже мезора, т.к. во время исследований отмечено снижение уровня мочевины во всех группах) влияния ветома 3 на уровень мочевины в летний период находились показатели 1-й и 2-й опытных групп, которые были ниже мезора ((12,487±0,29) ммоль/л) на 7,5 и 3,0 %, в пассивной фазе – показатели 3, 4 и 5-й опытных групп, которые были выше мезора на 5,5; 1,2 и 3,8 % соответственно. Продолжительность активной фазы была короче пассивной на 54,5 %. Абсолютная амплитуда показателей уровня мочевины составила 1,6 ммоль/л, относительная амплитуда – 1,14 ед., коэффициент синхронизации – 0,57 ед./ч. Акрофаза влияния ветома 3 на уровень мочевины у телят в летний период приходилась на 7 и 19 ч, что соответствует показателям телят 1-й опытной группы (рис. 27). В активной фазе влияния ветома 3 на уровень мочевины в осенний период находились показатели 2-й и 3-й опытных групп, которые были ниже мезора ((12,76±0,29) ммоль/л) на 1,5 и 0,9 %, в пассивной фазе – показатели 1, 4 и 5-й опытных групп, которые были выше мезора на 0,2; 1,2 и 1,1 % соответственно. Продолжительность активной фазы превышала пассивную в 2 раза. Абсолютная амплитуда показателей уровня мочевины составила 0,35 ммоль/л, относительная амплитуда – 1,03 ед., коэффициент синхронизации – 0,52 ед./ч. Акрофаза влияния ветома 3 на уровень мочевины у телят в осенний период приходилась на 8 и 20 ч, что соответствует показателям телят 2-й опытной группы (рис. 28).
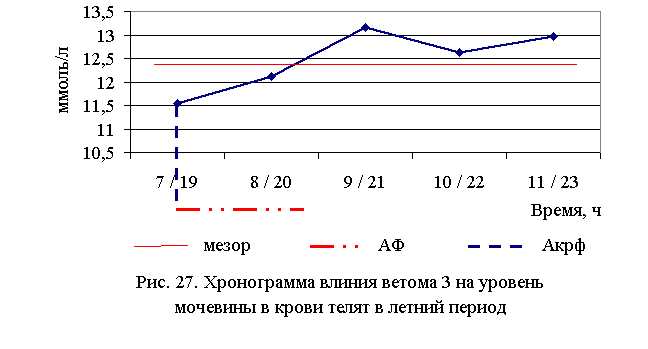
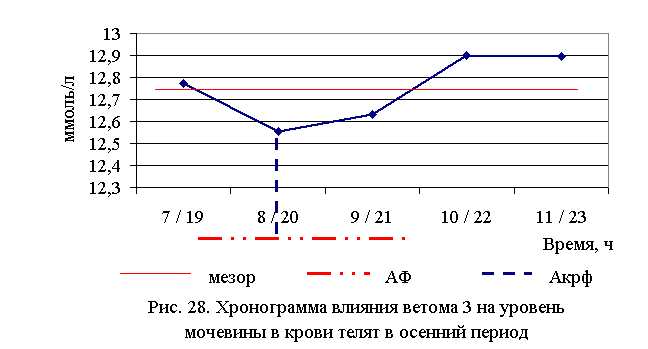
При проведении исследований уровень креатинина в крови телят опытных групп также понижался (табл. 26).
Содержание креатинина после выздоровления в крови животных 1–5-й опытных было ниже по сравнению с аналогами из контроля в летний период – на 27,1; 20,3; 20,9; 14,9; 22,3 %, осенью – на 16,7; 25,6; 21,1; 18,1; 6,7 % соответственно. По сравнению с исходными данными уровень креатинина в крови телят 1–5-й опытных снизился на 16,3; 3,8; 10,0; 8,2; 3,1 % – в летний, и на 15,2; 27,2; 14,9; 13,0; 2,6 % – в осенний периоды соответственно. Тогда как у аналогов из контроля количество креатинина в крови увеличилось по сравнению с исходными данными на 7,9 и 0,4 % летом и осенью соответственно (табл. 26).
Таблица 26. Динамика уровня креатинина в крови подопытных телят, мкмоль/л
| Группа |
Лето |
Осень |
||
|
До лечения |
После выздоровления |
До лечения |
После выздоровления |
|
|
1-я опытная |
20,684±0,734 Cv=6,15 |
17,313±1,16 Cv=11,60 |
22,363±0,794 Cv=6,15 |
18,971±0,886 Cv=8,08 |
|
2-я опытная |
19,692±2,204 Cv=19,39 |
18,945±0,922 Cv=8,44 |
23,258±1,84 Cv=13,7 |
16,941±1,255 Cv=12,83 |
|
3-я опытная |
20,88±2,327 Cv=19,3 |
18,799±1,22 Cv=11,24 |
21,093±3,555 Cv=29,19 |
17,957±1,851 Cv=17,86 |
|
4-я опытная |
22,029±3,253 Cv=25,58 |
20,225±1,535 Cv=13,14 |
21,446±0,763 Cv=6,16 |
18,654±1,094 Cv=10,16 |
|
5-я опытная |
19,039±0,95 Cv=8,64 |
18,455±1,035 Cv=9,72 |
21,807±2,769 Cv=21,99 |
21,25±1,81 Cv=14,75 |
|
контроль |
21,684±5,202 Cv=41,55 |
20,268±3,264 Cv=27,9 |
21,631±0,492 Cv=3,94 |
19,843±0,331 Cv=2,89 |
В активной фазе (ниже мезора) влияния ветома 3 на уровень креатинина в летний период находились показатели 1-й и 5-й опытных групп, которые были ниже мезора ((18,747±0,467) мкмоль/л) на 7,6 и 1,6 %, в пассивной фазе – показатели 2, 3 и 4-й опытных групп, которые были выше мезора на 1,1; 0,3 и 7,9 % соответственно. Продолжительность активной фазы была меньше пассивной на 70,3 %. Абсолютная амплитуда показателей уровня креатинина составила 2,9 мкмоль/л, относительная амплитуда – 1,2 ед., коэффициент синхронизации – 0,4 ед./ч. Акрофаза влияния ветома 3 на уровень креатинина у телят в летний период приходилась на 7 и 19 ч, что соответствует показателям телят 1-й опытной группы (рис. 29).
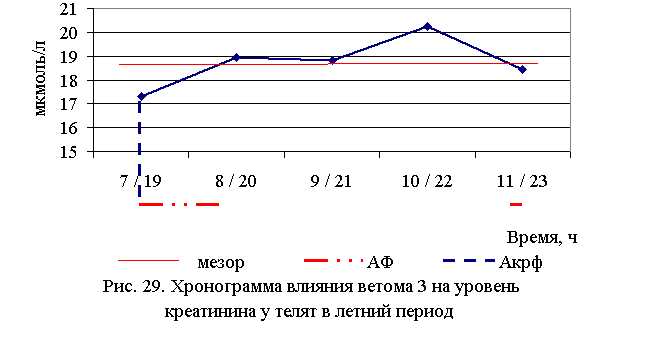
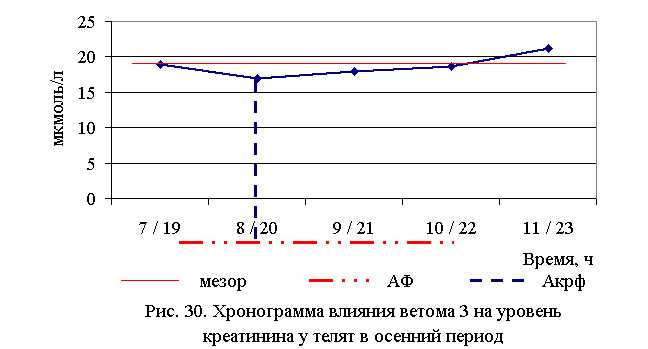
В активной фазе влияния ветома 3 на уровень креатинина в осенний период находились показатели 2, 3 и 4-й опытных групп, которые были ниже мезора ((18,755±0,714) мкмоль/л) на 9,7; 4,3 и 0,5 %, в пассивной фазе – показатели 1-й и 5-й опытных групп, которые были выше мезора на 1,2 и 13,3% соответственно. Продолжительность активной фазы превышала пассивную на 66,7 %. Абсолютная амплитуда показателей уровня креатинина составила 4,3 мкмоль/л, относительная амплитуда – 1,3 ед., коэффициент синхронизации – 0,43 ед./ч. Акрофаза влияния ветома 3 на уровень креатинина у телят в осенний период приходилась на 8 и 20 ч, что соответствует показателям телят 2-й опытной группы (рис. 30). Таким образом, ветом 3 обладает выраженным влиянием на небелковые азотистые компоненты крови, вызывая понижение уровня мочевины и креатинина у телят, что может свидетельствовать об улучшении детоксицирующей функции печени. Оптимальное снижение уровня мочевины и креатинина отмечено при применении препарата в 7 и 19 ч – в летний период, и в 8 и 20 ч – осенью.
При проведении опыта отмечены изменения в уровне желчных пигментов в крови телят. Необходимо отметить, что до лечения уровень билирубина и его фракций превышал границу физиологической нормы во всех группах. При применении ветома 3 наблюдалась тенденция к понижению уровня данных показателей в крови телят опытных групп (табл. 27-32).
Содержание общего билирубина в крови телят 1–5-й опытных групп после выздоровления был ниже по сравнению с аналогами из контроля в летний период – на 24,4 (P<0,1); 14,3 (P<0,1); 6,3; 6,1; 4,3 %, осенью – на 8,56; 19,57 (P<0,001); 9,70 (P<0,05); 4,96; 4,74 % соответственно. По сравнению с исходными данными уровень общего билирубина снизился у телят 1–5-й опытных и контрольной групп на 29,0; 17,5; 6,6; 5,9; 12,3 и 0,3 % – в летний, и на 10,06; 21,33; 9,54; 5,20; 5,44 и 0,52 % – в осенний периоды соответственно (табл. 27).
Таблица 27. Динамика содержания общего билирубина в крови телят в летний период, мкмоль/л
| Группа |
До лечения |
После выздоровления |
|
1-я опытная |
23,47±0,90 Cv=8,6 |
16,45±1,04** Cv=14,13 |
|
2-я опытная |
22,60±1,08 Cv=10,66 |
18,65±0,67* Cv=8,01 |
|
3-я опытная |
21,84±1,63 Cv=16,32 |
20,40±0,37 Cv=4,08 |
|
4-я опытная |
21,73±2,15 Cv=22,09 |
20,44±0,89 Cv=9,71 |
|
5-я опытная |
23,75±0,48 Cv=4,5 |
20,84±1,2 Cv=12,87 |
|
Контроль |
21,94±0,88 Cv=8,97 |
20,45±1,22 Cv=13,37 |
Таблица 28. Динамика содержания общего билирубина в крови телят в осенний период, мкмоль/л
| Группа |
До лечения |
После выздоровления |
|
1-я опытная |
23,17±0,88 Cv=8,51 |
20,84±1,03 Cv=11,05 |
|
2-я опытная |
23,3±0,84 Cv=8,08 |
18,33±0,55# Cv=6,66 |
|
3-я опытная |
22,75±0,68 Cv=6,68 |
20,58±0,77** Cv=8,38 |
|
4-я опытная |
22,83±0,94 Cv=9,21 |
21,66±0,80 Cv=8,25 |
|
5-я опытная |
22,96±0,66 Cv=6,42 |
21,71±0,57 Cv=5,86 |
|
Контроль |
23,45±0,49 Cv=4,74 |
21,63±0,74 Cv=7,62 |
В активной фазе (ниже мезора) влияния ветома 3 на уровень общего билирубина в летний период находились показатели 1-й и 2-й опытных групп, которые были ниже мезора ((19,356±0,819) мкмоль/л) на 15,0 и 3,6 %, в пассивной фазе – показатели 3, 4 и 5-й опытных групп, которые были выше мезора на 5,4; 5,6 и 7,7 % соответственно. Продолжительность активной фазы была меньше пассивной на 54,5%. Абсолютная амплитуда показателей уровня общего билирубина составила 4,4 мкмоль/л, относительная амплитуда – 1,3 ед., коэффициент синхронизации – 0,33 ед./ч. Акрофаза влияния ветома 3 на уровень общего билирубина у телят в летний период приходилась на 7 и 19 ч, что соответствует показателям телят 1-й опытной группы (рис. 31).
В активной фазе влияния ветома 3 на уровень общего билирубина в осенний период находились показатели 2-й и 3-й опытных групп, которые были ниже мезора ((20,624±0,615) мкмоль/л) на 11,1 и 0,2 %, в пассивной фазе – показатели 1, 4 и 5-й опытных групп, которые были выше мезора на 1,0; 5,0 и 5,3 % соответственно. Продолжительность активной и пассивной фаз были равными. Абсолютная амплитуда показателей уровня общего белка составила 3,4 мкмоль/л, относительная амплитуда – 1,2 ед., коэффициент синхронизации – 0,4 ед./ч. Акрофаза влияния ветома 3 на уровень общего билирубина у телят в осенний период приходилась на 8 и 20 ч, что соответствует показателям телят 2-й опытной группы (рис. 32).
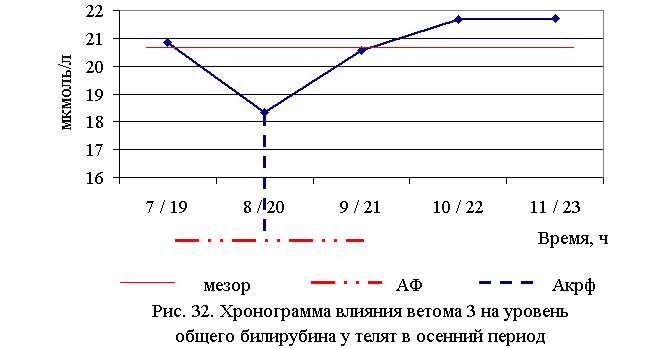
После выздоровления в крови телят 1–5-й опытных групп уровень конъюгированного билирубина был ниже по сравнению с аналогами из контроля в летний период – на 33,3; 21,2; 15,5; 11,2; 15,0 %, осенью – на 15,6; 25,3; 12,5; 7,2; 6,1 % соответственно. По сравнению с исходными данными содержание конъюгированного билирубина в крови телят 1–5-й опытных и контрольной групп снизилось на 25,6; 21,2; 11,3; 8,9; 14,5 и 2,7 % – в летний, и на 20,6; 31,8; 18,2; 16,0; 15,0 и 6,84 % – в осенний периоды соответственно (табл. 29-30). Уровень неконъюгированного билирубина в крови телят 1-й и 2-й опытных групп после выздоровления в летний период был ниже показателей контрольной группы на 11,5 и 4,2 %, а у животных 3, 4 и 5-й опытных групп – выше на 7,3; 1,4 и 11,5 % соответственно. В осенний период у телят 1–5-й опытных групп данный показатель был ниже уровня неконъюгированного билирубина телят из контроля на 1,0; 13,5; 6,8; 2,6; 3,3 % соответственно.
Таблица 29. Динамика уровня конъюгированного билирубина у телят в летний период, мкмоль/л
| Группа |
До лечения |
После выздоровления |
|
1-я опытная |
11,61±1,02 Cv=19,65 |
8,64±0,56# Cv=14,49 |
|
2-я опытная |
12,94±0,75 Cv=12,91 |
10,2±0,64** Cv=14,0 |
|
3-я опытная |
12,33±1,33 Cv=24,17 |
10,94±0,92* Cv=18,8 |
|
4-я опытная |
12,63±1,15 Cv=20,38 |
11,5±0,38* Cv=7,41 |
|
5-я опытная |
12,88±0,67 Cv=11,64 |
11,01±1,32 Cv=26,83 |
|
Контроль |
13,31±0,46 Cv=7,65 |
12,95±0,53 Cv=9,12 |
По сравнению с исходными данными, в летний период содержание неконъюгированного билирубина снизилось у телят 1–5-й опытных групп на 34,1; 12,5; 1,6; 1,8; 9,6 % соответственно, тогда как у аналогов из контроля данный показатель увеличился на 1,1 % (табл. 31-32). В осенний период уровень неконъюгированного билирубина у телят 2-й опытной группы был ниже по сравнению с исходными данными на 8,6 %, тогда как у животных 1, 3, 4, 5-й опытных и контрольной групп данный показатель увеличился на 2,3; 1,0; 9,0; 6,8 и 7,2 % соответственно (табл. 31-32).
Таким образом, ветом 3 оказывает влияние на показатели пигментного обмена, понижая уровень билирубина и его фракций в крови телят опытных групп, что может свидетельствовать об улучшении функции печени. Установлена зависимость влияния пробиотика на уровень билирубина в зависимости от времени применения препарата. Максимальное снижение общего билирубина и его фракций отмечено при применении ветома 3 в 7 и 19 ч – в летний период, и в 8 и 20 ч – осенью.
Таблица 30. Динамика уровня конъюгированного билирубина у телят в осенний период, мкмоль/л
| Группа |
До лечения |
После выздоровления |
|
1-я опытная |
12,46±0,63 Cv=11,32 |
9,89±0,63* Cv=14,3 |
|
2-я опытная |
12,82±0,37 Cv=6,45 |
8,75±0,46*** Cv=11,83 |
|
3-я опытная |
12,53±0,55 Cv=9,84 |
10,25±0,42* Cv=9,17 |
|
4-я опытная |
12,94±0,77 Cv=13,37 |
10,88±0,60 Cv=12,31 |
|
5-я опытная |
12,94±0,21 Cv=5,37 |
11,0±0,42 Cv=0,55 |
|
Контроль |
12,58±0,37 Cv=6,63 |
11,72±0,53 Cv=10,20 |
Таблица 31. Динамика уровня неконъюгированного билирубина у телят в летний период, мкмоль/л
| Группа |
До лечения |
После выздоровления |
|
1-я опытная |
11,85±0,52 Cv=9,72 |
7,81±1,54 Cv=43,99 |
|
2-я опытная |
9,66±1,21 Cv=27,95 |
8,45±0,54 Cv=14,34 |
|
3-я опытная |
9,61±2,56 Cv=59,65 |
9,46±1,22 Cv=28,9 |
|
4-я опытная |
9,1±3,08 Cv=75,81 |
8,94±0,53 Cv=13,17 |
|
5-я опытная |
10,87±0,5 Cv=10,37 |
9,83±0,89 Cv=20,31 |
|
Контроль |
8,72±1,35 Cv=34,66 |
8,82±1,66 Cv=42,11 |
Таблица 32. Динамика уровня неконъюгированного билирубина у телят в осенний период, мкмоль/л
| Группа |
До лечения |
После выздоровления |
|
1-я опытная |
10,71±0,54 Cv=11,33 |
10,96±1,57 Cv=32,05 |
|
2-я опытная |
10,48±1,08 Cv=23,14 |
9,58±0,9 Cv=21,05 |
|
3-я опытная |
10,22±0,45 Cv=9,77 |
10,32±1,12 Cv=24,15 |
|
4-я опытная |
9,89±0,68 Cv=15,35 |
10,78±0,38 Cv=7,90 |
|
5-я опытная |
10,02±0,64 Cv=14,30 |
10,7±0,36 Cv=7,60 |
|
Контроль |
10,33±0,28 Cv=5,98 |
11,07±0,47 Cv=9,42 |
При проведении исследований отмечены изменения в уровне аминотрансфераз. Содержание аланинаминотрансферазы (АЛТ) в сыворотке крови у телят 1–5-й опытных групп после выздоровления было ниже по сравнению с аналогичным показателем животных контрольной группы в летний период – на 25,9; 10,2; 9,8; 14,9; 20,9 %, осенью – на 21,7; 23,5; 18,1; 12,0; 7,1 % соответственно. По сравнению с исходными данными уровень АЛТ снизился у телят 1–5-й опытных и контрольной групп на 18,3; 14,2; 18,8; 22,5; 21,8 и 8,9 % – в летний, и на 23,0; 29,7; 24,8; 18,8; 16,0 и 8,1 % – в осенний периоды соответственно (табл. 33).
Уровень аспартатаминотрансферазы (АСТ) в сыворотке крови у телят 1–5-й опытных групп после выздоровления был ниже по сравнению с аналогичным показателем животных контрольной группы в летний период – в 2,5; 2,0; 2,5; 1,9; 2,3 раза, осенью – в 2,0; 2,4; 1,9; 2,2; 1,9 раз соответственно. По сравнению с исходными данными содержание АСТ у животных 1–5-й опытных групп увеличилось в 5,3; 4,0; 3,8; 1,9; 3,3 раза – в летний, и в 3,2; 4,2; 2,6; 5,0; 3,3 раза – в осенний периоды соответственно. В крови животных контрольной группы уровень АСТ по сравнению с исходными данными в летний период – уменьшился на 25,0 %, а в осенний период – увеличился на 33,3 % (табл. 34).
Таблица 33. Динамика уровня аминотрансфераз в крови телят в летний период, мкмоль/л
| Группа |
АЛТ |
АСТ |
||
|
До лечения |
После выздоровления |
До лечения |
После выздоровления |
|
|
1-я |
10,65±0,3 Cv=6,34 |
8,7±0,24 Cv=6,23 |
0,4±0,1 Cv=55,9 |
2,1±0,46 Cv=50,58 |
|
2-я |
12,3±0,35 Cv=6,33 |
10,55±0,2 Cv=4,24 |
0,45±0,09 Cv=46,48 |
1,8±0,36 Cv=45,43 |
|
3-я |
13,05±0,8 Cv=13,71 |
10,6±0,49 Cv=10,36 |
0,55±0,14 Cv=59,27 |
2,1±0,26 Cv=27,41 |
|
4-я |
12,9±1,31 Cv=22,63 |
10,0±0,26 Cv=5,86 |
0,9±0,41 Cv=101,3 |
1,75±0,14 Cv=15,31 |
|
5-я |
11,9±0,93 Cv=17,49 |
9,3±0,31 Cv=7,46 |
0,6±0,06 Cv=22,82 |
2,0±0,14 Cv=15,31 |
|
контроль |
12,9±0,56 Cv=9,75 |
11,75±0,4 Cv=7,52 |
0,65±0,23 Cv=79,76 |
0,6±0,1 Cv=37,27 |
Анализ хронобиологических особенностей влияния ветома 3 на уровень АЛТ и АСТ не позволяет сделать однозначных выводов. До лечения коэффициент де Ритиса был значительно понижен как в летний, так и в осенний периоды опыта. После выздоровления у телят опытных групп отмечена тенденция к повышению показателя данного диагностического теста, в основном за счет значительного повышения уровня аспартатаминотрансферазы, а также уменьшения аланинаминотрансферазы крови.
Таблица 34. Динамика уровня аминотрансфераз в крови телят в осенний период, мкмоль/л
| Группа |
АЛТ |
АСТ |
||
|
начало опыта |
окончание опыта |
начало опыта |
окончание опыта |
|
|
1-я |
11,5±0,37 Cv=7,21 |
8,85±0,39 Cv=9,91 |
0,5±0,11 Cv=50,0 |
1,6±0,13 Cv=17,82 |
|
2-я |
12,3±0,22 Cv=3,91 |
8,65±0,62 Cv=15,91 |
0,45±0,15 Cv=72,44 |
1,9±0,1 Cv=11,77 |
|
3-я |
12,3±0,35 Cv=6,33 |
9,25±0,31 Cv=7,4 |
0,6±0,15 Cv=55,9 |
1,55±0,12 Cv=17,67 |
|
4-я |
12,25±0,29 Cv=5,2 |
9,95±0,2 Cv=4,49 |
0,35±0,06 Cv=39,12 |
1,75±0,11 Cv=14,29 |
|
5-я |
12,5±0,33 Cv=5,83 |
10,5±0,21 Cv=4,45 |
0,45±0,15 Cv=72,44 |
1,5±0,22 Cv=33,33 |
|
контроль |
12,3±0,4 Cv=7,24 |
11,3±0,38 Cv=7,57 |
0,6±0,13 Cv=47,51 |
0,8±0,09 Cv=26,15 |
Рис. 33. Динамика коэффициента де Ритиса у телят в летний период
Коэффициент де Ритиса у телят 1–5-й опытных групп превышал после выздоровления аналогичный показатель животных контрольной группы в 4,6; 3,4; 3,9; 3,4; 4,2 раза – в летний, и в 2,5; 3,1; 2,3; 2,5; 2,0 раза – в осенний периоды соответственно (рис. 33).
В активной фазе действия ветома 3 на показатели коэффициента де Ритиса у телят в летний период находились значения 1-й и 5-й опытных групп, которые превышали мезор ((0,199±0,026) ед.) на 18,6 и 8,0 %, в пассивной фазе – 2, 3 и 4-й опытных групп, в которых коэффициент де Ритиса был ниже мезора на 14,1; 0,5 и 12,1 % соответственно. Абсолютная амплитуда показателей составила 0,07 ед., относительная амплитуда – 1,4 ед., коэффициент синхронизации – 1,4 ед./ч. Акрофаза влияния ветома 3 на коэффициент де Ритиса в летний период приходилась на 7 и 19 ч, что соответствует показателям телят 1-й опытной группы (рис. 33).
В активной фазе действия ветома 3 на показатели коэффициента де Ритиса у телят в осенний период находились значения 1-й и 2-й опытных групп, в которых данный показатель превышал мезор ((0,176±0,011) ед.) на 2,8 и 25,0 %, в пассивной фазе – показатели 3-й и 5-й опытных групп, в которых коэффициент де Ритиса был ниже мезора на 8,0 и 18,8 % соответственно, у телят 3-й опытной группы коэффициент де Ритиса соответствовал мезору. Абсолютная амплитуда показателей составила 0,08 ед., относительная амплитуда – 1,5 ед., коэффициент синхронизации – 0,51 ед./ч. Акрофаза влияния ветома 3 на коэффициент де Ритиса в осенний период приходилась на 8 и 20 ч, что соответствует показателям телят 2-й опытной группы (рис. 34).
Таким образом, при проведении исследований ветом 3 оказывал влияние на уровень аминотрансфераз у телят опытных групп, под действием препарата отмечена тенденция к повышению коэффициента де Ритиса, что может свидетельствовать об улучшении функционального состояния печени. Установлена зависимость действия пробиотика на уровень АЛТ, АСТ и коэффициента де Ритиса от времени применения препарата и сезона. Оптимальный эффект получен при применении ветома 3 в 7 и 19 ч – летом и в 8 и 20 ч – осенью.
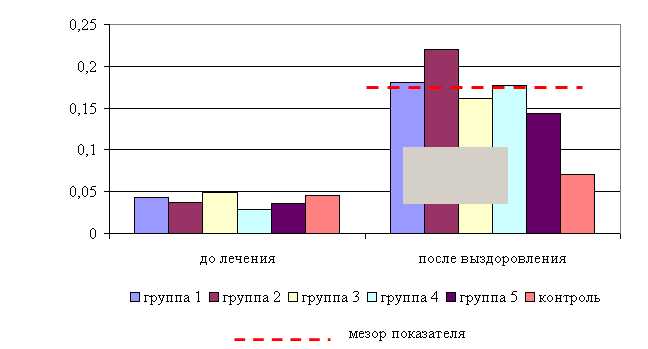
Рис. 34. Динамика коэффициента де Ритиса у телят в осенний период
Отмечено недостоверное влияние препарата на минеральный обмен веществ.
После выздоровления количество кальция в крови телят 1-й и 5-й опытных групп в летний период было выше по сравнению с аналогами из контроля 5,0 и 4,5 %, а у животных 2, 3 и 4-й опытных групп – ниже на 0,04; 0,3; 0,4 % соответственно; в осенний период уровень кальция в крови телят 1, 2 и 4-й опытных групп был выше аналогичного показателя телят контрольной группы на 1,4; 0,7 и 0,6 %, а у животных 3-й и 5-й опытных групп – ниже на 0,1 и 0,7% соответственно. По сравнению с исходными данными в летний период уровень кальция в крови телят 1, 2 и 5-й опытных и контрольной групп увеличился на 4,9; 1,5; 3,5 и 0,9 %, а у животных 3-й и 4-й опытных групп – уменьшился на 0,8 и 2,5 % соответственно. Количество кальция в осенний период увеличилось по сравнению с исходными данными у телят 1–5-й опытных групп на 4,4; 3,7; 0,1; 1,3; 0,2 % соответственно, тогда как у животных контрольной группы – уменьшилось на 0,64 % (табл. 36-37).
Уровень фосфора в крови телят 1–5-й групп после выздоровления был ниже аналогичного показателя животных контрольной группы на 6,3; 2,3; 2,3; 2,7; 4,8 % – в летний, и на 2,6; 5,1; 3,7; 3,6; 3,8 % – в осенний периоды соответственно. По сравнению с исходными данными уровень фосфора в летний период увеличился у телят 1-й и 2-й опытных и контрольной групп на 1,4; 0,3 и 0,3 %, а у животных 3, 4 и 5-й опытных групп – уменьшился на 3,0; 0,5 и 5,5 % соответственно. В осенний период количество кальция в крови телят 1–5-й опытных групп уменьшилось по сравнению с исходными данными на 2,9; 3,4; 1,0; 3,2; 2,7 % соответственно, а у аналогов из контроля – увеличилось на 0,8%. (табл. 35-36).
Таблица 36. Динамика показателей кальция и фосфора в крови телят летом, ммоль/л
| Группа |
Кальций |
Фосфор |
||
|
До лечения |
После выздоровления |
До лечения |
После выздоровления |
|
|
1-я |
2,662±0,048 Cv=4,08 |
2,792±0,05* Cv=4,01 |
1,234±0,052 Cv=9,49 |
1,251±0,026* Cv=4,69 |
|
2-я |
2,617±0,031 Cv=2,66 |
2,657±0,105 Cv=8,85 |
1,301±0,028 Cv=4,75 |
1,305±0,033 Cv=5,67 |
|
3-я |
2,673±0,037 Cv=3,13 |
2,651±0,059 Cv=4,95 |
1,345±0,035 Cv=5,78 |
1,305±0,025 Cv=4,36 |
|
4-я |
2,715±0,054 Cv=4,48 |
2,648±0,07 Cv=5,94 |
1,305±0,027 Cv=4,63 |
1,299±0,013 Cv=2,26 |
|
5-я |
2,684±0,041 Cv=3,39 |
2,778±0,042* Cv=3,41 |
1,345±0,04 Cv=6,72 |
1,271±0,047 Cv=8,27 |
|
Контроль |
2,683±0,058 Cv=4,87 |
2,658±0,038 Cv=3,16 |
1,311±0,027 Cv=4,57 |
1,335±0,029 Cv=4,89 |
Таблица 37. Динамика уровня кальция и фосфора в крови телят осенью, ммоль/л
| Группа |
Кальций |
Фосфор |
||
|
До лечения |
После выздоровления |
До лечения |
После выздоровления |
|
|
1-я |
2,545±0,018 Cv=1,61 |
2,657±0,014 Cv=1,2 |
1,366±0,018 Cv=2,94 |
1,327±0,027 Cv=4,51 |
|
2-я |
2,545±0,024 Cv=2,1 |
2,639±0,09 Cv=0,73 |
1,339±0,012 Cv=2,09 |
1,293±0,040 Cv=6,86 |
|
3-я |
2,616±0,020 Cv=1,73 |
2,619±0,031 Cv=2,64 |
1,328±0,011 Cv=1,86 |
1,313±0,034 Cv=5,82 |
|
4-я |
2,604±0,022 Cv=1,90 |
2,637±0,047 Cv=3,96 |
1,357±0,009 Cv=1,53 |
1,314±0,019 Cv=3,26 |
|
5-я |
2,596±0,024 Cv=2,08 |
2,602±0,024 Cv=2,1 |
1,347±0,009 Cv=1,53 |
1,311±0,025 Cv=4,34 |
|
Контроль |
2,638±0,025 Cv=2,12 |
2,621±0,022 Cv=1,91 |
1,352±0,016 Cv=2,72 |
1,363±0,014 Cv=2,34 |
Показатель кальций-фосфорного отношения по окончанию опыта в летний и осенний периоды изменился незначительно. Анализ сезонных изменений уровня кальция и фосфора в единице объема крови не позволяет сделать однозначных выводов.
Таким образом, ветом 3 обладает позитивным влиянием на белковый и пигментный обмен. Препарат нормализует функциональное состояние печени телят опытных групп, о чем свидетельствует увеличение коэффициента де Ритиса по сравнению с показателями контрольной группы в 4,6; 3,4; 3,9; 3,4; 4,2 раза – в летний, и в 2,5; 3,1; 2,3; 2,5; 2,0 раза – в осенний периоды соответственно, и снижение уровня небелковых азотистых компонентов крови. Оптимальный эффект получен при применении ветома 3 в 7 и 19 ч – летом, и в 8 и 20 ч – осенью.
3.4. Хронобиологические особенности действия ветома 3 на интенсивность роста телят после выздоровления
При изучении влияния циркадианных и сезонных биологических ритмов на интенсивность роста телят под влиянием ветома 3 установлено, что препарат обладает выраженным ростостимулирующим эффектом.
В летний период абсолютный прирост живой массы телят 1–5-й опытных групп был выше аналогичного показателя животных контрольной группы на 86,3; 51,0; 51,0; 39,2; 35,3 % соответственно (табл. 37).
Среднесуточный прирост живой массы телят 1–5-й опытных групп превышал в летний период аналогов из контроля 86,2; 50,9; 50,9; 39,1; 35,3 % соответственно (табл. 38).
Скорость роста телят 1–5-й опытных групп в летний период была выше по сравнению с животными контрольной группы на 86,2; 51,0; 51,0; 39,1; 35,3 % соответственно (рис. 36).
Таблица 37. Динамика абсолютного прироста живой массы телят, кг
| Группа |
Лето |
Осень |
|
1-я опытная |
19,0±2,77* Сv=32,66 |
19,0±1,76 Cv=20,72 |
|
2-я опытная |
15,4±2,73 Cv=39,66 |
21,2±2,13 Cv=22,47 |
|
3-я опытная |
15,4±3,25 Cv=47,18 |
19,0±1,41 Cv=16,64 |
|
4-я опытная |
14,2±1,43 Cv=22,49 |
17,0±2,7 Cv=35,54 |
|
5-я опытная |
13,8±2,15 Cv=34,93 |
17,4±2,01 Cv=25,89 |
|
Контроль |
10,2±3,44 Cv=75,43 |
15,4±3,31 Cv=48,07 |
Таблица 38. Динамика среднесуточного прироста живой массы телят, кг
| Группа |
Лето |
Осень |
|
1-я опытная |
0,633±0,92 Cv =32,61 |
0,636±0,059 Cv=20,85 |
|
2-я опытная |
0,513±0,091 Cv=39,68 |
0,706±0,071 Cv=22,5 |
|
3-я опытная |
0,513±0,108 Cv=47,18 |
0,633±0,047 Cv=16,65 |
|
4-я опытная |
0,473±0,48 Cv=22,51 |
0,566±0,09 Cv=35,55 |
|
5-я опытная |
0,460±0,072 Cv=35,05 |
0,58±0,067 Cv=25,89 |
|
Контроль |
0,340±0,115 Cv=75,44 |
0,513±0,110 Cv=48,07 |
В активной фазе влияния ветома 3 на уровень среднесуточных приростов живой массы телят в летний период находились показатели 1-й опытной группы, которые превышали мезор ((0,518±0,031) кг) на 22,2 %, в пассивной фазе – показатели 2, 3, 4 и 5-й опытных групп, которые были ниже мезора на 1,0; 1,0; 8,7 и 11,2 % соответственно. Продолжительность активной фазы превышала пассивную на 66,7 %. Абсолютная амплитуда показателей составила 0,17 кг, относительная амплитуда – 1,4 ед., коэффициент синхронизации – 0,34 ед./ч. Акрофаза влияния ветома 3 на уровень среднесуточного прироста живой массы телят в летний период приходилась на 7 и 19 ч, что соответствует показателям телят 1-й опытной группы (рис. 35).
В осенний период абсолютный прирост живой массы телят 1–5-й опытных групп был выше аналогичного показателя животных контрольной группы на 23,4; 23,4; 10,4; 13,0; 5,2 % соответственно (табл. 37).
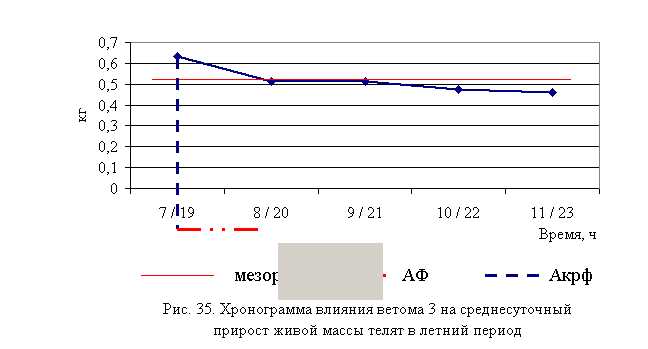
Среднесуточный прирост живой массы телят 1–5-й опытных групп превышал в летний период аналогов из контроля 23,9; 37,6; 23,4; 10,3; 13,1 % соответственно (табл. 38).
Скорость роста телят 1–5-й опытных групп в летний период была выше по сравнению с животными контрольной группы на 24,0; 37,6; 23,4; 10,3; 13,0 % соответственно (рис. 36).
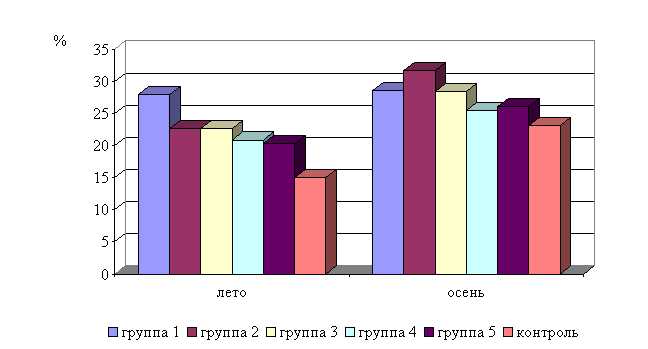
Рис. 36. Динамика скорости роста подопытных телят
В активной фазе влияния ветома 3 на среднесуточный прирост живой массы телят в осенний период находились показатели 1, 2 и 3-й опытных групп, которые превышали мезор ((0,624±0,025) кг) на 1,9; 13,1 и 1,4 %, в пассивной фазе – показатели 4 и 5-й опытных групп, которые были ниже мезора на 9,3 и 7,1 % соответственно. Продолжительность активной фазы превышала пассивную на 66,7 %. Абсолютная амплитуда показателей составила 0,14 кг, относительная амплитуда – 1,2 ед., коэффициент синхронизации – 0,6 ед./ч. Акрофаза влияния ветома 3 на среднесуточный прирост живой массы телят в осенний период приходилась на 8 и 20 ч, что соответствует показателям телят 2-й опытной группы (рис. 37).
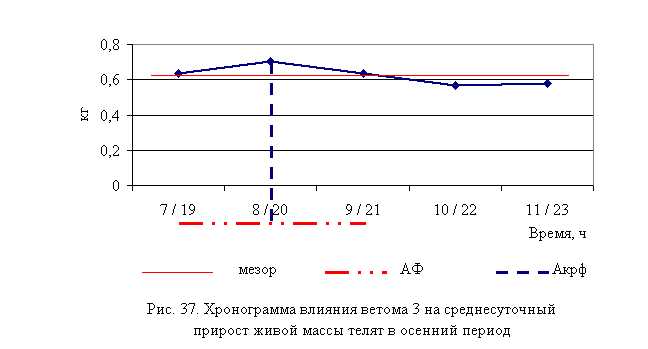
Таким образом, ветом 3 обладает выраженным ростостимулирующим эффектом. Установлена зависимость влияния пробиотика на среднесуточный прирост живой массы телят от времени применения препарата. Максимальное увеличение среднесуточного прироста живой массы и скорости роста отмечены у телят при применении ветома 3 в 7 и 19 ч – летом и 8 и 20 ч – осенью.
Анализ ростостимулирующего действия ветома 3 у телят показал выраженный эффект препарата на интенсивность роста животных. Оптимальная скорость роста телят была отмечена при применении препарата в 7 и 19 ч – в летний период, и в 8 и 20 ч – осенью, и превышала мезор показателя на 22,2 и 13,1 % соответственно. По сравнению с контролем у телят, получавших пробиотик по указанной схеме, скорость роста была выше на 86,2 и 37,6 % летом и осенью соответственно.
Увеличение скорости роста телят под влиянием пробиотика, по-видимому, связано как с купированием патологического процесса, а значит с повышением всасывающей способности кишечника, снижением потерь белка с экссулатом, так и со специфическим свойствами B. subtilis, которые продуцируют в организме 9--D-рибофуранозилгипоксантин, обладающий анаболическими свойствами (Беликов В.Г., 1993). Кроме того, сами бактерии, отмирая, становятся полноценным белковым субстратом для организма.
2. Хронофармакология пробиотиков при их применении здоровым животным
2.1. Хронобиологические особенности действия ветома 3 на морфологические показатели крови у здоровых мышей
Главный принцип превентивного применения лекарственных средств заключается в том, чтобы максимальная концентрация применяемых лекарств совпадала с акрофазой показателей. Этот принцип базируется на законе J. Wilder (1962), согласно которому та или иная функция тем слабее стимулируется и легче угнетается, чем исходно она сильнее активирована. Оптимизация времени введения лекарств основывается преимущественно на расчете времени, необходимом для создания максимальной концентрации препарата в крови ко времени развития определенного события (Комаров Ф.И. и соавт., 2000).
Эффективность превентивной хронотерапии наглядно была продемонстрирована у людей, больных эссенциальной гипертонией, в работах Л.Г. Хетагуровой (1991), Р.М. Заславской с соавт. (1991-1996), К.К. Токбаевой (1997). Использование гипотензивных препаратов разных фармакологических групп (α- и β-адреноблокаторов, клофелина, адельфана и др.) за 1,5-2 ч до установленной при первом биоритмологическом исследовании акрофазы систолического артериального давления и минутного объема сердца, позволяло достигнуть в более короткие сроки (в 2 раза) снижения артериального давления при применении меньших разовых, суточных и курсовых доз (в 2-3 раза) соответствующих препаратов, чем при традиционной терапии (Заславская Р.М., 1996). Превентивная хронотерапия гепарином и дезагрегантами оказалась более эффективной, чем традиционное лечение этими препаратами больных хроническим пиелонефритом и хронической почечной недостаточностью. Аналогичная закономерность превентивного действия гепарина и тренала на циркадианную ритмику гемостаза при инсулинзависимом сахарном диабете и синдроме диабетической нефропатии была выявлена А.И. Семеновой (1995).
Цель наших исследований заключалась в изучении хронофармакологических особенностей действия ветома 3 на морфологические показатели крови и интенсивность роста здоровых животных. Для реализации поставленной цели в виварии кафедры фармакологии и общей патологии Института ветеринарной медицины Новосибирского государственного аграрного университета были проведены опыты на мышах.
До начала эксперимента белых беспородных мышей (массой 18-20 г) в течение 5 суток адаптировали к условиям среды: свет с 7 до 22 ч, температура 18…20°С. Кормили дважды в день в 8 и 20 ч, воду давали ab libitum.
Животные по принципу аналогов были разделены на 5 опытных и контрольную группы по 12 в каждой. Мышам опытных групп назначали ветом 3 в дозе 50 мг/кг массы 2 раза в сутки вместе с кормом в различное время: в 1-й опытной группе – в 7 и 19 ч, 2-й – в 8 и 20 ч, 3-й – в 9 и 21 ч, 4-й – в 12 и 22 ч, 5-й – в 14 и 22 ч (табл. 1). Пробиотик назначали в течение 5 суток. Мышам из контроля препарат не применяли.
Для изучения действия препарата в динамике исследование крови и взвешивание мышей проводили перед началом опыта, на 6, 15 и 30-е сутки эксперимента. Кровь стабилизировали 10%-м раствором трилона Б.
Таблица 1. Схема опыта
| № гр. |
Тип группы |
Препараты |
Путь введения |
Дозы и кратность применения |
Время назначения |
|
1 |
Опытные |
Ветом |
Внутрь |
мгкгр в день |
7 и 19 ч. |
|
2 |
8 и 20 ч. |
||||
|
3 |
9 и 21 ч. |
||||
|
4 |
12 и 22 ч. |
||||
|
5 |
14 и 22 ч. |
||||
|
6 |
Контроль |
Не применяли |
|||
Морфологические исследования крови включали определение уровня эритроцитов и лейкоцитов (меланжерным способом с использованием камеры Горяева), гемоглобина (по Сали), скорости оседания эритроцитов (по Панчекову). Лейкограмму определяли по И.А. Болотникову (1980). С целью изучения хронофармакологических особенностей ростостимулирующего действия ветома 3 определяли абсолютный, среднесуточный и относительный приросты живой массы.
Временную организацию действия ветома 3 на показатели крови и живой массы животных изучали с помощью графически-параметрического метода анализа биологических ритмов (Романов Ю.А., 1979) и определяли следующие параметры: мезор – среднее значение показателей (фазы) за промежуток времени; акрофазу – момент крайнего отклонения фазы; активную (пассивную) фазы – значения фазы, лежащие выше (ниже) мезора; абсолютную амплитуду – разность между максимальным и минимальным значениями фазы; относительную амплитуду – отношение максимального к минимальному значению фазы; коэффициент синхронизации – отношение относительной амплитуды к промежутку времени между максимальным и минимальным значениями фазы (Комаров Ф.И., Рапопорт С.И., 2000).
Обработку данных проводили методами вариационной статистики с использованием программы «PGN-1.4». Достоверность результатов определяли с помощью критерия Стьюдента.
В результате проведенных исследований установлено, что до применения ветома 3 количество эритроцитов, лейкоцитов у мышей опытных и контрольной групп не имело достоверных различий и находилось в пределах физиологических норм, а количество гемоглобина и лимфоцитов было ниже физиологической нормы.
На 6-е сутки исследований у мышей 1–5-й опытных групп уровень эритроцитов в крови превышал аналогичный показатель животных контрольной группы на 3,6 (P<0,1), 1,4, 5,3 (P<0,1), 6,9 (P<0,05), 0,1% соответственно. По сравнению с исходными данными количество эритроцитов у животных 1–5-й опытных и контрольной групп увеличилось на 3,1; 3,2; 4,7; 6,3; 4,1 и 1,7% соответственно.
В активной фазе влияния ветома 3 на уровень эритроцитов на 6-е сутки исследований находились показатели 1, 3 и 4-й опытных групп ((9,38±0,11) 1012/л; (9,53±0,21) 1012/л; (9,67±0,10) 1012/л), которые превышали мезор ((9,36±0,25) 1012/л) на 0,2; 1,8 и 3,3% соответственно, в пассивной фазе находились показатели 2-й и 5-й опытных групп ((9,18±0,17) 1012/л; (9,05±0,20) 1012/л), которые были ниже мезора на 1,9 и 3,2% соответственно. Акрофаза влияния ветома 3 на уровень эритроцитов в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня эритроцитов 4-й опытной группы.
На 15-е сутки исследований содержание эритроцитов в крови мышей 1–5-й опытных групп было выше по сравнению с контролем на 7,0 (P<0,1), 5,8; 9,5 (P<0,05), 11,9 (P<0,05); 3,4%, а по сравнению с исходными данными – на 3,9; 4,9; 6,3; 8,6; 4,9% соответственно. Тогда как у животных контрольной группы количество эритроцитов в единице объема крови уменьшилось по сравнению с исходными данными на 0,8%.
В активной фазе влияния ветома 3 на уровень эритроцитов на 15-е сутки исследований находились показатели 3-й и 4-й опытных групп ((9,67±0,21) 1012/л; (9,88±0,10) 1012/л), которые превышали мезор ((9,49±0,29) 1012/л) на 1,9 и 4,1% соответственно, в пассивной фазе находились показатели 1, 2 и 5-й опытных групп ((9,45±0,23) 1012/л; (9,34±0,12) 1012/л; (9,13±0,21) 1012/л), которые были ниже мезора на 0,4; 1,6 и 3,8% соответственно. Акрофаза влияния ветома 3 на уровень эритроцитов в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня эритроцитов 4-й опытной группы (рис. 1).
На 30-е сутки исследований уровень эритроцитов в крови мышей 1–5-й опытных групп был выше по сравнению с аналогами из контроля на 7,9; 9,1 (P<0,5); 11,1 (P<0,01); 15,2 (P<0,05); 4,2%, а по сравнению с исходными данными – на 4,7; 8,2; 7,8; 11,8; 5,8% соответственно. Количество эритроцитов в единице объема крови животных контрольной группы на 30-е сутки опыта было ниже по сравнению с исходными данными на 0,8%.
В активной фазе влияния ветома 3 на уровень эритроцитов на 30-е сутки исследований находились показатели 3-й и 4-й опытных групп ((9,81±0,16) 1012/л; (10,17±0,24) 1012/л), которые превышали мезор ((9,66±0,36) 1012/л) на 1,4 и 5,2% соответственно, в пассивной фазе находились показатели 1, 2 и 5-й опытных групп ((9,53±0,31) 1012/л; (9,63±0,12) 1012/л; (9,2±0,25) 1012/л), которые были ниже мезора на 1,4; 0,4 и 4,9% соответственно. Акрофаза влияния ветома 3 на уровень эритроцитов в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня эритроцитов 4-й опытной группы (рис. 1). У животных 3-й опытной группы так же отмечали резкое увеличение эритроцитов, близкое к показателям животных 4-й опытной группы.
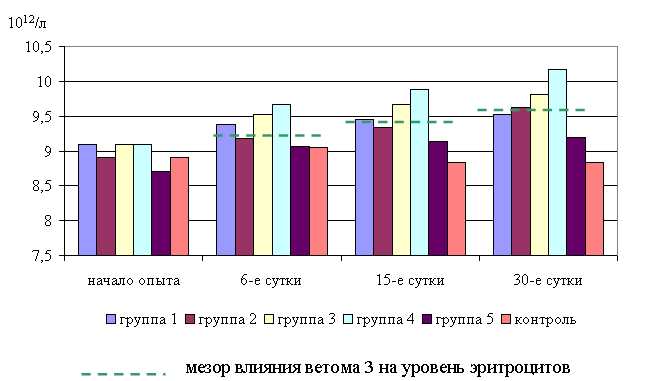
Рис. 1. Динамика уровня эритроцитов у мышей во время опыта
Таким образом, ветом 3 способствует повышению уровня эритроцитов в пределах физиологических норм в крови мышей опытных групп, причем действие ветома 3 на данный показатель находится в зависимости от времени введения препарата. Оптимальное увеличение отмечено при применении препарата в 12 и 22 ч.
Уровень гемоглобина в крови мышей также изменялся под влиянием ветома 3.
На 6-е сутки исследований у мышей 1–5-й опытных групп уровень гемоглобина в крови превышал аналогичный показатель животных контрольной группы на 1,5; 3,1 (P<0,1); 4,0 (P<0,1); 5,6 (P<0,05); 1,5%, а по сравнению с исходными данными – на 2,3; 3,9; 2,3; 5,6; 2,4% соответственно. У аналогов из контроля содержание гемоглобина в крови на 6-е сутки опыта по сравнению с исходными данными не изменилось.
В активной фазе влияния ветома 3 на уровень гемоглобина на 6-е сутки исследований находились показатели 3-й и 4-й опытных групп ((124,83±1,33) г/л; (126,67±1,67) г/л), которые превышали мезор ((124,37±2,43) г/л) на 0,9 и 2,3%, в пассивной фазе находились показатели 1, 2 и 5-й опытных групп ((121,83±0,83); (123,67±1,33); (121,83±2,67) г/л), которые были ниже мезора на 1,6, 0,1 и 1,6% соответственно. Акрофаза влияния ветома 3 на уровень гемоглобина в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня гемоглобина 4-й опытной группы.
Уровень гемоглобина в крови мышей 1–5-й опытных групп на 15-е сутки исследований был выше по сравнению с контролем на 4,1; 6,6 (P<0,1); 7,3 (P<0,05); 9,6 (P<0,05); 4,9%, а по сравнению с исходными данными – на 3,2; 5,7; 3,8; 7,8; 3,6% соответственно. Тогда как у животных контрольной группы уровень гемоглобина снизился на 1,7% по сравнению с исходными данными.
В активной фазе влияния ветома 3 на уровень гемоглобина на 15-е сутки исследований находились показатели 2, 3 и 4-й опытных групп ((125,83±1,67); (126,67±2,83); (129,33±0,83) г/л), которые превышали мезор ((125,7±2,54) г/л) на 0,1; 0,8 и 2,9%, в пассивной фазе находились показатели 1-й и 5-й опытных групп ((122,83±0,67); (123,83±1,33) г/л), которые были ниже мезора на 2,3 и 1,5% соответственно. Акрофаза влияния ветома 3 на уровень гемоглобина в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня гемоглобина 4-й опытной группы (рис. 2).
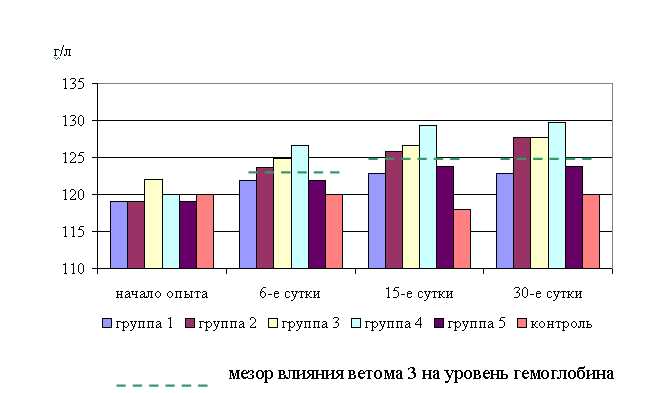
Рис. 2 Динамика уровня гемоглобина у мышей во время опыта
На 30-е сутки исследований у мышей 1–5-й опытных групп уровень гемоглобина в крови превышал аналогичный показатель животных контрольной группы на 2,4; 6,4 (P<0,05); 6,4 (P<0,05); 8,1 (P<0,01); 3,2%. По сравнению с исходными данными уровень гемоглобина у животных 1–5-й опытных и контрольной групп увеличился на 3,2; 7,3; 4,6; 8,1; 4,1 и 1,7% соответственно.
В активной фазе влияния ветома 3 на уровень гемоглобина на 30-е сутки исследований находились показатели 2, 3 и 4-й опытных групп ((127,67±1,33); (127,67±0,83); (129,67±0,83) г/л), которые превышали мезор ((126,33±2,88) г/л) на 1,1; 1,1 и 2,6%, в пассивной фазе находились показатели 1-й и 5-й опытных групп ((122,83±1,76); (123,83±1,67) г/л), которые были ниже мезора на 2,8 и 2,0% соответственно. Акрофаза влияния ветома 3 на уровень гемоглобина в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня гемоглобина 4-й опытной группы (рис. 3).
Таким образом, ветом 3 способствует повышению уровня гемоглобина в крови мышей опытных групп, причем действие ветома 3 на данный показатель находится в зависимости от времени введения препарата. Содержание гемоглобина в единице объема крови до начала исследований было ниже физиологической нормы, по окончанию опыта уровень гемоглобина повысился, практически достигнув физиологической нормы при применении ветома 3 в 12 и 22 ч. Акрофаза влияния препарата на уровень эритроцитов и гемоглобина приходится на одно время. Максимальное увеличение этих показателей регистрировали при назначении ветома 3 в 12 и 22 ч.
Под влиянием ветома 3 уровень лейкоцитов в крови мышей опытных групп также изменялся.
На 6-е сутки исследований у мышей 1–5-й опытных групп уровень лейкоцитов в крови превышал аналогичный показатель животных контрольной группы на 0,8; 4,2; 13,5 (P<0,05); 12,1 (P<0,05); 0,4% соответственно. Содержание лейкоцитов в крови животных 1–5-й опытных и контрольной групп увеличилось по сравнению с исходными данными на 9,7; 12,3; 11,3; 11,9; 7,1 и 0,8 % соответственно.
В активной фазе влияния ветома 3 на уровень лейкоцитов на 6-е сутки исследований находились показатели 3-й и 4-й опытных групп ((12,35±0,45) 109/л; (12,2±0,33) 109/л), которые превышали мезор ((11,56±0,68) 109/л) на 6,8 и 5,5 % соответственно, в пассивной фазе находились показатели 1, 2 и 5-й опытных групп ((10,97±0,35) 109/л; (11,34±0,67) 109/л; (10,92±0,39) 109/л), которые были ниже мезора на 5,1; 1,9 и 5,5% соответственно. Акрофаза влияния ветома 3 на уровень лейкоцитов в крови мышей опытных групп приходилась на 9 и 21 ч, что соответствует показателям уровня лейкоцитов 3-й опытной группы.
На 15-е сутки количество лейкоцитов в единице объема крови мышей 1–5-й опытных групп было выше по сравнению с контролем на 3,2; 5,9; 14,4; 14,8; 1,3%, а по сравнению с исходными данными – на 11,5; 13,3 (P<0,05); 11,3 (P<0,1); 13,8 (P<0,05); 7,3% соответственно. Тогда как у животных контрольной группы содержание лейкоцитов по сравнению с исходными данными не изменилось.
В активной фазе влияния ветома 3 на уровень лейкоцитов на 15-е сутки исследований находились показатели 3-й и 4-й опытных групп ((12,35±0,69) 109/л; (12,4±0,73) 109/л), которые превышали мезор ((11,66±0,68) 109/л) на 5,9 и 6,3% соответственно, в пассивной фазе находились показатели 1, 2 и 5-й опытных групп ((11,15±0,37) 109/л; (11,44±1,03) 109/л; (10,94±0,12) 109/л), которые были ниже мезора на 4,5; 1,4 и 6,3% соответственно. Акрофаза влияния ветома 3 на уровень лейкоцитов в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня лейкоцитов 4-й опытной группы (рис. 3).
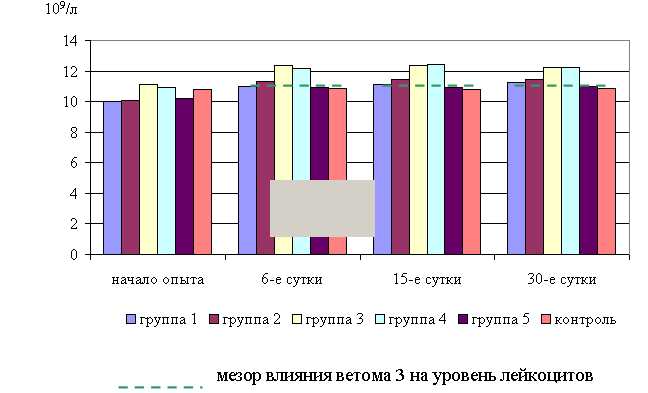
Рис. 3 Динамика уровня лейкоцитов у мышей во время опыта
На 30-е сутки исследований у мышей 1–5-й опытных групп уровень лейкоцитов в крови превышал аналогичный показатель животных контрольной группы на 3,2; 5,3; 12,5 (P<0,05); 12,5 (P<0,05); 0,7 % соответственно. По сравнению с исходными данными количество лейкоцитов у животных 1–5-й опытных и контрольной групп увеличилось на 12,4; 13,6; 10,4; 12,4; 7,5; 0,9 % соответственно.
В активной фазе влияния ветома 3 на уровень лейкоцитов на 30-е сутки исследований находились показатели 3-й и 4-й опытных групп ((12,25±1,12) 109/л; (12,25±0,67) 109/л), которые превышали мезор ((11,64±0,69) 109/л) на 5,2 %, в пассивной фазе находились показатели 1, 2 и 5-й опытных групп ((11,24±0,56) 109/л; (11,47±0,67) 109/л; (10,97±0,84) 109/л), которые были ниже мезора на 3,5; 0,7; 5,8 % соответственно. Акрофаза влияния ветома 3 на уровень лейкоцитов в крови мышей опытных групп приходилась на период с 9 до 12 и с 21 до 22 ч, что соответствует показателям уровня лейкоцитов 3 и 4-й опытных групп (рис. 2).
Таким образом, ветом 3 способствует повышению уровня лейкоцитов в крови мышей опытных групп до верхних пределов физиологической нормы, причем действие ветома 3 на данный показатель находится в зависимости от времени введения препарата. Оптимальное увеличение отмечено при применении препарата в 9 и 21, и 12 и 22 ч. Следовательно, на основании результатов наших исследований, можно делать вывод о том, что ветом 3 активизирует эритро- и лейкопоэз в пределах физиологической нормы. Оптимальные результаты получены при назначении препарата с 9 до 12 и с 21 до 22 ч.
Скорость оседания эритроцитов у мышей опытных и контрольной групп до начала исследований достоверно не отличалась и составляла в среднем 3,5-4,0 мм/ч. На 6-е сутки исследований, данный показатель снизился в опытных группах и составил в среднем 2,5-3,0 мм/ч, тогда как в контрольной группе скорость оседания эритроцитов оставалась на уровне 4,0 мм/ч. На 15 и 30-е сутки исследований тенденция по снижению скорости оседания эритроцитов у мышей опытных групп сохранилась.
Анализ лейкограммы свидетельствует о наличии зависимости влияния ветома 3 на видовой состав лейкоцитов крови телят от временного фактора.
Уровень лимфоцитов до применения препарата был ниже физиологической нормы (табл. 3).
Таблица 3. Лейкоцитарный профиль мышей до применения препарата, %
|
Показатель |
Опытные группы |
Контроль | ||||
| 1-я | 2-я | 3-я | 4-я | 5-я | ||
| Э | 1,0±0,58 | 0,7±0,67 | 1,3±0,33 | 1,0±0,58 | 0,7±0,33 | 0,7±0,67 |
| Б | 0 | 0 | 0 | 0 | 0 | 0 |
| Ю | 2,3±0,33 | 2,3±0,67 | 3,0±0,58 | 2,3±0,33 | 2,3±0,33 | 3,0±0,58 |
| П | 5,3±0,33 | 6,0±0,58 | 6,0±1,0 | 5,7±0,33 | 6,0±0,58 | 6,6±0,88 |
| С | 28,0±1,15 | 29,3±1,2 | 27,3±1,86 | 27,3±2,4 | 27,0±2,31 | 27,0±1,0 |
| Л | 59,7±2,03 | 58,0±1,76 | 59,3±2,60 | 58,7±8,65 | 59,7±1,33 | 58,7±3,53 |
| М | 3,7±1,20 | 3,7±0,67 | 3,1±0,58 | 5,0±1,0 | 4,3±1,86 | 4,0±0,58 |
Примечание: здесь и далее Э – эозинофилы, Б – базофилы, Ю, П, С – юные, палочкоядерные и сегментоядерные нейтрофилы, Л – лимфоциты, М – моноциты.
На 6-е сутки исследований процентное содержание лимфоцитов у мышей 1–5 опытных групп было выше по сравнению с аналогичным показателем животных из контроля на 8,7 (P<0,05); 5,4; 5,4; 6,3; 6,1 %, а по сравнению с исходными данными – на 4,4; 4,1; 1,9; 3,7; 1,8 % соответственно, тогда как у мышей контрольной группы уровень лимфоцитов снизился по сравнению с исходными данными на 2,4 % (табл. 4).
В активной фазе влияния ветома 3 на уровень лимфоцитов на 6-е сутки исследований находились показатели 1-й опытной группы, которые превышали мезор (60,96 %) на 2,2 %, в пассивной фазе находились показатели 2–5-й опытных групп, которые были ниже мезора на 0,9; 0,9; 0,1; 0,3 % соответственно. Акрофаза влияния ветома 3 на уровень лимфоцитов в крови мышей опытных групп приходилась на 7 и 19 ч, что соответствует показателям уровня лимфоцитов 1-й опытной группы.
Таблица 4. Лейкоцитарный профиль мышей на 6-е сутки исследований, %
| Показатель |
Опытные группы |
Контроль | ||||
| 1-я | 2-я | 3-я | 4-я | 5-я | ||
| Э |
0 |
0 |
1,3±0,88 Cv=114,56 |
0 |
0 |
0 |
| Б |
0 |
0 |
0 |
0 |
0 |
0 |
| Ю |
3,3±0,33 Cv=17,32 |
4,3±0,67 Cv=26,65 |
4,7±1,33 Cv=86,6 |
4,3±0,67 Cv=26,65 |
3,3±0,33 Cv=17,32 |
3,0±0,58 Cv=50,0 |
| П |
6,0±0,58 Cv=16,67 |
6,3±0,33 Cv=9,12 |
6,0±1,15 Cv=40,0 |
6,0±0,58 Cv=16,67 |
5,7±0,67* Cv=20,38 |
7,6±0,58 Cv=14,29 |
| С |
24,7±2,40 Cv=16,88 |
25,0±1,0 Cv=6,93 |
24,6±6,74 Cv=69,37 |
24,5±1,15 Cv=9,09 |
25,7±0,33 Cv=2,25 |
26,4±0,67 Cv=4,88 |
| Л |
62,3±1,76** Cv=4,90 |
60,4±1,67 Cv=4,84 |
60,4±11,92 Cv=44,25 |
60,9±2,08 Cv=5,72 |
60,8±2,03 Cv=6,02 |
57,3±0,33 Cv=0,96 |
| М |
3,7±0,88 Cv=45,83 |
4,0±0*** Cv=0 |
3,0±1,04* Cv=65,83 |
4,3±0,88 Cv=35,25 |
4,5±1,33 Cv=40,75 |
5,7±0,33 Cv=10,19 |
Примечание: здесь и далее * - P<0,1, ** - P<0,05, *** - P<0,01
На 15-е сутки исследований уровень лимфоцитов у мышей 1–5-й опытных групп был выше по сравнению с контролем на 9,2; 9,8; 10,3; 14,6; 8,5 %, а по сравнению с исходными данными – на 1,2; 4,7; 2,9; 8,0; 0,5 % соответственно. У аналогов из контроля данный показатель снизился по сравнению с исходными данными на 5,8 % (табл. 5). В активной фазе влияния ветома 3 на уровень лимфоцитов на 15-е сутки исследований находились показатели 4-й опытной группы, которые превышали мезор (61,1 %) на 3,8 %, в пассивной фазе находились показатели 1, 2, 3 и 5-й опытных групп, которые были ниже мезора на 1,1; 0,7; 1,1; 1,9 % соответственно. Акрофаза влияния ветома 3 на уровень лимфоцитов в крови мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям уровня лимфоцитов 4-й опытной группы.
На 30-е сутки исследований уровень лимфоцитов у мышей 1–5-й опытных групп был выше по сравнению с контролем на 7,0; 5,4; 10,1; 10,1; 10,6 % соответственно. По сравнению с исходными данными процентное содержание лимфоцитов увеличилось у животных 2, 3, 4 и 5-й групп на 1,2; 3,4; 4,4; 3,2 %, тогда как у мышей 1-й и контрольной группы – снизилось на 0,2 и 5,1 % соответственно (табл. 6)..
Таблица 5. Лейкоцитарный профиль мышей на 15-е сутки исследований, %
| Показатель | Опытные группы | Контроль | ||||
|
1-я |
2-я |
3-я |
4-я |
5-я |
||
| Э |
0 |
0 |
0,7±0,33 Cv=86,6 |
0 |
1,0±0,58 Cv=100,0 |
0 |
| Б |
0 |
0 |
0 |
0 |
0 |
0 |
| Ю |
3,3±0,33 Cv=17,32 |
3,3±0,67 Cv=34,64 |
2,3±0,67 Cv=49,49 |
4,3±0,33 Cv=13,32 |
3,7±0,88 Cv=41,66 |
3,0±0,58 Cv=100,0 |
| П |
6,5±0,58 Cv=14,29 |
6,3±0,33 Cv=9,12 |
6,7±0,33 Cv=8,66 |
6,7±0,33 Cv=8,66 |
6,3±0,88 Cv=24,12 |
5,9±0,33 Cv=15,75 |
| С |
26,3±1,45 Cv=9,56 |
26,7±0,88 Cv=5,73 |
25,7±2,33 Cv=15,75 |
22,3±1,45** Cv=11,27 |
25,3±0,67** Cv=4,22 |
29,7±1,2 Cv=7,52 |
| Л |
60,4±1,33 Cv=3,83 |
60,7±1,53 Cv=4,41 |
61,0±4,04 Cv=11,48 |
63,4±0,88 Cv=2,41 |
60,0±1,53 Cv=4,56 |
55,3±8,69 Cv=27,19 |
| М |
3,5±1,0 Cv=57,74 |
3,0±0,58 Cv=33,33 |
3,6±1,2 Cv=56,77 |
3,3±0,33 Cv=17,32 |
3,7±0,88 Cv=41,66 |
6,1±1,53 Cv=52,92 |
Таблица 6. Лейкоцитарный профиль мышей на 30-е сутки исследований, %
| Показатель |
Опытные группы |
Контроль |
||||
|
1-я |
2-я |
3-я |
4-я |
5-я |
||
|
Э |
0 |
0 |
0 |
0 |
0 |
0,7±0,33 Cv=86,6 |
|
Б |
0 |
0 |
0 |
0 |
0 |
0 |
|
Ю |
3,7±0,67 Cv=31,49 |
4,0±0,58* Cv=25,0 |
2,7±0,33 Cv=21,65 |
4,3±0,33* Cv=13,32 |
2,3±0,67 Cv=49,49 |
1,7±0,88 Cv=91,65 |
|
П |
7,3±0,88 Cv=20,83 |
7,3±0,67 Cv=15,75 |
6,3±0,67 Cv=18,23 |
5,7±0,33 Cv=7,53 |
5,7±0,33 Cv=10,19 |
5,0±1,53 Cv=52,92 |
|
С |
25,7±0,67** Cv=4,50 |
26,3±1,45 Cv=9,56 |
26,7±0,67 Cv=4,75 |
24,7±2,85 Cv=22,09 |
26,7±2,33 Cv=15,16 |
29,6±1,2 Cv=7,10 |
|
Л |
59,6±1,76 Cv=5,24 |
58,7±1,2 Cv=3,55 |
61,3±7,69 Cv=24,97 |
61,3±4,26 Cv=12,02 |
61,6±1,2 Cv=3,38 |
55,7±3,38 Cv=10,53 |
|
М |
3,7±0,88** Cv=32,73 |
3,7±1,2* Cv=56,77 |
3,0±1,0** Cv=34,64 |
4,0±1,0* Cv=43,3 |
3,7±1,73 Cv=60,0 |
7,3±0,88 Cv=20,83 |
В активной фазе влияния ветома 3 на уровень лимфоцитов на 30-е сутки исследований находились показатели 3, 4 и 5-й опытной группы, которые превышали мезор (60,5 %) на 1,3; 1,3; 1,8 %, в пассивной фазе находились показатели 1-й и 2-й опытных групп, которые были ниже мезора на 1,5 и 3,0 % соответственно. Акрофаза влияния ветома 3 на уровень лимфоцитов в крови мышей опытных групп приходилась на 14 и 22 ч, что соответствует показателям уровня лимфоцитов 5-й опытной группы.
Таким образом, ветом 3 повышал уровень лимфоцитов мышей опытных групп до границ физиологических норм, однако, анализ влияния циркадианных ритмов действия ветома 3 на уровень лимфоцитов не позволяет сделать однозначных выводов.
Уровень моноцитов у мышей всех групп до применения препарата находился в пределах физиологических норм (табл. 3).
На 6-е сутки исследований процентное содержание моноцитов у мышей 1–5 опытных групп было ниже по сравнению с аналогичным показателем животных из контроля на 35,1; 29,8 (P<0,01); 47,4 (P<0,1); 24,6; 21,1 % соответственно. По сравнению с исходными данными уровень моноцитов у мышей 3-й и 4-й опытных групп снизился на 3,2; 14,0 %, у животных 2-й и 5-й опытных групп – увеличился на 8,1; 4,7 %, а у аналогов из 1-й опытной группы – остался без изменений. У мышей контрольной группы содержание моноцитов на 6-е сутки опыта было выше границ физиологической нормы, увеличившись по сравнению с исходными данными на 42,5 %. Анализ хронобиологических особенностей влияния ветома 3 на уровень моноцитов на 6-е сутки опыта не позволяет сделать однозначных выводов (табл. 4).
Процентное содержание моноцитов в крови мышей 1–5 опытных групп на 15-е сутки исследований было ниже по сравнению с аналогичным показателем животных из контроля на 42,6; 50,8; 41,0; 45,9; 39,3 % соответственно. По сравнению с исходными данными уровень моноцитов у мышей 1, 2, 4 и 5-й опытных групп снизился на 5,4; 18,9; 34,0 и 14,0 %, а у животных 2-й опытной группы – увеличился на 16,1 %. У мышей контрольной группы содержание моноцитов на 15-е сутки опыта было выше границ физиологической нормы и возросло по сравнению с исходными данными на 52,5 %. Анализ хронобиологических особенностей влияния ветома 3 на уровень моноцитов на 15-е сутки опыта не позволяет сделать однозначных выводов (табл. 5)..
На 30-е сутки исследований процентное содержание моноцитов у мышей 1–5 опытных групп было достоверно ниже по сравнению с аналогичным показателем животных из контроля на 49,3 (P<0,05); 49,3 (P<0,1); 59,0 (P<0,05); 45,2 (P<0,1); 49,3 % соответственно. По сравнению с исходными данными уровень моноцитов у мышей 3, 4 и 5-й опытных групп снизился на 3,2; 20,0; 14,0 %, а у животных 1-й и 2-й опытных групп – остался без изменений. У мышей контрольной группы содержание моноцитов на 30-е сутки опыта было значительно выше границ физиологической нормы и увеличилось по сравнению с исходными данными на 82,5 %. Анализ хронобиологических особенностей влияния ветома 3 на уровень моноцитов на 30-е сутки опыта не позволяет сделать однозначных выводов (табл. 6).
Таким образом, у мышей опытных групп содержание моноцитов за весь период опыта оставалось в пределах физиологических норм, тогда как у животных контрольной группы – значительно превышало последние. Анализ влияния циркадианных ритмов действия ветома 3 на уровень моноцитов не позволяет сделать однозначных выводов.
Уровень нейтрофилов у мышей всех групп до применения препарата находился в пределах физиологических норм (табл. 3).
На 6-е сутки исследований у мышей 1–5 опытных групп по отношению к аналогам из контроля процентное содержание сегментоядерных форм нейтрофилов было ниже на 6,4; 5,3; 6,8; 7,2; 2,7 %, палочкоядерных форм – ниже на 21,1; 17,1; 21,1; 21,1; 25,0 (P<0,1) %, юных форм – выше на 10,0; 43,3; 56,7; 43,3; 10,0 % соответственно. По сравнению с исходными данными уровень сегментоядерных форм нейтрофилов у мышей 1–5-й опытных и контрольной групп снизился на 11,8; 14,7 (P<0,1); 9,9; 10,3; 4,8 и 2,2 % соответственно. Содержание палочкоядерных форм нейтрофилов по сравнению с исходными данными у животных 1, 2 и 4-й опытных групп увеличилось на 13,2; 5,0 и 0,2 %, тогда как у мышей 3-й опытной группы – не изменилось, а у животных 5-й опытной и контрольной групп – уменьшилось на 5,0 и 13,2 % соответственно. Уровень юных форм нейтрофилов по сравнению с исходными данными у мышей 1–5-й опытных групп был выше на 43,5 (P<0,1); 86,9; 56,7; 86,9 (P<0,1); 43,5 (P<0,1) % соответственно, тогда как у аналогов из контроля данный показатель не изменился (табл. 4).
Необходимо отметить, что на 6-е сутки опыта уровень палочкоядерных нейтрофилов был выше границы физиологической нормы, остальные показатели находились в пределах физиологической нормы. Анализ хронобиологических особенностей влияния ветома 3 на уровень нейтрофилов на 6-е сутки опыта не позволяет сделать однозначных выводов.
На 15-е сутки исследований у мышей 1–5 опытных групп по отношению к аналогам из контроля процентное содержание сегментоядерных нейтрофилов было ниже на 11,4; 10,1; 13,5; 24,9 (P<0,05); 14,8% (P<0,05), палочкоядерных – выше на 10,2; 6,8; 13,6; 13,6; 6,8 % соответственно. Уровень юных нейтрофилов по сравнению с аналогами из контроля у мышей 1, 2, 4 и 5-й опытных групп был выше на 10,0; 10,0; 43,3; 23,3 % соответственно, тогда как у животных 3-й опытной группы – ниже на 23,3 %. По сравнению с исходными данными уровень сегментоядерных нейтрофилов у мышей 1–5-й опытных групп снизился на 6,1; 8,9; 5,9; 18,3; 6,3 % соответственно, тогда как у аналогов из контроля – увеличился на 10,0 %. Содержание палочкоядерных нейтрофилов по сравнению с исходными данными у животных 1–5-й опытных и контрольной групп увеличилось на 22,6; 5,0; 11,7; 17,5 (P<0,1); 5,0; 10,6 % соответственно. Уровень юных нейтрофилов по сравнению с исходными данными у мышей 1, 2, 4 и 5-й опытных групп был выше на 43,5 (P<0,1); 43,5; 89,6 (P<0,05) и 60,9 % соответственно, тогда как у животных 3-й опытной группы – ниже на 23,3 %, а у аналогов из контроля – не изменился.
Необходимо отметить, что на 15-е сутки исследований уровень сегментоядерных нейтрофилов у мышей контрольной группы находился на верхней границе нормы, а содержание юных и палочкоядерных форм – в пределах физиологической нормы. Анализ хронобиологических особенностей влияния ветома 3 на уровень нейтрофилов на 15-е сутки опыта не позволяет сделать однозначных выводов (табл. 5).
На 30-е сутки исследований у мышей 1–5 опытных групп по отношению к аналогам из контроля процентное содержание сегментоядерных нейтрофилов было ниже на 13,2 (P<0,05); 11,1; 9,8; 16,6; 9,8 %, палочкоядерных – выше на 46,0; 46,0; 26,0; 14,0; 14,0 %, юных форм – выше в 2,2; 2,3 (P<0,1); 1,6; 2,5 (P<0,1); 1,4 раза соответственно. По сравнению с исходными данными уровень сегментоядерных нейтрофилов у мышей 1–5-й опытных групп снизился на 8,2; 10,2; 2,2; 9,5;, 1,1 % соответственно, тогда как у аналогов из контроля – увеличился на 9,6 %. Содержание палочкоядерных нейтрофилов по сравнению с исходными данными у животных 1, 2 и 3-й опытных групп увеличилось на 37,7; 21,6 и 5,0 %, тогда как у мышей 4-й опытной группы – не изменилось, а у животных 5-й опытной и контрольной групп – уменьшилось на 5,0 и 24,2 % соответственно. Уровень юных нейтрофилов по сравнению с исходными данными у мышей 1, 2 и 4-й опытных групп был выше на 60,9; 73,9; 86,9 (P<0,05) %, тогда как у животных 5-й опытной группы – не изменился, а у аналогов из 3-й опытной и контрольной групп – был ниже на 10,0 и 43,3 % соответственно.
Необходимо отметить, что на 30-е сутки исследований уровень сегментоядерных нейтрофилов у мышей контрольной группы находился на верхней границе нормы, количество юных и палочкоядерных нейтрофилов – в пределах физиологической нормы. Анализ хронобиологических особенностей влияния ветома 3 на уровень нейтрофилов на 30-е сутки опыта не позволяет сделать однозначных выводов (табл. 6).
Таким образом, у мышей опытных групп содержание нейтрофилов за весь период опыта оставалось в пределах физиологических норм, тогда как у животных контрольной группы – уровень палочкоядерных нейтрофилов на 6-е сутки исследований превышал пределы нормы, а уровень сегментоядерных нейтрофилов на 15-е и 30-е сутки опыта находился на верхней границе физиологической нормы. Ветом 3 стимулировал нейтрофилопоэз юных нейтрофилов. Анализ влияния циркадианных ритмов действия ветома 3 на уровень нейтрофилов не позволяет сделать однозначных выводов.
Уровень эозинофилов у мышей всех групп во время опыта снизился. Так, если перед началом опыта эозинофильные клетки были обнаружены у мышей всех групп, то на 6-е сут. исследований эозинофилы были отмечены только у животных 3-й опытной группы (1,3±0,88) %, на 15-е сут. – у мышей 3 и 5-й опытных групп ((0,7±0,33) и (1,0±0,58) % соответственно), а на 30-е сут. – у мышей из контроля (0,7±0,33) %. При проведении исследований базофилов в мазках крови обнаружено не было (табл. 3-6).
Таким образом, полученные результаты свидетельствуют о позитивном влиянии ветома 3 на эритро- и лейкопоэз, в т. ч. лимфоцитопоэз и нейтрофилопоэз у мышей опытных групп в пределах физиологических норм, как во время применения препарата, так и в период его последействия. Выраженность данного влияния зависела от биоритмологической организации физиологических функций мышей. Оптимальные влияние ветома 3 на эритропоэз отмечено при применении препарата в 12 и 22 ч, при этом показатели содержания эритроцитов и гемоглобина на 6, 15 и 30-е сутки исследований превышали мезор на 2,3 и 3,3; 2,9 и 4,1; 2,6 и 5,2 % соответственно. Максимальное увеличение уровня лейкоцитов отмечено при применении ветома 3 в 9 и 21, и 12 и 22 ч, при этом показатели содержания лейкоцитов на 6, 15 и 30-е сутки превышали мезор на 6,8 и 5,5; 5,8 и 6,3; 5,2 и 5,2% соответственно.
Таким образом, действие ветома 3 на организм белых находится в зависимости от времени применения препарата. Полученные результаты согласуется с мнением ряда авторов о том, что действие любого лекарственного вещества на организм, равно как и восприимчивость фармакологического воздействия структурными единицами индивидуума, зависят от биоритмологической структуры живого организма, в частности ритмов активности его клеток, органов и систем (Зидермане А.А., 1988; Арушанян Э.Б., 1998; Комаров Ф.И., Рапопорт С.И., 2000).
У подопытных мышей до применения препарата изучаемые гематологические показатели были в пределах нормы.
По окончании опыта у мышей, получавших пробиотик, в крови увеличивалось количество, эритроцитов, лейкоцитов и гемоглобина по сравнению с контролем. Оптимальные результаты получены при применении ветома 3 в 12 и 22 ч. Так, мыши, получавшие препарат в указанное время, превышали мезор по содержанию эритроцитов – на 3,3, 4,1 и 5,2 %, лейкоцитов – на 6,9, 11,9 и 15,2 %, гемоглобина – на 2,3, 2,9 и 2,6 % на 6, 15 и 30-е сутки соответственно.
Оптимальное увеличение гематологических показателей крови и живой массы мышей при применении ветома 3 в 12 и 22 ч, по-видимому, связаны с низкой активностью энергетического обмена в эпителии структурно-функциональной единицы тонкой кишки «крипта-ворсинка» в эти временные рамки (Романов Ю.А. и соавт., 1981, Комаров Ф.И., Рапопорт С.И., 2000), что согласно закону J. Wilder (1962), по которому та или иная функция тем слабее стимулируется и легче угнетается, чем исходно она сильнее активирована, является обязательным условием применения лекарственных средств для стимуляции тех или иных показателей у здоровых животных при биоритмологическом подходе. Кроме того, по данным Р.М. Заславской (1996), Ф.И. Комарова, С.И. Рапопорта (2000) при профилактическом применении лекарств максимальный фармакологический эффект совпадает с акрофазой показателей.
Хронобиологические особенности ростостимулирующего действия ветома 3 на здоровых мышей
Живой организм – единое целое, живущее по принципам саморегуляции. Любое воздействие извне может нарушать внутреннюю регуляцию организма, обуславливая уменьшение или полное блокирование компенсаторных реакций, механизмов адаптации, неполный или некачественный фармакологический ответ на лечебные или профилактические мероприятия, что в конечном итоге приводит к развитию патологических реакций.
Животные постоянно подвергаются воздействию неблагоприятных факторов внешней среды, что способствует возникновению массовых заболеваний, особенно у молодняка (Иванова А.Б., 2002), а также снижению скорости роста, что, безусловно, сказывается на экономических показателях сельскохозяйственного производства.
Нами были проведены научно-производственные опыты по изучению хронофармакологических особенностей ростостимулирующего действия пробиотического препарата.
Нами установлено, что ветом 3 обладает выраженным ростостимулирующим действием на организм белых мышей. Однако выраженность эффекта зависела от времени введения препарата.
На 6-е сутки исследований живая масса мышей 1, 3, 4 и 5-й опытных групп была выше по сравнению с аналогами из контроля на 3,68; 3,68; 8,95; 8,95 %, среднесуточный прирост и скорость роста – в 2,4; 2,4; 4,4; 4,4 раза соответственно. Тогда как у животных 2-й опытной группы по сравнению с контролем живая масса была ниже на 1,5 %, среднесуточный прирост живой массы – на 60,0 %. По сравнению с исходными данными живая масса мышей 1–5-й опытных и контрольной групп увеличилась на 6,49; 1,08; 6,49; 11,89; 11,89 и 2,7 % соответственно (табл. 7-9).
Живая масса мышей 1–5-й опытных групп на 15-е сутки исследований была выше по сравнению с аналогами из контроля на 3,0; 3,0; 5,1; 11,7; 10,2% соответственно. По сравнению с исходными данными живая масса мышей 1–5-й опытных и контрольной групп увеличилась на 9,7; 9,7; 11,9; 18,9; 17,3 и 6,5 % соответственно (табл. 7).
Таблица 7. Динамика живой массы мышей опытных групп, г
| Группа |
Исходные данные |
6-е сутки |
15-е сутки |
30-е сутки |
|
1-я опытная |
18,5±0,29 Cv=2,7 |
19,7±0,33 Cv=2,94 |
20,3±0,33 Cv=2,84 |
20,7±0,33 Cv=2,79 |
|
2-я опытная |
18,5±0,29 Cv=2,7 |
18,7±0,67 Cv=6,49 |
20,3±0,33 Cv=2,84 |
21,3±1,2 Cv=9,76 |
|
3-я опытная |
18,5±0,29 Cv=2,7 |
19,7±0,88 Cv=7,77 |
20,7±0,67 Cv=5,59 |
21,3±0,33* Cv=2,71 |
|
4-я опытная |
18,5±0,29 Cv=2,7 |
20,7±0,88 Cv=7,39 |
22,0±1,15 Cv=9,09 |
22,7±0,88* Cv=6,74 |
|
5-я опытная |
18,5±0,29 Cv=2,7 |
20,7±0,88 Cv=7,39 |
21,7±0,88 Cv=7,05 |
21,8±1,2 Cv=9,61 |
|
Контрольная |
18,5±0,29 Cv=2,7 |
19,0±0,58 Cv=5,26 |
19,7±0,33 Cv=2,94 |
20,3±0,33 Cv=2,84 |
Среднесуточный прирост и скорость роста у животных 2, 3, 4 и 5-й опытных групп на 15-е сутки исследований были выше по сравнению с контролем в 2,3; 1,4; 1,8; 1,4 раза соответственно, тогда как у мышей 1-й опытной группы данные показатели были ниже аналогов из контроля на 14,1 %. (табл. 8-9).
Таблица 8. Динамика среднесуточных приростов мышей опытных групп, г
| Группа |
6-е сутки |
15-е сутки |
30-е сутки |
За опытный период |
|
1-я опытная |
0,240±0,003 |
0,067±0,033 |
0,027±0,007 |
0,111±0,086 |
|
2-я опытная |
0,040±0,007 |
0,178±0,083 |
0,067±0,003 |
0,095±0,055 |
|
3-я опытная |
0,240±0,033 |
0,111±0,033 |
0,040±0,007 |
0,130±0,073 |
|
4-я опытная |
0,440±0,133 |
0,144±0,033 |
0,047±0,007 |
0,210±0,153 |
|
5-я опытная |
0,440±0,167 |
0,111±0,003 |
0,007±0,001 |
0,186±0,169 |
|
Контрольная |
0,100±0,133 |
0,078±0,007 |
0,040±0,003 |
0,073±0,022 |
Таблица 9. Динамика скорости роста мышей опытных групп, %
| Группа |
6-е сутки |
15-е сутки |
30-е сутки |
За опытный период |
|
1-я опытная |
6,28±0,67 |
3,0±0,67 |
1,95±0,67 |
3,74±1,69 |
|
2-я опытная |
1,08±0,83 |
8,21±0,83 |
4,81±0,33 |
4,7±2,41 |
|
3-я опытная |
6,28±1,33 |
4,95±0,67 |
2,86±0,33 |
4,7±1,23 |
|
4-я опытная |
11,22±0,67 |
6,09±0,83 |
3,13±0,67 |
6,82±2,94 |
|
5-я опытная |
11,22±0,83 |
4,72±0,33 |
0,46±0,67 |
5,47±3,84 |
|
Контрольная |
2,67±0,83 |
3,62±0,67 |
3,0±0,33 |
3,09±0,35 |
На 30-е сутки исследований живая масса мышей 1–5-й опытных групп была выше по сравнению с аналогами из контроля на 2,0; 5,0; 5,0 (P<0,1); 11,8 (P<0,1); 7,4 % соответственно. По сравнению с исходными данными живая масса мышей 1–5-й опытных и контрольной групп увеличилась на 11,9; 15,1; 15,1; 22,7; 17,8 и 9,7 % соответственно (табл. 7). Среднесуточный прирост и скорость роста у животных 2 и 4-й опытных групп на 30-е сутки исследований были выше по сравнению с контролем на 67,5 и 17,5 %, у мышей 1 и 5-й опытных групп – ниже на 32,5 и 82,5 %, а у аналогов из 3-й опытной группы – на уровне мышей из контроля (табл. 8-9).
В активной фазе влияния ветома 3 на скорость роста мышей опытных групп за весь период исследований находились показатели 4 и 5-й опытных групп, которые превышали мезор (5,08±0,85%) на 34,3 и 7,7 % соответственно, в пассивной фазе находились показатели 1, 2 и 3-й опытных групп, которые были ниже мезора на 26,4, 7,5 и 7,5 % соответственно. Акрофаза влияния ветома 3 на скорость роста мышей опытных групп приходилась на 12 и 22 ч, что соответствует показателям скорости роста мышей 4-й опытной группы (рис. 4).
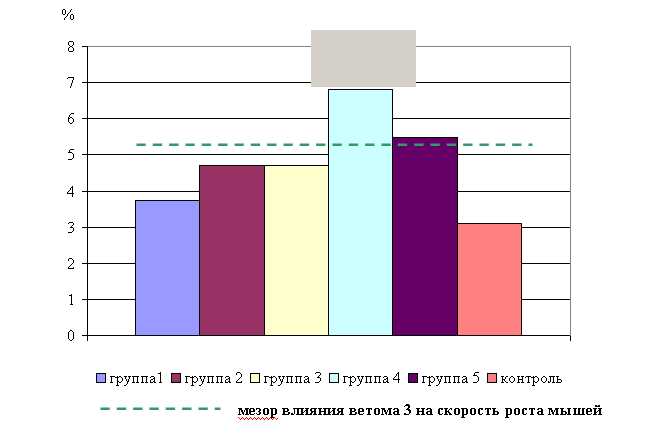
Рис. 4. Скорость роста мышей опытных групп
Таким образом, ветом 3 обладает выраженным ростостимулирующим действием на организм мышей, как при применении препарата, так и в период его последействия.
При изучении ростостимулирующего действия ветома 3 на организм белых мышей установлено выраженное влияние препарата на интенсивность роста, зависящее от биоритмологической организации физиологических функций организма. Так, у животных, получавших пробиотик в 12 и 22 часа среднесуточный прирост живой массы мышей за опытный период был выше мезора на 34,4 %. Полученные результаты согласуются с данными ряда авторов о позитивном влиянии ветома 3 на динамику привесов живой массы животных (Ноздрин Г.А. и соавт, 1997, 2001, 2003, Ноздрин А.Г., 2003).
А.И. Шевченко (2003) указывает на сохранение тенденции по увеличению живой массы цыплят спустя 20 и 40 дней по истечении введения ветома 1.1, что согласуется с полученными нами результатами о том, что после завершения введения препарата, у мышей, получавших ветом 3 в 12 и 22 ч, отмечалась наибольшая скорость роста.
Литература
1. Авербах М.М. О ритмических процессах в клинике, эпидемиологии и иммунологии туберкулеза / М.М. Авербах, В.Р. Левин // Тез. всесоюзн. симп. «Биологические ритмы в механизмах компенсации нарушенных функций» – М., 1973. – С. 245-255.
2. Акляринский Б.С. Биологические ритмы и организация жизни человека в космосе / Б.С. Алякринский // Пробл. космической биологии. – М.: Наука, 1983. – Т.46. – С. 238.
3. Акляринский Б.С. Этапы эволюции десинхроза / Б.С. Алякринский // Материалы 4-й Всесоюзн. конф. по экологической физиологии «Морфофизиологические и биохимические механизмы адаптации животных к факторам среды» - Краснодар, 1972. – С. 17-18.
4. Алпатов А.М. Расщепление циркадного ритма температуры тела у обезьян в условиях артиоортостатической гипокинезии / А.М. Алпатов, В.Я. Климовицкий // Космич. биол. и авиакосимч. медицина. – 1986. - №5. – С. 37-41.
5. Алпатов А.М. Циркадные ритмы человека и режим труда-отдыха: гипотеза сжатой пружины / А.М. Алпатов // Изв. РАН, сер. биол. – 1993. – № 6. – С. 810-822.
6. Альбинская Л.И. Хронофармакология и артериальная гипертензия / Л.И. Альбинская, Б.А. Хапаев // ТОП-Медицина. – 1995. - №4. – С. 9-11.
7. Алякринский Б.С. Адаптация в аспекте биоритмологии / Б.С. Алякринский // Проблемы временной организации живых систем – М.: Наука, 1979. – С. 8-36.
8. Алякринский Б.С. По закону ритма / Б.С. Алякринский, С.И. Степанова – М.: Наука, 1985. – С. 169.
9. Алякринский Б.С. Проблема циркадианности / Б.С. Алякринский // Пробл. космической биологии – М.: Наука, 1989. – Т.64. – С. 12-34.
10. Алякринский Б.С. Проблемы скрытого десинхроза / Б.С. Алякринский // Космическая биология и медицина. – 1972. – Т.6. - №1. – С. 32-37.
11. Андерсон Т. Статистически анализ временных рядов / Т. Андерсон – М.: Мир, 1976. – 760 с.
12. Антипов В.А. Использование пробиотиков в животноводстве / В.А. Антипов // Ветеринария. – 1991. – №4. – С. 55-58.
13. Антипов В.А. Пробиотики в ветеринарии / В.А. Антипов // Тез. докл. Ленингр. вет. ин-т «Новые фармакологические средства в ветеринарии». – Л., 1989. – С. 7-8.
14. Антонов Б.И. Лабораторные исследования в ветеринарии / Б.И. Антонов – М.: Агропромиздат, 1991. – 287 с.
15. Антохин А.И. Состояние пространственно-временной организации пролиферативной системы крипты тонкой кишки до и после фотоинверсии / А.И. Антохин, С.С. Филиппович, А.Ю. Слинякова и др. // Тез. докл. симп. «Патофизиология органов и систем. Типовые патологические процессы». – М., 1996. – С. 49.
16. Арушанян Э.Б. Вклад неостриатума в ритмическую организацию мозговой деятельности и приспособительное поведение животных / Э.Б. Арушанян // Успехи физиол. наук. – 1992 - №1. – С. 58-73.
17. Арушанян Э.Б. Влияние повреждения супрахиазматических ядер гипоталамуса крыс на динамику их короткопериодных колебаний нормального и абнормального поведения / Э.Б. Арушанян, А.В. Попов // Физиол. журнал им. И.М. Сеченова. – 1994. – № 3. – С. 1-7.
18. Арушанян Э.Б. Возможное участие зрительного анализатора в психофармакологическом эффекте / Э.Б. Арушанян, К.Б. Ованесов // Эксперим. и клиническая фармакология. – 1997. – № 4. – С. 76-82.
19. Арушанян Э.Б. Основы хронофармакологии / Э.Б. Арушанян – Ставрополь, 1988. – 264 с.
20. Арушанян Э.Б. Супрахиазматическое ядро гипоталамуса как регулятор циркадной системы млекопитающих / Э.Б. Арушанян, В.А. Батурин, А.В. Попов // Успехи физиол. наук. – 1988. – № 2 – С. 67-87.
21. Арушанян Э.Б. Хронофармакология / Э.Б. Арушанян. – Ставрополь, 2000. – 565 с.
22. Арушанян Э.Б. Эпифиз и организация поведения / Э.Б. Арушанян // Успехи физиол. наук. – 1991. – № 4. – С. 122-141.
23. Аршавский И.А. О смене типов питания и пищеварения в онтогенезе / И.А. Аршавский, М.Г. Немец // Успехи физиол. наук. – 1996. – Т.27. - №1. – С. 109-128.
24. Аршавский И.А. Учение А.А. Ухтомского о хронотопе – его значение в анализе временных механизмов и закономерностей биологии индивидуального развития / И.А. Аршавский // Успехи физиол. наук. – 1991. – Т.22. - №3. – С. 3-24.
25. Аршавский И.А. Физиологические механизмы и закономерности индивидуального развития / И.А. Аршавский. – М.: Наука, 1982. – С. 58.
26. Аскин Я.Ф. Направление времени и временная структура. / Я.Ф. Аскин // Пространство, время, движение. – М.: Наука, 1971. – С. 56-79.
27. Асланян Н.Л. Методика исследования биологических ритмов в клинике. Методические рекомендации / Н.Л. Асланян, Р.А. Багдасарян, В.М. Шухян, Г.Ж. Ерицян – Ереван, 1978. – 18 с.
28. Асланян Н.Л. Способ выявления и определения параметров биологического ритма / Н.Л. Асланян, Г.Г. Акопян // Проблемы хронобиологии. – 1990. – Т.1. – №3-4. – С. 167-170.
29. Ахметов К.Ж. Хроночувствительность и хроноэффективность гипотензивных препаратов у больных гипертонической болезнью: Автофер. дисс… д-ра мед. наук. – Актюбинск-М., 1993 – 40 с.
30. Ахундов М.Д. Концепции пространства и времени: истоки, эволюция, перспективы / М.Д. Ахундов – М.: Наука, 1982. – С. 22.
31. Ашофф Ю. Свободнотекущие и захваченные циркадианные ритмы / Ю. Ашофф // Биологические ритмы. – М.: Мир, 1984. – Т.1. – С. 54-69.
32. Баевский Р.М. Биоритмологический подход к оценке здоровья и прогнозу / Р.М. Баевский // Материалы 2-й Всесоюзн. конф. по адаптации – Новосибирск, 1976. – С. 6.
33. Баевский Р.М. Временная организация и адаптационно-приспособительная деятельность организма / Р.М. Баевский // Теор. прикл. аспекты анализа временной организации биосистем. – М.: Наука, 1976. – С. 88-111.
34. Баевский Р.М. Саморегуляция биологических ритмов как один из механизмов адаптации организма к изменениям внешней среды / Р.М. Баевский // Адаптация и саморегуляция функций. – М.: Медицина, 1977. – С. 66.
35. Баженова А.Ф. Циркадные ритмы кортикостероидов и электролитов как показатель адаптации человека к условиям Севера / А.Ф. Баженова, В.С. Посный // Научно-технический прогресс и приполярная медицина. – Новосибирск, 1978. – Т.2. – С. 143-144.
36. Балуда В.П. Биологические ритмы системы гемостаза человека / В.П. Балуда, В.А. Исабаева. – Фрунзе, 1978. – 278 с.
37. Балуда В.П. Биологические ритмы системы гемостаза человека. Их роль в физиологии и патологии / В.П. Балуда // Тез. докл. 1-го Всесоюз. съезда гематологов и трансфузиологов. – М., 1979. – С. 310.
38. Барашенков В.С. Представление о пространстве и времени в современной физике / В.С. Барашенков // Философ. науки. – 1984. – № 4. – С. 33-40.
39. Барбараш Н.А. Биоритмологическая характеристика осложнений у больных после протезирования клапанов сердца в госпитальном периоде / Н.А. Барбараш, Л.С. Барбараш, В.Д. Харин и др. // Бюлл. СО АМН СССР. – 1990. - №2. – С. 60-62.
40. Барбараш Н.А. Индивидуальный годичный цикл изменений уровня здоровья и устойчивости организма здоровых лиц и больных ИБС / Н.А. Барбараш, О.Л. Барбараш, Н.И. Лазик // Материалы докл. IV Национ. конгр. по профилактической медиц. и валеол. – СПб: Здоровый мир, 1997. – С. 21-22.
41. Баркова Э.Н. Биоритмы эритропоэза у жителей Крайнего Севера. Фундаментальные и прикладные аспекты / Э.Н. Баркова // Тез. докл. симп. «Патофизиология органов и систем. Типовые патологические процессы». – М., 1996. – С. 236.
42. Беликов В.Г. Синтетические и природные лекарственные средства / В.Г. Беликов – М.: Высшая школа, 1993. – С. 469.
43. Березкин М.В. Некоторые аспекты хронобиологии в медицине / М.В. Березкин // Новости медицины и медицинской техники. – ВНИИМИ, 1977. - №8. – С. 31-63.
44. Березов Т.Т. Биологическая химия / Т.Т. Березов, Б.Ф. Коробкин – М.: Медицина, 1982. – 625 с.
45. Березовская И.В. Циркадные биоритмы и действие лекарственных препаратов / И.В. Березовская // Хим.-фарм. журн. – М., 1977. - №5. – С. 47-55.
46. Березовский Б.А. Индивидуальная реактивность и биоритмы / Б.А. Березовский // Тез. докл. науч.-практ. конф. «Вопросы адаптации, компенсации и реабилитации патологических процессов». - Куйбышев, 1982. – С. 169.
47. Березовский Б.А. Ритм биологических процессов как проявление индивидуальной реактивности и конституции индивида / Б.А. Березовский / Пат. физ. и экспер. терапия. – 1983. - №3. – С. 3-7.
48. Берлякова Е.М. Влияние изменений режима освещения на строение и околосуточную белковую ритмику элементов эпифиза в постнатальном онтогенезе крысы: Автореф. дисс. … канд. биол. наук – М.: РГМУ, 1994.
49. Бовкун Г.Ф. Лечебное действие бифинорма при микроэкологических нарушениях кишечника у телят / Г.Ф. Бовкун, В.Ф. Семенихина, Н.Д. Ткачев // Ветеринария. – 1999. - №4. – С. 39-40.
50. Бойков П.Я. Околочасовой ритм аминоацилирования тРНК в культуре гепатоцитов / П.Я. Бойков, Т.Е. Новикова, Н.А. Шевченко и др. // БЭБМ. – 1990. - №3. – С. 393-396.
51. Большакова Е.Н. Применение бактериальных препаратов для коррекции микрофлоры животных / Е.Н. Большакова // Архив вет. наук. – 1998. – Т.1(48). – С. 61-66.
52. Брагина Н.Н. Функциональные ассиметрии человека / Н.Н. Брагина, Т.А. Доброхотова. – М.: Медицина, 1988. – 239 с.
53. Бродский В.Я. О природе околочасовых внутриклеточных ритмов. Сходство с фракталами / В.Я. Бродский // Изв. РАН. – 1998. – № 3. – С. 316-329.
54. Бродский В.Я. Ритм синтеза белка в денервированной печени / В.Я. Бродский, Т.К. Дубовая, Н.В. Нечаева // Изв. РАН, сер. биол. – 1995. – №2. – С. 133-137.
55. Бродский В.Я. Самосинхронизация клеток в культуре гепатоцитов с противофазными колебаниями интенсивности синтеза белка / В.Я. Бродский, Н.В. Нечаева, Т.Е. Новикова // Изв. РАН, сер. биол. – 1994. – №6. – С. 853-858.
56. Бродский В.Я. Фрактальная структура биоритмов / В.Я. Бродский // Изв. РАН. – сер. биол. – 1998. – С. 6.
57. Бунге М. Пространство и время в современной науке / М. Бунге // Вопросы философии. – 1970. – № 7.– С. 81-92.
58. Бурдун Н.И. Пробиотики и пробиотические продукты в профилактике и лечении наиболее распространенных заболеваний человека / Н.И. Бурдум // Пища, вкус и аромат. – 1999. - №3. – С. 4-6.
59. Вернадский В.И. Проблема времени в современной науке / В.И. Вернадский // Изв. АН СССР, 7 сер., отд. математики и естественных наук. – 1932. – № 4. – С. 511-541.
60. Войно-Ясенецкий А.В. Первичные ритмы возбуждения в онтогенезе / А.В. Войно-Ясинецкий – Л.: Наука, 1974. – С. 23-110.
61. Воробьев А.А. Бактерии нормальной микрофлоры. Биологические свойства и защитные функции / А.А. Воробьев, Е.А. Лыкова // Микробиология. – 1999. - №6. – С. 102-105.
62. Гласс Л. От часов к хаосу. Ритмы жизни / Л. Гласс, М. Мэки. – М.: Мир, 1991.
63. Гневышева А.А. Биологические ритмы в становлении соматических и функциональных признаков у школьников 8-17 лет / А.А. Гневышева // Материалы докл. 11-й науч. конф. по возрастной физиологии, морфологии и биохимии. – Т.1. – М., 1969. – С. 50-53.
64. Голиков А.П. Сезонные биоритмы в физиологии и патологии / А.П. Голиков, П.П. Голиков – М.: Медицина, 1987. – 256с.
65. Гончарова Г.И. Бифидофлора человека и необходимость ее оптимизации / Г.И. Гончарова // Бифидобактерии и их использование в клинике, медицинской промышленности и сельском хозяйстве. – М., 1986. – С. 10-17.
66. Гончарова Г.И. Микробная экология кишечника в норме и при патологии / Г.И. Гончарова // Антибиотики и химиотерапия. – 1989. – Т.34. - №6 – С. 462-466.
67. Готшалк Г.И. Метаболизм бактерий / Г.И. Готшалк. – М.: Мир, 1982. – 310 с.
68. Губин Г.Д. Хронологические подходы к анализу возрастных этапов человека / Г.Д. Губин, А.М. Дуров // Проблемы хронобиологии. – 1991. – Вып. 2. - №1-2. – С. 7-19.
69. Гудвин В.Г. Временная организация клетки / В.Г. Гудвин – М.: Мир, 1966.
70. Дедов И.И. Биоритмы гормонов / И.И. Дедов, В.И. Дедов – М.: Медицина, 1992. – 256 с.
71. Денисенко Л.Н. Определение изоферментов аспартатаминотрансферазы в сыворотке крови / Л.Н. Денисенко, Э.М. Амдий, Б.Ф. Коровкин // Лаб. дело. – 1970. - №1. – С. 31-35.
72. Дерягина Г.П. Суточная периодика показателей системы свертывания крови и гормональная активность надпочечников у здоровых лиц / Г.П. Дерягина, Г.Ю. Кривская // Физиол. журнал СССР. – 1975. - №10. – С. 1564-1573.
73. Дильман В.М. Нарушение гормональной регуляции углеводного обмена при возрастной патологии человека / В.М. Дильман, М.Н. Остроумова // Проблемы медицинской химии – Л., 1973. – С. 147-183.
74. Доброхотов В.Н. Суточная периодичность деления в эпителии пищевода белых крыс / В.Н. Доброхотов, А.Г. Курдюмова // Бюлл. экспер. биол. и мед. – 1962. - №8. – С. 81-84.
75. Доскин В.А. Актуальные проблемы профилактической медицины / В.А. Доскин, Н.А. Лаврентьева // Медицина и здравоохранение. – 1985. – Вып.2. – 81 с.
76. Доскин В.А. Биологические ритмы растущего организма / В.А. Доскин, Н.Н. Кинджи – М., 1989. – 103 с.
77. Доскин В.А. Ритмы жизни / В.А. Доскин, Н.А. Даврентьева – М.: Медицина, 1991. – 176 с.
78. Дружинин Ю.П. Суточный ритм активности крупноклеточных ядер гипоталамуса и коры надпочечников крыс / Ю.П. Дружинин // Проблемы временной организации живых систем – М.: Наука, 1979. – С. 81-97.
79. Дубинина Р.И. Исследования колебаний в минеральном обмене томатных растений / Р.И. Дубинина, Е.И. Ермаков // Колебательные процессы в биологических и химических системах – Пущино-на-Оке, 1971. – С. 182-185.
80. Дэмбэрэл Ш. Возможность использования пробиотиков при болезнях молодняка / Ш. Дэмбэрэл // Материалы науч.-практ. конф. «Стабилизация сельскохозяйственного производства в Монголии, Сибири и Казахстане» – Новосибирск, 1998. – Ч.2. – С. 65-66.
81. Ерещукова М.Г. О пространственной синхронизации периодических режимов в распределенной биохимической системе / М.Г. Ерещукова, Г.С. Маркман // Динамика биологических популяций – Горький: ГГУ, 1983. – С. 3-6.
82. Жирмунский А.В. Критические уровни в развитии природных систем / А.В. Жирмунский, Б.И. Кузьмин – Л.: Наука, 1990. – С. 15-27.
83. Жукова И.Б. К вопросу об азотистом обмене в рубце жвачных животных при различных рационах кормления: Автореф. дис… канд. биол. наук. – М., 1966. – 15 с.
84. Загускин С.Л. Взаимодействие околочасового и околосуточного ритмов. Кибернетическая модель / С.Л. Загускин, С.Н. Гринченко, В.Я. Бродский // Изв. РАН, сер. биол. – 1991. – № 6. – С. 950-954.
85. Загускин С.Л. Ритм перераспределения тигроида в живом нейроне механорецептора речного рака / С.Л. Загускин, М.Е. Немировский, А.В. Жукоцкий, Н.М. Вахтель // Цитология. – 1980. – Т.22. - №8. – С. 982-988.
86. Заславская Р.М. Хронодиагностика и хронотерапия заболеваний сердечно-сосудистой системы / Р.М. Заславская – М.: Медицина, 1991 – 319 с.
87. Заславская Р.М. Хронотерапия артериальной гипертонии / Р.М. Заславская, Ф. Халберг, К.Ж. Ахметов – М.: Квартет, 1996 – 256 с.
88. Зидермане А.А. Некоторые вопросы хронобиологии и хрономедицины / А.А. Зидермане – Рига: Зинатне, 1988. – С. 214.
89. Зинченко У.В. Иммунопробиотический препарат Бактоферон / У.В. Зинченко, А.Н. Панин, К.Н. Груздев // Тез. докл. 2-й науч.-практ. конф. «Актуал. пробл. вет.-сан. контр. с.-х. продукции» – М., 1997. – Ч.2. – С. 80.
90. Иванова А.Б. Влияние ветома 3 на сохранность и интенсивность роста цыплят-бройлеров различных кроссов / А.Б. Иванова // Материалы науч.-практ. конф. «Новые пробиотические и иммунотропные препараты в ветеринарии». – Новосибирск, 2003. – С. 48-49.
91. Иванова А.Б. Изучение влияния препарата Зимун 3.22 на биохимические показатели сыворостки крови при гнойно-катаральном мастите у коров / А.Б. Иванова // Там же – Новосибирск, 2003. – С. 37-38.
92. Иванова А.Б. Фармакологическая коррекция неспецифической резистентности и продуктивности цыплят-бройлеров с использованием ветома 3: Автореф. дис… канд. ветеринар. наук. – Троицк, 2002, 18 с.
93. Ивановский А.А. Новый пробиотик бактоцеллолактин при различных патологиях у животных / А.А. Ивановский // Ветеринария. – 1996. - №11. – С. 34-35.
94. Иноземцев В.П. Новое эффективное средство для профилактики и лечения желудочно-кишечных болезней поросят / В.П. Иноземцев // Ветеринария. – 1998. - №1. – С. 47-51.
95. Казначеев В.П. Патофизиологические аспекты десинхрозов / В.П. Казначеев, Ю.П. Шорин // Циркадные ритмы человека и животных – Фрунзе, 1975. – С. 314-317.
96. Калунянц К.А. Применение продуктов микробиологического синтеза в животноводстве / К.А. Калунянц – М., 1980. – 287 с.
97. Карачковская В.А. Изучение адъювантных свойств ветома 1.1 / В.А. Карачковская // Материалы науч.-практ. конф. «Акт. вопросы ветеринарии» – Новосибирск, 1999. – С. 29-30.
98. Карп В.П. Вычислительные методы анализа в хронобиологии и хрономедицине / В.П. Карп, Г.С. Катинас – СПб, 1997. – 115 с.
99. Карп В.П. Проблемы использования математических методов в хронобиологии и хрономедицине / В.П. Карп, Г.С. Катинас // Проблемы хронобиологии. – 1990. – Т.1. - №1-2. – С. 27-37
100. Кассиль Г.Н. Гуморально-гормональные механизмы вегетативного равновесия при действии на организм физических и химических факторов / Г.Н. Кассиль – Вильнюс, 1969. – С 14-22.
101. Катинас Г.С. Некоторые способы оценки пространственной и временной организации тканей / Г.С. Катинас // Временная и пространственная организация тканей – Л., 1981. – С. 7-25.
102. Киреев А.В. Состояние некоторых показателей вегетативной системы и длительности индивидуальной минуты у человека в разное время суток. / А.В. Киреев // Тез. докл. 47-й студ. науч. конф. Тбилис. гос. мед. ин-та. – Тбилиси, 1984.
103. Кицышин В.П. Суточная вариабельность некоторых нарушений ритма / В.П. Кицышин, С.Б. Шустов, В.М. Емельяненко // Тез. 3-го Междунар. славянского конгр. по электростимуляции и электрофизиологии сердца «Кардиостим-98» - СПб., 1998. – 24 с.
104. Козинец Г.И. Интерпретация анализов крови и мочи и их клиническое значение / Г.И. Козинец – М.: Триада-Х, 1998. – 104 с.
105. Колпаков М.Г. Циркадный ритм активности системы гипоталамус-гипофиз-кора надпочечников / М.Г. Колпаков, Э.М. Казеев, Г.Г. Авдеев // Успехи физиол. наук. – 1976. – Т.7. - №1. – С. 8-23.
106. Комаров Ф.И. Биохимические исследования в клинике / Ф.И. Комаров, Б.Ф. Коровкин, В.В. Меньшиков. – М.-Элиста.: Джангар, 2001. – 215 с.
107. Комаров Ф.И. Предмет, задачи и основные направления хронобиологических исследований в отечественной физиологии / Ф.И. Комаров, Н.И. Моисеева // Физиология человека. – 1983. – Т.6. – С. 1011-1022.
108. Комаров Ф.И. Проблемы хрономедицины на современном этапе / Ф.И. Комаров // Клиническая медицина. – 1988. – № 12. – С. 3-7.
109. Комаров Ф.И. Хронобиологическое направление в медицине: биоуправляемая хронофизиотерапия / Ф.И. Комаров, С.Л. Загускин, С.И. Рапопорт // Терапевтический архив. – 1994. - №8. – С. 3-6.
110. Комаров Ф.И. Хронобиология и хрономедицина – новое направление в медико-биологичекской науке / Ф.И. Комаров // Тез. докл. 1-го Росс. конгр. «Патофизиология органов и систем. Типовые патологические процессы» – М., 1996. – С. 253-254.
111. Комаров Ф.И. Хронобиология и хрономедицина / Ф.И. Комаров, С.И. Рапопорт – М.: Триада-Х, 2000. – 488 с.
112. Комаров Ф.И. Хрономедицина – новое направление в медико-биологической науке и практике / Ф.И. Комаров, Ю.А. Романов, Н.И. Моисеева // Хронобиология и хрономедицина – М.: Медицина, 1989. – С. 5-16.
113. Комисcарова И.А. Возрастная динамика сукцинатдегидрогеназы лимфоцитов и физически активных и неактивных людей. Проблемы эволюционной морфологии человека и его рас / И.А. Комисарова, Г.Н. Лаврухина, Б.В. Гудкова и др. – М.: Наука, 1986. – С. 208-211.
114. Комисcарова И.А. Новые подходы к оценке эффективности терапии на основе индивидуального прогнозирования / И.А. Комисарова, Р.П. Нарциссов // Актуальные проблемы оценки фармакологически активных химических соединений. Ч.2. – М., 1981. – С. 25.
115. Кондрахин И.П. Клиническая лабораторная диагностика в ветеринарии / И.П. Кондрахин – М.: Агропромиздат, 1985. – 287 с.
116. Корнеев А.А. Некоторые аспекты индивидуальной резистентности к гипоксии беременных крыс и их потомства. Препараты коррекции / А.А. Корнеев, И.А. Комисарова, Е.М. Чиркова, М.А. Коппель др. // Тез. докл. 2-го Росс. нац. конгр. «Человек и лекарство». – М., 1995. – С. 16.
117. Коршунов В.М. Проблема регуляции микрофлоры кишечника / В.М. Коршунов // Микробиология. – 1995. - №3. – С. 48-55.
118. Косова И.В. Управление и экономика фармацевтического дела / И.В. Косова, Е.Е. Лоскутова, Т.П. Лагуткина – М., 2003. – С. 19.
119. Косых М.И. Биоэнергетические свойства «темных» и «светлых» клеток / М.И. Косых, Ю.С. Ченцов // Доклады РАН. – 1991. – Т. 316. - №2. – С. 475-478.
120. Косяков А.С. Клиническая биохимия / А.С. Косяков – Л., 1967. – 459 с.
121. Краюшкин С.И. Суточная и сезонная динамика показателей кардиореспираторной системы и перекисного окисления липидов у человека при функциональных нагрузках: Дис… канд. мед. наук. – М., 1991. – 131 с.
122. Кривошеева Н.К. Эффективность бифидумбактерина при лечении вторичных иммунодефицитов у телят / Н.К. Кривошеева // Морфология, физиология, патология и терапия животных и пушных зверей клеточного содержания – Омск, 1997. – С. 84-85.
123. Крыжановский Г.Н. Биоритмы и закон структурно-функциональной временной дискретности биологических процессов / Г.Н. Крыжановский // Биологические ритмы в механизмах компенсации нарушенных функций – М., 1973. – С. 20-34.
124. Кудряшов Б.А. Биологические проблемы регуляции жидкого состояния крови и ее свертывания / Б.А. Кудряшов – М.: Медицина, 1975. – 488 с.
125. Кузнецова С.В. Зависимость секреции гормонов фетоплацентарного комплекса от времени года / С.В. Кузнецова, Р.В. Учакина // Физиология человека. – 1998. – Т. 24., № 1. – С. 114-117.
126. Кулкаева Ж.Ж. Хроночувствительность и хроноэффективность антагонистов кальция – верапомила и кордипина у больных стенокардией: Автореф. дис… канд. мед. наук. – Москва, 1997. – 24 с.
127. Лазик Н.И. Биоритмологический подход к прогнозированию результатов аорто-коронарного шунтирования: Автореф. дис… канд. мед. наук. – Томск, 1997. – 22с.
128. Ланда П.С. Автоколебания в живых организмах / П.С. Ланда, М.Г. Розенблюм // Природа. – 1992. - №8. – С. 18-27.
129. Левин В.Р. О возможной 3-х годичной периодичности в биологических системах. / В.Р. Левин // Биофизика. – 1969. – № 1. – С. 199-203.
130. Леденева О.Ю. Фармакологическая коррекция гнойно-катаральных эндометритов у коров с применением нового пробиотического препарата ветомгин: Автореф. дис… канд. ветеринар. наук. – Троицк, 2003. – 18 с.
131. Леляк А.И. Пробиотики открывают новый фронт против инфекций / А.И. Леляк // «Комсомольская правда» от 17.01.2001.
132. Леонтович В.А. Биохимия лейкоцитов / В.А. Леонтович // Нормальное кроветворение и его регуляция – М.: Медицина, 1976. – С. 260-274.
133. Литвина Л.А. Использование пробиотиков для повышения сохранности телят / Л.А. Литвина, В.М. Коростель // Проблемы с.-х. экологии. – Новосибирск, 2000. – С. 53.
134. Литвина Л.А. Микробиоценоз кишечника и его роль в поддержании гомеостаза / Л.А. Литвина // Там же – Новосибирск, 2000. – С. 51-52.
135. Лужнова С.А. Хронобиологические аспекты влияния диаминодифенилсульфона на гематологические показатели у мышей в летний и зимний сезон года / С.А. Лужнова, Н.Г. Урляпова // Пат. физиол. и экспериментальная терапия. – 2004. – № 2. – С. 18-20.
136. Львов С.Е. Биоритмы и травматизм / С.Е. Львов, Е.П. Щенников // Ортопедия, травматизм и протезирование. – 1982. - №6. – С. 62-63.
137. Лютинский С.И. Патологическая физиология сельскохозяйственных животных / С.И. Лютинский – М.: Колос, 2001. – 495 с.
138. Макаров В.И. Изменение биоритмов в экстремальных условиях / В.И. Макаров // Хронобиология и хрономедицина – М.: Медицина, 1989. – С. 169-183.
139. Малик Н.И. Ветеринарные пробиотические препараты / Н.И. Малик, А.Н. Панин // Ветеринария. – 2001. - №1. – С. 46-51.
140. Маркина В.В. Пространственно-временная организация активности ферментов энергетического обмена в печени: Автореф. дис… докт. мед. наук – М.: 2 МОЛГМИ, 1987.
141. Маркина В.В. Пространственно-временная организация энергетического обмена в печени / В.В. Маркина, Ю.А. Романов // Доклады 3-го симпоз. СССР-ГДР «Хронобиол. и хрономедиц.». – Галле, 1987. –С. 116-123.
142. Мозжерин В.И. Влияние биостимуляторов на естественную резистентность организма телят / В.И. Мозжерин // Ветеринария. – 2000. - №6. – С. 38-41.
143. Моисеева Н.И. Восприятие времени человеком и его роль в спортивной деятельности / Н.И. Моисеева, Н.И. Караулова, С.В. Панюшкина, А.Н. Петров – Ташкент: Медицина, 1985. – 157 с.
144. Моисеева Н.И. Некоторые методологические аспекты изучения понятия времени в биологии. / Н.И. Моисеева // Методол. вопр. теории медиц. – Л.: Медицина, 1975. – С. 87-116.
145. Моисеева Н.И. Свойства биологического времени. / Н.И. Моисеева // Сбор. научн. трудов «Фактор времени в функцион. организации деят. живых систем». – Л.: АН СССР, 1980. – С. 15-19.
146. Моисеева Н.И. Структура биоритмов как один из критериев возможностей физиологической адаптации организма / Н.И. Моисеева // Физиол. журнал СССР. – 1978. – Т.64. - №11. – С. 1632-1640.
147. Мостепатенко А.М. Размерность времени и временной порядок / А.М. Мостепатенко // Пространство, время, движение. – М.: Наука, 1971. – С. 35-51.
148. Нечаева Н.В. Околочасовая периодичность синтеза белка в тканях некоторых беспозвоночных / Н.В. Нечаева, А.Д. Харазова, В.И. Фатеева // Цитология. – 1989. – Т. 31. – № 5. – С. 601-603.
149. Ноздрин А.Г. Терапевтическая эффективность схем лечения с использованием ветома 1.1 и антибиотика при диспепсии у телят / А.Г. Ноздрин // Материалы науч.-практ. конф. «Новые пробиотические и иммунотропные препараты в ветиринарии». – Новосибирск, 2003. – С. 33-34.
150. Ноздрин А.Г. Фармакологические аспекты применения пробиотиков новорожденным телятам: Автореф. дис… канд. ветеринар. наук. – Троицк, 2000. – 18 с.
151. Ноздрин Г.А. Механизм антимикробного действия пробиотических препаратов / Г.А. Ноздрин, А.Г. Ноздрин, А.Б. Иванова // Материалы науч.-практ. конф. «Новые пробиотические и иммунотропные препараты в ветиринарии». – Новосибирск, 2003. – С. 56-58.
152. Ноздрин Г.А. Новые иммуномодуляторы и лечебно-профилактические средства / Г.А. Ноздрин, В.Н. Зеленков // Тез. докл. 4-й межвуз. науч.-практ. конф. «Новые фармакологические средства в ветеринарии» – СПб., 1992. – 114 с.
153. Ноздрин Г.А. Принципы рациональной профилактики болезней органов пищеварения у новорожденных телят с использованием пробиотиков / Г.А. Ноздрин, В.Д. Соколов // Тез. докл. науч.-практ. конф. «Актуальные вопросы ветеринарии» – Новосибирск, 1999. – С. 3-4.
154. Ноздрин Г.А. Пути повышения естественной резистентности новорожденных телят / Г.А. Ноздрин, А.С. Донченко // Тез. докл. науч.-практ. конф. «Актуальные вопросы ветеринарии» – Новосибирск, 1997. – С. 4-5.
155. Ноздрин Г.А. Состояние и перспективы применения пробиотиков на основе Bac. subtilis в Западно-Сибирском регионе / Г.А. Ноздрин // Материалы науч.-практ. конф. «Новые пробиотические и иммунотропные препараты в ветиринарии». – Новосибирск, 2003. – С. 7-9.
156. Ноздрин Г.А. Фармакологическая коррекция иммунодефицитов у телят в ранний постнатальный период жизни: Автореф. дис... д-ра ветеринар. наук. – СПб., 1996. – 37 с.
157. Ноздрин Г.А. Фармакопрофилактика и фармакотерапия при гинекологических заболеваниях у коров с использованием нового пробиотика ветомгин / Г.А. Ноздрин, О.Ю. Леденева // Материалы науч.-практ. конф. «Новые пробиотические и иммунотропные препараты в ветиринарии». – Новосибирск, 2003. – С. 29-30.
158. Оранский И.Е. Биологические ритмы и бальнеотерапия / И.Е. Оранский – М.: Медицина, 1977. – 119 с.
159. Оранский И.Е. Биоритмология и хронотерапия / И.Е. Оранский, П.Г. Царфис – М.: Высшая школа, 1989. – 159 с.
160. Оранский И.Е. Природные лечебные факторы и биологические ритмы / И.Е. Оранский – М.: Медицина, 1988. – 288 с.
161. Осинова И.Г. Изучение безопасности бактерий рода Bacillus, составляющих основу некоторых пробиотиков / И.Г. Осинова // ЖМЭИ. – 1998 – С. 30-68.
162. Панин А.Н. Влияние пробиотического препарата с иммунорегуляторным компонентом на некоторые иммунологические показатели у лабораторных животных / А.Н. Панин, Н.И. Малик, Е.В. Малик и др. // Сборн. науч. трудов ВГНКИ. – 1996. – Т.59. – С. 139-143.
163. Пауков В.С. Структурно-функциональная характеристика нейтрофильных лейкоцитов и их роль в формировании воспалительных и иммунных процессов / В.С. Пауков, О.Я. Кауфман // Арх. патологии. – 1983. – Т. 45. – Вып. 5. – С. 3-13.
164. Петричук С.В. Влияние факторов внешней среды на ферментный статус лейкоцитов крови человека / С.В. Петричук, В.М. Шищенко, Р.П. Нарциссов // Живые системы под внешним воздействием. – СПб, 1992. – Т.2. – С. 21-27.
165. Петров Р.В. Контроль и регуляция иммунного ответа / Р.В. Петров – Л.: Медицина, 1981. – 311 с.
166. Питтендрай К. Циркадные ритмы и циркадная организация живых систем / К. Питтендрай // Биологические часы. – М.: Мир, 1964 – С. 263-306.
167. Питтендрих К. Циркадианные системы: общая перспектива / К. Питтендрих // Биологические ритмы, М.: Мир, 1984. – Т.1. – С. 22-53.
168. Платонов А.В. Производство препаратов для животноводства на основе микроорганизмов-симбионтов желудочно-кишечного тракта / А.В. Платонов. – М., 1985. – С. 23.
169. Покровский А.А. Использование ферментных реакций в клинике с диагностическ5им целями / А.А. Покровский // Акт. вопросы современной биохимии. – М., 1962. – С. 220-230.
170. Полякова Э.Д. Пути биосинтеза холестерина в печени и его регуляция / Э.Д. Полякова // Липиды. Структура, биосинтез, превращения и функции. – М., 1977. – С. 131-142.
171. Пронина Т.С. Сезонные и возрастные ритмы функциональной активности гипофизарно-надпочечниковой системы в онтогенезе человека / Т.С. Пронина, Н.И. Орлова, Т.А. Филиппова // Хронобиология и хронотерапия. – М., 1981. – С. 290.
172. Пэрна Н.Я. Ритм, жизнь и творчество / Н.Я. Пэрна. – Л.-М.: Петроград, 1925. – 141с.
173. Радыш И.В. Суточная динамика показателей кардиореспираторной системы при адаптации человека в различных природно-климатических условиях: Дисс… канд. мед. наук. – М., 1987. – 227 с.
174. Рапопорт С.И. Включение аминокислот в белки слизистой желудка у больных с хроническим гастритом / С.И. Рапопорт, Н.В. Нечаева, В.И. Фатеева и др. // Клин. медицина. – 1987 - №6. – С. 64-67.
175. Романов Ю.А. Анализ временных и пространственных изменений в пролиферативной системе крипты тонкой кишки у нормальных и зараженных брюшнотифозной инфекцией мышей / Ю.А. Романов, А.И. Антохин, А.Ю. Слинякова и др. // Тез. докл. межд. науч. конф. «Акт. пробл. экол. хронобиол. и хрономедиц.» – Екатеринбург, 1994. – С. 159.
176. Романов Ю.А. Анализ временных параметров деления клеток при изменении фотопериодичности / Ю.А. Романов, С.С. Филиппович, С.М. Кузин и др. // Материалы симп. «Способы регенерации и клеточное деление» – М.: Наука, 1979. – С. 44-53.
177. Романов Ю.А. Влияние инверсии фоторежима на разнопериодические биологические ритмы митотического индекса в эпителии пищевода мышей / Ю.А. Романов, О.А. Ириков, С.С. Филиппович, В.В. Евстафьев // Бюлл. эксп. биол. мед. – 1996. - №1. – С. 94-97.
178. Романов Ю.А. Временная организация биологических систем / Ю.А. Романов // Биологические ритмы. – М.: Наука, 1980. – С. 10-56.
179. Романов Ю.А. Изучение пространственно-временной организации размножения клеток в системе «крипта-ворсинка» тонкой кишки у интактных и зараженных брюшнотифозной инфекцией мышей / Ю.А. Романов, В.В. Маркина, А.И. Антохин и др. // Тез. докл. симп. «Патофизиология органов и систем. Типовые патологические процессы» – М., 1996. – С. 256.
180. Романов Ю.А. Междисциплинарный характер исследования временной организации биологических систем и их значение для медицины / Ю.А. Романов // Биология и медицина. – М., 1985. – С. 90-103.
181. Романов Ю.А. Новые данные о пространственно-временной организации энергетического метаболизма и пролиферативных процессов в системе «крипта-ворсинка» тонкой кишки мышей в норме и при патологии / Ю.А. Романов, В.В. Маркина, А.И. Антохин и др. // Материалы 8-го межд. симпоз. «Эколого-физиологические проблемы адаптации». – М., 1998. – С. 320.
182. Романов Ю.А. О временной организации процессов репродукции клеток в организме / Ю.А. Романов // Суточные ритмы физиологических процессов в организме. – М., 1972. – С. 48-51.
183. Романов Ю.А. Проблемы хронобиологии / Ю.А. Романов. – М.: Знание, 1989. – 64 с.
184. Романов Ю.А. Пространственно-временная организация энергетического обмена в печени / Ю.А. Романов, В.В. Маркина // Хронобиология и хрономедицина. – М.: Медицина, 1989. – С. 52-69.
185. Романов Ю.А. Теория биологических систем и проблема их временной организации / Ю.А. Романов // Проблемы хронобиологии. – 1990. – Т. 1. – № 3-4. – С. 105-122.
186. Романов Ю.А. Теория пространственно-временной организации морфофункциональных систем организма и ее значение для понимания их деятельности / Ю.А. Романов, В.В. Маркина // Пространственно- временная организация развития. – М.: Изд-во МГУ, 1998. – С. 1-13.
187. Романов Ю.А. Хронобиология и проблема пространственно-временной организации морфофункциональных систем организма / Ю.А. Романов, В.В. Маркина, В.П. Рыбаков // Тез. докл. конф. «Хронобиология и хрономедицина». – Уфа, 1985. – Т. 1. – С. 14-15.
188. Романов Ю.А. Хронобиология и хроноэкология: новый взгляд на информационные взаимодействия в живой системе / Ю.А. Романов // Тез. докл. Межд. научн. конф. «Акт. пробл. экол. хронобиол. и хрономедиц.». – Екатеринбург, 1994. – С. 154-156.
189. Ряпосова И.К. Ферменты и изоферменты в сыворотке крови при заболеваниях гепатобилиарной системы: Автореф. дис… канд. биол. наук. – М., 1973. – 20 с.
190. Селиверстова Г.П. Суточный профиль и корреляционные отношения показателей липидного обмена и системы гемостаза у здоровых людей / Г.П. Селиверстова // Физиол. человека. – 1988. – Т.4. - №10. – С. 659-663.
191. Селиверстова Г.П. Хроноструктура суточной динамики биохимических показателей у здоровых людей и больных с начальной стадией ишимической болезни сердца: Автореф. дис... д-ра мед. наук. – М., 1990 – 29 с.
192. Семенова А.И. Жизненный принцип организма / А.И. Семенова. – М.: Знак, 1995. – 191 с.
193. Сергеева Э.П. Периодичность синтеза белка в клетках изолированных жабр мидии в разное время года / Э.П. Сергеева, А.Д. Харазова, В.И. Фатеева, Н.В. Нечаева // Биология моря. – 1987. – № 3. – С. 19-22.
194. Сетров М.И. Взаимосвязь основных иерархических рядов организации живого / М.И. Сетров // Развитие концепции структурных уровней в биологии. – М.: Наука, 1972. – С. 311-321.
195. Смирнов В.В. Антибиотики/или пробиотики: размышоения и факты / В.В. Смирнов // Медицинская картотека. – 1998. - №8. – С. 10-12.
196. Смирнов В.В. Современные представления о механизме лечебно-профилактического действия пробиотиков из бактерий рода Bacillus / В.В. Смирнов // Микробиология. – 1993. – Т.55. – №4. – С. 34-35.
197. Смирнов В.В., Высокоэффективный биологический препарат Биоспорин / В.В. Смирнов, С.Р. Резник, И.В. Сорокулова // Врачебное дело. – 1994.- №5-6.- С.133-137.
198. Смирнов К.М. Циркадные ритмы человека и животных / К.М. Смирнов, Е.К. Аникина – Фрунзе, 1978. – С. 259-260.
199. Сорокулова И.Б. Рекомбинантные пробиотики: проблемы и перспективы использования в медицине и ветеринарии / И.Б. Сорокулова // Вестн. РАМН. – 1997. - №3. – С. 46-49.
200. Степанова С.И. О биоритмологическом отборе космонавтов / С.И. Степанова // Косм. биол. и авиакосм. медицина. – 1975. - №4. – С. 40.
201. Степанова С.И. Теоретические и прикладные проблемы биоритомлогии: Автореф. дис... д-ра мед. наук. – М., 1983. – 30с.
202. Субботин В.В. Биотехнология пробиотика лактобифадола (бифацидобактерина) и его лечебно-профилактическая эффективность: Автореф. дис… д-ра ветеринар. наук. – М., 1999. – 41 с.
203. Субботин В.В. Биотехнология пробиотиков ветеринарного назначения / В.В. Субботин // Аграр. наука. – 1998. - №3. – С. 20-21.
204. Субботин В.В. Лактобифадол для бактериопрофилактики и терапии желудочно-кишечных заболеваний / В.В. Субботин, М.А. Сидоров // Ветинформ. – 1991. - №1. – С. 20.
205. Субботин В.В. Новые пробиотики / В.В. Субботин, Н. Данилевская // Животновод. – 1998. - №4. – С. 20.
206. Таболина В.А. Суточные ритмы физиологических процессов организма / В.А. Таболина – М., 1972. – 134 с.
207. Тараканов Б.В. Использование пробиотиков в животноводстве / Б.В. Тараканов – Калуга, 1998 – С. 5-6.
208. Тараканов Б.В. Механизмы действия пробиотиков на микрофлору пищеварительного тракта и организм животных / Б.В. Тараканов // Ветеринария. – 2000. - №1. – С. 47-54.
209. Тараканов Б.В. Новые биопрепараты для ветеринарии / Б.В. Тараканов, Т.А. Николичева // Ветеринария, 2000. – №7. – С. 45-50.
210. Тараканов Б.В. Применение лактоамиловорина при выращивании телят / Б.В. Тараканов, В.Г. Косолапова // Зоотехния. – 1999. - №9. – С. 57-60.
211. Тараканов Б.В. Пробиотический потенциал телят / Б.В. Тараканов, Т.А. Николичева // Ветеринария. – 2001. – №3. – С. 46-49.
212. Тимошко М.А. Теоретические и практические аспекты гнотобиологии / М.А. Тимошко. – М., 1986. – С. 158-162.
213. Токбаева К.К. Временная организация гемодинамики и ее коррекция гипотензивными препаратами у больных гипертонической болезнью II стадии в условиях Западного Казахстана: Автореф. дис... д-ра мед. наук. – Актюбинск-Москва, 1997. – 23 с.
214. Уинфри А. Время по биологическим часам / А. Уинфри. – М.: Мир, 1990.
215. Федер Е. Фракталы / Е. Федер. – М.: Мир, 1991. – 261 с.
216. Федулина Н. Биологическая активность целлобактерина / Н. Федулина // Птицеводство. – 1989. - №5. – С. 34-35.
217. Фещенко В.М. Изучение влияния препарата ветом 4 и низкоинтенсивного лазерного излучения на поросят, больных гастроэнтеритом: Автореф. дис… канд. ветеринар. наук. – Троицк, 2003 – 18 с.
218. Халберг Ф. Временная координация физиологических функций / Ф. Халберг // Биологические часы. – М.: Мир, 1964. – С. 475-509.
219. Халберг Ф. Хроном – выявление связи многочастотных ритмов с возрастными трендами и хронориском и роль хронома в профилактической медицине / Ф. Халберг, Ж. Корнелиссен, Д. Хилман и др. // Хронобиол. и хрономед. и влияние гелиогеофизич. Факторов на организм чел. – М., 1992. – С. 83-124
220. Хетагурова Л.Г. Хронофитокорреция десинхрозов в эксперименте / Л.Г. Хетагурова // Тез. докд. совещ. ПК АМН СССР по хронобиологии и хрономедицине «Временная организация чувствительности организма к биологически и экологически активным веществам» – Свердловск, 1991. – С. 139-140.
221. Черная Л.А. Перспективное направление исследований в изучении годового эндогенного цикла / Л.А. Черная, Т.Ф. Никитская, В.И. Шапошникова // Вакцинопрофилактика детских инфекций. – Л., 1981. – С. 124-127.
222. Шамрай Е.Ф. Клиническая биохимия / Е.Ф. Шамрай, А.Е. Пащенко – М., 1970. – 216 с.
223. Шапошникова В.И. Зоны риска в годовом эндогенном цикле / В.И. Шапошникова, Р.П. Нарциссов, Н.В. Белкина // Материалы I Росс. конгр. по патофизиологии. – М., 1996. – С. 260.
224. Шапошникова В.И. Индивидуальный год – собственный календарь морфогенеза, заболеваний и устойчивости эффективной деятельности / В.И. Шапошникова, Р.П. Нарциссов, Н.В. Белкина // Бюл. всеросс. науч. центра по безопасности биологически активных веществ. – М., 1995. – № 1. – С. 60-68.
225. Шапошникова В.И. Исследование динамики спортивных результатов в процессе многолетней подготовки спортсменов / В.И. Шапошникова // Теор. и практ. физич. культ. – 1969. – № 8. – С. 59-64.
226. Шапошникова В.И. Критические периоды в жизни человека / В.И. Шапошникова, М.Я. Левин, В.Р. Левин // Человек и среда. – Л.: Наука, 1975. – С. 188-193.
227. Шапошникова В.И. Многолетние биологические ритмы человека / В.И. Шапошникова // Человек и среды – Л.: Наука, 1975. – С. 181-187.
228. Шевченко А.И. Фармакологическая эффективность применения ветома 1.1 у цыплят-бройлеров кросса «Смена-2»: Автореф. дис… канд. ветеринар. наук. – Троицк, 2003. – 18 с.
229. Шендеров Б.А. Медицинская микробная экология и функциональное питание. Т.1. Микрофлора человека и животных и ее функция / Б.А. Шендеров. – М.: Грантъ, 1998. – 288с.
230. Шендеров Б.А. Функциональное питание и пробиотики: микроэкологические аспекты. – М.: Агар, 1997. – 24 с.
231. Шлыгин Г.К. Желчные кислоты / Г.К. Шлыгин, Ф.И. Комаров // БМЭ – М., 1978. – Т.8. – С. 162-165.
232. Шлыгин Г.К. Периодические изменения ферментоотделительных процессов в поджелудочной железе / Г.К. Шлыгин, Т.В. Лактаева // Физиол. ж. СССР. – 1975. – Т.61. - №4. – С. 628-635.
233. Яковлев В.А. Изоферменты / В.А. Яковлев // Успехи биол. химии. – 1968. - №9. – С. 65.
234. Яковлев В.А. Суточные ритмы эндокринной системы у здорового и больного человека / В.А. Яковлев, С.Б. Шустов – М.: Союзмединформ. – 1989. – 66 с.
235. Янушкевичус З.И. Нарушение ритма и проводимости сердца / З.И. Янушкевичус, Ю.Ю. Бредикис, А.Й. Лукошявичюте, П.В. Забела – М.: Медицина, 1964. – 288 с.
236. Aschoff J. Circadian systems / J. Aschoff // Pflugers Arch. – 1985. – Suppl. 1. – P. 403.
237. Aschoff J. Desynchronization and resynchronization of human circadian rhythms / J. Aschoff // Aerospace med. – 1969. – Vol. 40 – № 8. – P. 844-849.
238. Aschoff J. On the aging of circadian systems / J. Aschoff // Evolution of circadian clock – Sapporo, 1994. – P. 22-24.
239. Brodsky V.Y. Protein synthesis rhythm / V.Y. Brodsky // Journal theor. Biol. – 1975. – V.55 – № 2. – P. 167-194.
240. Brodsky V.Y. Rhythms of protein synthesis and other circahoralian oscillations / V.Y. Brodsky // Ultradian rhythms in life processes – London: Springer, 1992. – P. 23-40.
241. Bunning E. Die Physiologische Uhr / E. Bunning – Berlin: Springer, 1958.
242. Daan S. Circadian contributions to survival / S. Daan, J. Aschoff // Vertebrate circadian systems. – London: Springer, 1982. – P. 305-321.
243. Gilliland S.E. // FEMS Microbiol. Rev. – 1990. – Vol. 87.
244. Halberg F. Chronobioilogy / F. Halberg // Am. Rev. Physiol. – 1969. – Suppl. 31. – P. 675-725.
245. Halberg F. Chronobiological glossary of the International society for the study of biological rhythms / F. Halberg, G. S. Katinas // Internat. J. Chronobiol. – 1973. – Suppl. 1. – P. 31-63.
246. Halberg F. Physiologic 24-hour rhythms. A determinant of response to enviromental agents / F. Halberg // Man’s dependence on the eathly atmosphere. – N.-Y., 1962. – P. 48-96.
247. Halberg F. Physiology 24-hour periodicity in human beings and mice, the lighting regimen and daily routine / F. Halberg // Photoperiodosm and related phenomena in plants ans animals – Washington, 1959. – P. 803-878.
248. Halberg F. Rhythmes circadiens et rhythmes de basse frequences en physiology humain / F. Halberg, A. Reinberg // Physiol. Paris. – 1967. - №59. – P. 117-200.
249. Hastings M.H. Central clocking / M.H. Hastings // Trends in Neurosci. – 1997. – № 20 (10) – P. 459-464.
250. Kippert F. A temperature compensated ultradian clock explains temperature-dependent quantal cell cycle times / F. Kippert, D. Lloyd // Soc. Exp. Biol. Symp.. – 1987. – V. 41 – P. 135-155.
251. Kondo T. Circadian clock mutans of cyanobacteria / T. Kondo, F. Tsinoremas, S.S. Golden // Science. – 1994. - №266. – P. 1233-1236.
252. Lloyd A. Hypothesis: The central oscillator of the circadian clock is a controlled chaotic attractor / A. Lloyd, D. Lloyd // BioSystems. – 1993. – V. 29 – P. 77-85.
253. Lloyd D. Chaos: its significants and detection in biology / D. Lloyd, A. Lloyd // Biol. Rhythns Res. – 1995. – Suppl. 26. – P. 233-252.
254. Lloyd A. Ultradian rhythms in life processes / A. Lloyd, E. Rossi // Springer-Verlag. – London, 1992 – 419pp.
255. Meijer J. Neurophysioligy of the suprachiasmatic circadian pacemaker in rodents / J. Meijer, W. Reitveld // Physiologycal revues. – 1989. – V. 69. – P. 671-707.
256. Menaker M. What does melatonin do and how does it do it? / M. Menaker // J. Biol. Rhythms. – 1997. – Suppl. 12(6). – P. 532-534.
257. Menaker M. Evolution of circadian organization in vertebrates / M. Menaker, L.F. Moreira, G. Tosini // Brazilian J. of Med. and Biol. Res. – 1997. – V. 30(3). – P. 305-313.
258. Moore R. Photic entrainment pathwars in the mammalian circadian system / R. Moore // Chronobiol. Internat. – 1997. – V. 14 – Suppl. 1 – P. 118.
259. Moore-Ede M. Physiology of the circadian timing system: predictive versus reactive homeostasis / M. Moore-Ede // Am. J. Physiol. – 1986. – Suppl. 250 – P. 735-752.
260. Reinberg A. Les Rythmes biologiques / A. Reinberg // La Recmefame, 1971. – №10. – P. 241-262.
261. Rietveld W.J. Circadian rhythms and masking: an overview / W.J. Rietveld, D.S. Minors, J. Waterhouse // Chronobiol. Internat. – 1993. – Suppl. 19(4). – P. 306-312.
1. Хронобиология как современное направление биологической и ветеринарной науки
1.1. Краткая история биоритмологии
Принцип временной организации биологических систем относятся к основным параметрам, характеризующим различные формы жизни, поскольку материя, и ее движение не существуют вне пространства и времени. Представление о ритмическом характере физиологических процессов не является новым. Уже в древних мифологических, религиозных и философских системах эти параметры рассматривались как отражающие генетическое начало мира (Ахундов М.Д., 1982). Гиппократ более 2400 лет назад писал о подъемах и падениях, присущих физическому состоянию людей, однако сравнительно недавно началось интенсивное изучение биоритмов, поиски истинного механизма биологических часов, свойственных всему живому (Зидермане А.А., 1988). В Древней Индии лекари назначали больным лекарства с учетом времени года, суток, а также погоды (Косова И.В., Лоскутова Е.Е., Лагуткина Т.П., 2003).
Способность организмов измерять время впервые обнаружил почти 300 лет назад французский астроном де Мерон. Проведенные им в 1729г. опыты показали, что у растений существует периодичность движений листьев. Вскоре наблюдения де Мерона были подтверждены многими биологами (исследования биоритмов на растениях в свое время проводили Т. Цинн (1759), К. Линней (1791), Х. Гутеланд (1797), Ч. Дарвин (1880)), однако причины периодичности физиологических процессов у живых организмов были обнаружены значительно позднее.
В истории развития науки вплоть до конца XIX века господствовала ньютоновская концепция пространства и времени. Ньютон выделял два типа пространства и времени: абсолютный и относительный. В своей работе «Математические начала натуральной философии» (1687) он писал, что абсолютное, истинное, математическое время само по себе и по самой своей сущности, без всякого отношения к чему-либо внешнему, протекает равномерно и иначе называется длительностью. Абсолютное пространство по самой своей сущности, безотносительно к чему бы то ни было внешнему, остается всегда одинаковым и неподвижным. Под относительным пространством Ньютон понимал протяженность материальных объектов, которые как во вместилище находятся в абсолютном пространстве. Он также говорил, что относительное, кажущееся или обыденное время или точная или изменчивая, постигаемая чувствами, внешняя, совершаемая при посредстве какого-либо движения мера продолжительности, употребляемая в обыденной жизни вместо истинного математического времени, как-то час, месяц, год. Следовательно, по Ньютону, относительные пространства и время – это эмпирические метризованные аналоги абсолютных пространства и времени (Романов Ю.А., 1989).
Следующим крупным этапом в развитии представлений о пространстве и времени стала специальная (частная) теория относительности А. Эйнштейна (1905), рассматривающая пространственно-временные свойства физических процессов и постулирующая существование в мире единого пространственно-временного континуума (непрерывности). Согласно этой теории, в физическом мире пространство и время едины и взаимозависимы, а геометрические свойства пространства, его кривизна и скорость течения времени зависят от распределения и движения материальных тел и от гравитационного поля.
По мнению М. Бунге (1970), пространство-время относится к важнейшим основаниям науки. Оно, по-видимому, представляет собой фундаментальную структуру совокупности событий.
Другими словами, течение и свойства времени зависит от системы отсчета времени, что в принципе означает наличие в различных по природе объектов мира своего собственного времени (Романов Ю.А., 1990).
Н.Я. Пери (1925) отмечал, что "...всякий периодический или волнообразный процесс есть, в сущности, прогрессивный процесс, в каждом периодическом процессе нечто достигается. Каждый последующий период или следующая волна не есть полное повторение предыдущих, а наслаивается на эти предыдущие как их следующая и новая ступени".
Считается, что проблема биологического времени была поставлена более 100 лет назад основоположником эмбриологии К. Бэром. Он время тесно связывал с процессами индивидуального развития. Однако научно обоснованная идея о биологическом времени принадлежит академику В.И. Вернадскому (1932). В это понятие он включил время, связанное с жизненными явлениями, происходящими в пространстве организмов, которое характеризуется диссиметрией. Разработка основ учения о восприятии времени органами чувств человека и животных и роли органов чувств в формировании биологических ритмов является заслугой И.М. Сеченова.
В 1935г. в Швейцарии было создано первое Международное общество по исследованию биологических ритмов, которое было преобразовано в 1971г. в США в Международное общество хронобиологии и существует до настоящего времени.
Отдельные разделы современной биоритмологии напрямую перекликаются с дошедшими до нас древними китайскими теориями о ритмически происходящих процессах в живом организме, его частях, структурах, органах, их объединениях, или, что сейчас нередко можно встретить в соответствующей литературе, органно-функциональных системах (ОФС). Понятие ритма является одним из главнейших в китайской медицине. Оно берет свое начало в глубокой древности и основывается на чередовании Янь и Инь, а также на смене сезонов, дня и ночи, лунных месяцев и т.д. Ритмы связаны с понятием времени: физическим, биологическим, под которым понимается соответствующая эволюция в филогенезе.
1.2. Теоретические основы хронобиологии
В настоящее время термином хронобиология принято обозначать самостоятельную междисциплинарную науку, собственно и занимающуюся колебательными процессами в организме. И поскольку все явления в живой природе испытывают ритмические колебания во времени, главным объектом хронобиологических исследований остаются биологические ритмы. Они представляют собой периодическое чередование каких-либо биологических событий, отделенных между собой во времени более или менее регулярными интервалами (Арушанян Э.Б., 2000).
В любом организме имеется большое количество биологических ритмов, составляющих основу временной организации и отличающихся не только функциональной принадлежностью, но и своими параметрами, значением, определенной соподчиненностью, поэтому временную организацию нельзя рассматривать как простую сумму составляющих ее ритмов, хотя каждый участвующий в ее образовании ритм является элементом временной организации (Романов Ю.А., 1985; Комаров Ф.И.; Рапопорт С.И., 2000).
Между тем, существует особый класс биологических ритмов – циркаритмы, и, прежде всего наиболее изученные из них циркадианные ритмы, – природа которых совершенно иная. Циркадианные ритмы не являются простым, пассивным ответом организма на суточные колебания внешних условий, но представляют собой эндогенные, активные, самоподдерживающиеся колебания, порождаемые в самой живой системе. Не являются они и простым следствием поддержания гомеостаза. Хотя гомеостатирование, как правило, создает колебания вокруг заданного уровня, амплитуда этих колебаний, в целях экономии регулирования, сводится к минимуму. Между тем, амплитуда циркадианного ритма поддерживается неизменно высокой. Циркадианные ритмы обеспечиваются специализированным механизмом – обособленным осциллятором, и в отличие от большинства других биологических ритмов представляют собой не побочный продукт, а самодостаточную ценность – отдельную особую функцию организма (Алпатов А.М., 1993).
Долгое время считалось, что циркадианные ритмы свойственны лишь эукариотам. Однако недавно циркадианные ритмы были обнаружены у цианобактерий (Kondo T. et al, 1994). Оказалось, что в культуре Synechococcus синтез многих полипептидов обнаруживает околосуточную зависимость. Примечательно, что циркадианные ритмы экспрессии генов поддерживаются даже в быстрорастущей культуре, где время между делениями значительно меньше суток.
Циркадианные ритмы столь же эндогенны, как ритмы дыхания и сердцебиения, как митотические циклы и спонтанные разряды нейронов. Подобно всем этим колебаниям, они способны менять частоту, подстраиваясь под внешние периодические воздействия. Главная особенность, основное отличие циркадианных ритмов – исключительная стабильность периода, постоянство фазы (Алпатов А.М., 1993; Комаров Ф.И., Рапопорт С.И., 2000).
Такая высокая стабильность циркадианных ритмов объясняется их значением: оптимизировать и приурочивать жизнедеятельность к наиболее благоприятному времени суток – так называемый «упреждающий гомеостаз» (Moore-Ede M., 1986), то есть возможность предвосхищать предстоящие изменения и заранее готовиться к ним, своевременно включать активные механизмы компенсации. Даже в тех случаях, когда приспособительное значение точной приуроченности активности не вполне очевидно, все же неоспоримо, что даже самые малые энергетические выигрыши, суммируясь ежедневно, со временем усиливаются многократно, и в конечном счете, обеспечивают преимущество в борьбе за выживание (Daan S., Aschoff J., 1982).
Циркадианные ритмы многих изученных функций складываются из околочасовых колебаний, которые, равно как и минутные, секундные биоритмы, лежат в сторону более высоких частот от циркадианных (Lloyd A., Rossi E., 1992; Бродский В.Я., Нечаева Н.В., 1994).
Околочасовые (ультрадианные) внутриклеточные ритмы открыты более 30 лет тому назад (Brodsky V., 1975, 1992; Бродский В.Я., Нечаева Н.В., Новикова Н.Т., 1994). Такие ритмы с периодами от 20 мин до 2 ч известны для многих свойств клетки: синтеза белка и его этапов, секреции, аксоплазматического тока, активности ферментов (изучено около 20 в разных клетках), концентрации АТФ и других аденилатов, включая цАМФ, полиаминов, дыхания клеток, рН цитоплазмы и др. Они найдены у бактерий, одноклеточных и в клетках различных беспозвоночных и позвоночных животных, а также у растений. Известны органные околочасовые ритмы. У позвоночных, например, это интегральные ритмы дыхания, частоты сердечных сокращений, температуры тела, активности мозга, концентрации гормонов в крови (около 10 примеров разных гормонов у различных животных и человека). Ритмы активности пищеварительной системы также имеют четкие околочасовые составляющие: таков ритм синтеза и выделения слюны, секреции ферментов поджелудочной железы, желчи, сокращений желудка и кишечника (Lloyd A., Rossi E., 1992).
Ряд свойств околочасовых ритмов приводят к выводу об их сходстве с детерминированными фракталами, хаотическими, но неслучайными колебаниями, отличающимися от беспорядочного шума определенной внутренней структурой очень разных на вид кривых. Свойства таких ритмов: значительная нерегулярность (вариабельность периодов), детерминированность, устойчивость к внешним воздействиям и способность к адаптивному ответу на периодические раздражители. Будучи нерегулярными, с внешне хаотически чередующимися разными периодами, околочасовые ритмы устойчивы по набору периодов. При существенных неспецифических воздействиях на клетки, например, при изменениях температуры среды, колебания сохраняются, и набор периодов изменяется мало («температурная компенсация») (Kippert F., Lloyd D., 1987; Сергеева Э.П. и соавт., 1988; Нечаева Н.В., Харазова А.Д., 1989; Lloyd A., Lloyd D., 1993).
Математическое обоснование отношений циркадианного и околочасовых ритмов одного признака дается в работе С.Л. Загускина и соавт. (1991), в которой отмечается возможность влияния на базовый циркадианный ритм через изменения околочасовых его составляющих.
В сторону более низких частот от циркадианных колебаний лежат инфрадианные (недельные, месячные), сезонные, годовые биоритмы.
На возможность существования многолетних биологических ритмов указывали исследования Н.Я. Пэрна (1925). На основании длительных наблюдений ученый установил, что у значительного числа людей проявляется ступенчатость жизни с «узловыми точками», или так называемыми пиками, в определенные возрастные периоды (Комаров Ф.И., Рапопорт С.И., 2000).
Многие известные специалисты в области спорта при изучении динамики спортивных результатов отмечали, что на достаточно высоком уровне спортивного совершенствования все же происходят временные спады и временная стабилизация результатов. По данным В.И. Шапошниковой (1969) у спортсменов более значительные приросты спортивных результатов происходят через два года на третий, а у спортсменок – через год. Был установлен и еще один интересный факт: варианты «мужского ритма» у спортсменок и «женский» - у спортсменов, особенно в период приближающийся к завершению спортивных выступлений. Это позволило предположить, что значительную роль в формировании данных ритмов играет эндокринная система (Шапошникова В.И. и соавт., 1996, 2000).
Многолетние биологические ритмы усиления ряда функциональных признаков у людей были обнаружены И.А. Комиссаровой (1981, 1986). Было установлено, что усилению функциональных возможностей предшествуют периоды скачкообразного прироста соматических признаков, а также, что биологические ритмы развития соматических признаков не совпадают по времени с ритмом развития функциональных признаков. В.Р. Левин (1969) высказал предположение о существовании 3-х годичных биологических ритмов, связанных с иммунными процессами организма.
J. Aschoff (1969) определил, что у человека существуют ритмы низких частот: 2,5 дня, 7 дней, 20 дней, 30 дней и 365 дней (недельные, месячные, годовые и промежуточные биоритмы).
A. Reinberg (1971), изучая динамику показателей метаболизма калия, отметил, что существует годовой эндогенный цикл. Было установлено, что биоритмы с годичным периодом наблюдаются в колебаниях пульса, температуры, плазматического кортизола, плазматического тестостерона, калия, 17-кортикостероидов мочи, половой активности и пищевых реакций.
По мнению В.И. Шапошниковой (1975), первый годовой эндогенный цикл у человека начинается в момент зачатия и завершается через 3 месяца после рождения. Кроме того, на проявление эндогенных годовых циклов оказывает определенное влияние окружающая среда (Шапошникова В.И., 1984). Влияние внешней среды начинает проявляться уже с момента зачатия организма. С.В. Кузнецова, Р.В. Учакина (1998) в своих исследованиях показали, что сезон года, в котором происходит зачатие, оказывает определенное воздействие на характер секреции гормонов.
По данным В.И. Шапошниковой (2000), для зрелого нейтрофила свойственно небольшое количество митохондрий и большое количество пероксидазосом, поэтому зрелый нейтрофил проявляет низкую активность СДГ и высокую активность НАДФН2-диафоразы. В связи с этим высокая активность НАДФН2-диафоразы и низкая активность СДГ в 4-й месяц после даты рождения будет указывать на химически дифференцированный нейтрофил, способный при всех прочих равных условиях эффективно продуцировать окись азота, регулируя тонус сосудов, и эффективно продуцировать перекись водорода, ингибируя бактерии, вирусы, грибы. К концу индивидуального года (8-10 месяцы) ситуация меняется: можно ожидать вялую регуляцию тонуса сосудов и понижение резистентности к инфекциям.
При рассмотрении месяцев рождения В.И. Шапошниковой (1984) было отмечено, что у практически здоровых индивидуумов уровень здоровья и работоспособности зависит не только от сезона года, но и от месяца индивидуального года.
1.3. Биологические часы и их характеристика
Биологическое время может отображать спираль с постоянно поступающим или возрастающим направлением, тогда как физическое время отображает движение по кругу. Понятие времени, измерение времени подводит к понятию биологических ритмов (Оранский И.Е., 1988).
Биологические часы регулируются внутренним, эндогенным источником ритмов, на который, несомненно, оказывают воздействие экзогенные ритмы, такие как, смена дня и ночи (солнечные), фазы Луны (лунные) и т.д. Экзогенные ритмы своим синхронизирующим действием определяют ритм эндогенного цикла. Эндогенные ритмы являются биологическими часами, характеризующими род, а также индивидуум. Экзогенные ритмы, действующие на эндогенные, являются синхронизаторами, роль которых заключается в постоянном контроле биологических часов, что позволяет организму лучше адаптироваться к условиям внешней среды. Под влиянием синхронизаторов микроорганизмы вырабатывают ритм, адаптированный к ритму макрокосма. Знание ритмов макрокосма необходимо для того, чтобы проводить полноценное и, самое главное, физиологически обусловленное лечение (Оранский И.Е., Царфис П.Г., 1989).
В подтверждение существования собственного времени у биологических систем можно привести следующие примеры. В 1959 г. американский хронобиолог F. Halberg ввел понятие циркадного ритма. Этот ритм является видоизменением суточного ритма с периодом 24 ч, он протекает в постоянных условиях, в частности в постоянной темноте и принадлежит к так называемым свободнотекущим ритмам, обладающим не навязанным им внешними условиями периодом. Такие ритмы считаются врожденными, эндогенными, обусловленными свойствами самого организма. Немецкий хронобиолог E. Bunning (1958) сообщил, что период циркадианных ритмов у растений равен 23-28 ч, а у животных – 23-25 ч. Но в связи с тем, что организмы обычно находятся в среде с циклическими изменениями ее условий, из которых наиболее важным является смена освещенности с периодом 24 ч (фотопериодичность), то период ритмов организма затягивается этими внешними изменениями и ритмы становятся суточными. Второй пример относится к изменениям периода суточного ритма бодрствования и сна у человека, который в обычных условиях смены освещенности равен 24 ч, но при нахождении людей в помещениях, экранированных от периодически изменяющихся внешних условий, в том числе от фотопериодичности и электромагнитного поля Земли, или у спелеологов, находящихся в лишенных естественного освещения пещерах, ритм сна становится свободнотекущим, а его период занимает время, превышающее 24 ч (до 56 ч). Установлено, что темп и степень увеличения периода ритма индивидуальны (Комаров Ф.И., Рапопорт С.И., 2000).
Н.И. Моисеева (1975, 1980) предложила гипотезу трехмерности индивидуального биологического времени, составляющегося из последовательности течения времени, сосуществовании времени, означающим набор одновременно происходящих в организме событий с той или иной временной протяженностью, и его величины, отражающей продуктивность каждого мгновения в общем балансе времени. Время живых организмов обладает одновременно векторностью и повторяемостью. Живые системы сосуществуют одновременно и как индивидульные особи, и как единицы сложной системы, что обуславливает возникновение масштабности времени. Биологическое время неравномерно. Это выражается в переменной скорости течения процессов и альтернативном дискретном переходе организма от одного вида деятельности к другому.
Об индивидуальности течения биологического времени у людей свидетельствуют данные, полученные при определении длительности индивидуальной минуты. По материалам А.В. Киреева (1984), длительность индивидуальной минуты у людей 19-20-летнего возраста неодинакова в разное время суток. Она наибольшая (69,9 с) в 8 ч и наименьшая (52,9 с) в 20 ч. У лиц 68-92-летнего возраста суточные колебания величины индивидуальной минуты исчезают, а среднесуточное ее значение меньше, чем у молодых на 11,56 с. Н.И.Моисеева с соавт. (1985) обнаружили, что, если у хорошо адаптирующихся лиц суточный ритм длительности индивидуальной минуты выражен, то у плохо адаптирующихся его практически нет, а различия в среднесуточной величине их индивидуальной минуты небольшие (4%). Н.Н. Брагина, Т.А. Доброхотова (1988) считают, что наряду с временными характеристиками внешнего социального и физического мира надо допустить существование индивидуального времени каждого человека и организацию его психических процессов.
Поиск в головном мозге биологических часов, ответственных за организацию суточного периодизма был начат в середине 60-х годов прошлого века К. Рихтером. Практически одновременно и независимо друг от друга сотрудники 2-х американских лабораторий в 1972 г. пришли к выводу, что локализованы такие «часы» в супрахиазматических ядрах гипоталамуса. Установлено, что импульсная активность нейронов супрахиазматических ядер, даже в опытах на переживающих срезах, обнаруживает четкую связь с фазами суточного цикла. Супрахиазматические ядра расположены в переднем гипоталамусе центральнее 3-го желудочка в виде небольших парных образований, лежащих над зрительной хиазмой. Согласно многочисленным морфологическим данным, в ядрах можно выделить ростральный и каудальный отделы. Последний, состоящий из мелкоклеточной дорсомедиальной и крупноклеточной вентролатеральной порций, гетерогенен не только структурно, но и нейрохимически, к тому же обе его части различаются по набору афферентных и эфферентных связей (Meijer J., Rietveld W., 1989). Посредством современных методических приемов убедительно аргументированы широкие связи супрахиазматических ядер с центрами головного мозга, которые участвуют в регуляции эмоционально-мотивационного поведения, моторики, деятельности эндокринных механизмов (Moore R., 1997).
У животных циркадианный осциллятор обособлен морфологически. Многие беспозвоночные имеют осцилляторы в глазах и оптических долях мозга. У млекопитающих, как отмечалось выше, главный циркадианный осциллятор находится в супрахиазматических ядрах гипоталамуса. Супрахиазматические ядра у млекопитающих состоят из порядка 10 тысяч специализированных нейронов-«часов», которые поддерживают эндогенный циркадианный ритм частоты разрядов и, сообща, вовлекают остальные функции организма в циркадианную ритмичность (Hastings M., 1997).
У всех без исключения позвоночных имеется «циркадная ось»: сетчатка – эпифиз – супрахиазматические ядра. У позвоночных до млекопитающих эпифиз часто совмещает функции фоторецептора и циркадианного осциллятора (Menaker M. et al, 1997). У млекопитающих эпифиз утратил функцию главного осциллятора, ее переняли супрахиазматические ядра.
В современной хронобиологии существует две основные модели функциональной деятельности супрахиазматических ядер: моно- и полиосцилляторная.
Согласно первой, развиваемой R. Moore et al. (1989), супрахиазматические ядра могут выступать в роли первичного осциллятора – ритмзадающего механизма для всей циркадианной системы организма в целом. При этом они задают темп колебаний мозговым структурам-посредникам со вторичными осцилляторными свойствами, с помощью которых необходимые команды в дальнейшем поступают к исполнительным органам.
По мнению M. Moore-Ede (1986), в головном мозге, помимо супрахиазматических ядер, существует еще один первичный осциллятор, контролирующий суточный ритм ряда физиологических функций независимо от ядерного аппарата гипоталамуса (полиосцилляторная модель). Оба пейсмейкера (локализация второго до сих пор неизвестна) отвечают за контроль подчиненных только им вторичных осцилляторов, расположенных в различных тканях и клетках организма. Базирующаяся на фотопериодизме информация о времени от супрахиазматических ядер может, по-видимому, передаваться различным циркадианным подсистемам, каждая из которых осуществляет ритмическое колебание той или другой функции (Арушанян Э.Б., 2000).
По Я.Ф. Аскину (1971), временную структуру процессов отражает категория «ритм». Ритм представляет собой характеристику периодической временной структуры. Ритмичность характеризует как определенный порядок во временной последовательности, так и длительность отрезков времени, поскольку содержит чередование фаз различной продолжительности.
1.4. Биологические ритмы, их характеристика и классификация
Биологические ритмы – циклические колебания интенсивности и характера биологических процессов и явлений в организме. Биоритмы наблюдаются почти у всех животных и растений, как одноклеточных, так и многоклеточных, у некоторых изолированных органов и отдельных клеток. На разных уровнях организации живой материи существует огромное множество биоритмов с периодами от долей секунды до десятков лет. Одни биоритмы (биение сердца, частота дыхания и т.д.) относительно самостоятельны и называются чаще физиологическими ритмами, другие – собственно биологические ритмы — дают возможность организмам приспосабливаться к циклическим изменениям окружающей среды (суточным, сезонным и др.).
Биологический ритм — не только непосредственная реакция на изменения внешних условий. Он сохраняется в искусственных условиях — при постоянном освещении, температуре, влажности и атмосферном давлении, причём продолжительность каждого периода биоритма в таких условиях почти не зависит от интенсивности обменных процессов. Например, на суточный ритм спорообразования некоторых водорослей не влияют химические вещества, тормозящие обменные процессы; массовое вылупление мух дрозофил повторяется в темноте через каждые 24 ч и не зависит от температуры (при колебаниях её в пределах от 16 до 26 °С); в аквариуме длительно сохраняется лунная периодичность открывания створок морских моллюсков; всхожесть семян, хранящихся в темноте и при постоянной температуре (в пределах от -22 до +45 °С), отчётливо меняется соответственно сезону.
По мнению Б.С. Алякринского (1983), биологические ритмы являются факторами естественного отбора и тем самым факторами адаптации, поскольку отбор, по сути дела, есть самый универсальный, самый общий ее механизм.
В каждом ритме различают период – длительность одного цикла до первого повтора. Эта величина – длительность периода – важнейшая характеристика ритма. Кривая ритма любой живой системы представляет собой условное изображение непрерывного движения, и каждая точка на этой кривой есть условное изображение тех состояний, через которые она проходит, никогда не задерживаясь. Каждая точка на кривой ритма, т.е. фактически мгновенное состояние, через которое проходит некоторая функция, называется фазой. В биоритмологии особое значение придается так называемым акрофазам, т.е. тем моментам, когда регистрируемый процесс достигает крайних значений: максимума и минимума. Понятие "фаза" часто используется как обозначение точки отсчета при анализе временной последовательности событий. В качестве таких точек отсчета принимают начало сна или момент пробуждения, начало работы и др. При смещении этих точек во времени говорят о сдвиге фазы. Так, сдвиги фазы характерны при перевозке животных в другой временной (новый часовой) пояс или для сменного режима работы у людей.
Очень важной характеристикой биологического ритма является амплитуда ритмического процесса. К числу категорий биоритмов относят и зону "блуждания" фазы, точнее акрофазы. Если в течение, например, ряда суточных циклов отмечать на шкале времени положение акрофазы (максимума или минимума) ритма какой-либо функции, то это положение варьирует в некотором диапазоне, который и называется зоной блуждания фазы (акрофазы). Масштаб зоны блуждания фазы характеризует фазовый угол. При четкой согласованности ритмов по фазе говорят о синхронизации, а в случаях рассогласования во времени – о десинхронизации или десинхронозе. Поддержание ритмических процессов зависит от датчиков времени – синхронизаторов, которые могут быть физическими или социальными (Арушанян Э.Б., 2000).
Существует множество классификаций биологических ритмов.
Ю. Ашофф (1984 г.) подразделил ритмы:
1. по их собственным характеристикам, таким как период (минутные, суточные, недельные, месячные, сезонные, годовые, 5-летние и т.д.);
2. по их биологической системе, например популяция (ритмы популяции);
3. по роду процесса, порождающего ритм (экзогенные, эндогенные);
4. по функции, которую выполняет ритм (ритмы сна, ритмы размножения и т.д.).
Наиболее распространена классификация биологических ритмов по частотам колебаний (F. Hallberg), т.е. по величине, обратной длине периодов ритмов. F. Hallberg подразделяет ритмы по зонам:
I. Высокочастотная зона - ультрадианные ритмы (длина периода до 20 ч);
II. Среднечастотная зона – циркадные ритмы (длина периода 20-28 ч), инфрадианные ритмы (28-72 ч);
III. Низкочастотная зона – циркасептанные (длина периода 7±3 суток), циркадисептанные (14±3 суток), циркавигинтанные (20±3 суток), циркакатригинтанные (30±3 суток), цирканнуальные ритмы (12±2 месяцев)
Согласно классификации Н.И. Моисеевой и В.Н. Сысуева (1961) выделяет пять основных классов биоритмов:
1. Ритмы высокой частоты: от доли секунды до 30 мин (ритмы протекают на молекулярном уровне, проявляются на ЭЭГ, ЭКГ, регистрируются при дыхании, перистальтике кишечника и др.).
2. Ритмы средней частоты (от 30 мин до 28 ч, включая ультрадианные и циркадные продолжительностью до 20 ч и 20 - 23 ч соответственно).
3. Мезоритмы (инфрадианные и циркасептанные около 7 сут продолжительностью 28 ч и 6 дней соответственно).
4. Макроритмы с периодом от 20 дней до 1 года.
5. Метаритмы с периодом 10 лет и более.
Многие авторы выделяют также ритмы по уровню организации биосистем (клеточные, органные, организменные, популяционные), по форме колебаний (импульсные, синусоидальные, релаксационные, смешанные), по зависимости от экзогенных колебаний (солнечно-суточные, лунно-суточные, лунно-месячные, годичные и т.д.).
Солнечно-суточный (24 ч)ритм свойствен большинству физиологических процессов (частоте деления клеток, колебаниям температуры тела, интенсивности обмена веществ и энергии у животных и человека и др.). Он проявляется в состоянии жизненных систем и поведении живых организмов, при этом меняется двигательная активность животных, положение листьев и цветочных лепестков у растений, расходование гликогена в печени млекопитающих и другие биохимические процессы.
У животных обнаружены нейро-гуморальные центры, координирующие суточную периодичность физиологических процессов. В зависимости от количества периодов активности в течение суток различают монофазный и полифазный суточные ритмы. В течение индивидуального развития (онтогенеза) многих животных и человека происходит переход от полифазного ритма к монофазному (например, для грудных детей характерно многократное чередование бодрствования и сна в течение суток).
Главными отправными точками суточного цикла являются восход и заход Солнца, в меньшей степени полдень и полночь. На восходе Солнца происходит активация деятельности так называемых "дневных" ОФС. Поэтому летом шесть "дневных" органов будут проявлять свою активность в течение более длительного интервала, чем 12 часов, а "ночные" будут вынуждены "довольствоваться" соответственно меньшим отрезком времени. Зимой наблюдается обратная картина (Оранский И.Е., 1988).
Для каждого органа (ОФС) в традиционной китайской медицине определяется свой пик активности. В эти временные рамки ОФС наиболее восприимчива к внешним воздействиям. И все процедуры, включая иглотерапию, ароматерапию и др. китайские лекари стремились проводить именно в этот период. Так, по данным И.Е. Оранского (1988), пик активности толстого кишечника у человека приходится на 5-7 ч, желудка – на 7-9 ч, тонкого кишечника – на 13-15 ч.
Лунно-суточный (24,8 ч), или приливный, ритм типичен для большинства животных и растений прибрежной морской зоны и проявляется совместно с солнечно-суточным ритмом в колебаниях двигательной активности, периодичности открывания створок моллюсков, вертикальном распределении в толще воды мелких морских животных и т.п. Солнечно- и лунно-суточный ритмы, так же как и звёздно-суточный (23,9 ч), имеют большое значение в навигации животных (например, перелётных птиц, многих насекомых), «использующих» астрономические ориентиры.
Лунно-месячный ритм (29,4 сут) соответствует периодичности изменения уровня морских приливов и проявляется в ритмичности вылупления из куколок насекомых в прибрежной зоне, в цикле размножения червя палоло, некоторых водорослей и многих других животных и растений. Близок лунно-месячному ритму и менструальный цикл женщин.
Годичный (сезонный) ритм изменения численности и активности животных роста и развития растений широко известен. Годичные ритмы у животных и растений во многих случаях регулируются изменениями длины светового дня (фотопериодизм), температуры и других климатических факторов.
Биологические ритмы, совпадающие по кратности с геофизическими ритмами, называются адаптивными (экологическими). К ним относят суточные, приливные, лунные и сезонные ритмы. В биологии адаптивные ритмы рассматриваются с позиций общей адаптации организмов к среде обитания, а в физиологии с точки зрения выявления внутренних механизмов такой адаптации и изучения динамики адаптации в различные периоды.
Физиологические ритмы – циклические колебания в различных системах организма. Они составляют основу жизни. Одни ритмы поддерживаются в течение всей жизни, и даже кратковременное их прерывание приводит к смерти. Другие появляются в определенные периоды жизни индивидуума, причем часть из них находится под контролем сознания, а часть протекает независимо от него. Ритмические процессы взаимодействуют друг с другом и с внешней средой.
Изменение ритмов, выходящих за пределы нормы, либо появление их там, где они раньше не обнаруживались, связано с болезнью.
Физиологические ритмы являются одной из основных форм проявления жизнедеятельности, наблюдаются у всех живых организмов и на всех уровнях организации живой материи от субклеточных структур до целостного организма. Они, как правило, не являются строго периодическими колебаниями: в определенных пределах меняется их период, амплитуда, форма, уровень. Примером их могут служить записи некоторых физиологических ритмов у человека: электрокардиограмма, сфигмограмма сонной артерии, пневмограмма, электроэнцефалограмма, суточная периодика частоты дыхания, суточная периодика экскреции калия с мочой.
Наиболее близки к периодическим колебаниям физиологические ритмы, которые возникают при усвоении организмом ритмичных внешних сигналов (например, световых мельканий), различные адаптивные ритмы.
Физиологические ритмы характеризуются широким спектром частот; их период варьирует от десятитысячных долей секунды до нескольких лет. Часто один и тот же показатель одновременно участвует в нескольких видах колебательных изменений (например, пульсовые, дыхательные и суточные изменения артериального давления, волны различной частоты на ЭЭГ). Характерные для одной системы ритмы могут передаваться другой (например, изменения частоты сердечных сокращений в ритме дыхания). Физиологические ритмы могут быть замаскированы апериодическими колебаниями исследуемого показателя (шумами) и другими ритмическими колебаниями, форма их часто бывает сложной. Поэтому разработаны специальные методы анализа, позволяющие выявлять и изучать скрытую периодичность физиологических процессов (гармонический анализ, автокорреляционный анализ, скользящее суммирование и др.).
Большинство физиологических ритмов связано с чередованием различных функциональных состояний соответствующих систем (например, сокращение и расслабление мускулатуры, сон и бодрствование). Поэтому в различные фазы колебательного процесса отмечается разная реакция на внешние воздействия: разное направление смещения фазы суточного цикла при действии датчика времени в различные его моменты, отсутствие реакции на раздражение в рефракторный период и т.п.
Адаптивные физиологические ритмы выработались в процессе эволюции как форма приспособления организмов к циклически меняющимся условиям среды. Наиболее изучены околосуточные (циркадные) ритмы, циркадные ритмы отражают периодичность геофизических факторов, обусловленную вращением Земли вокруг своей оси. В течение суток закономерно изменяется, прежде всего, естественное освещение. Суточным колебаниям подвержены цикл день-ночь, температура и влажность воздуха, напряженность электрического и магнитного поля Земли, потоки разнообразных космических факторов, падающих на Землю в конкретный временной цикл. Под влиянием этих внешних факторов совершалась эволюция всех форм жизни на Земле, колебания их в настоящее время, как и миллионы лет назад, играют жизненно важную роль для всех без исключения обитателей Земли. Например, для дневных животных восход Солнца сигнал для активной деятельности: добывания пищи, строительства жилья, выращивания потомства, а с наступлением темноты активизируются животные, ведущие ночной образ жизни. И все животные адаптируются к этому суточному ритму.
Адаптация конкретного организма или видовая адаптация к внешним условиям в широком биологическом смысле это синхронизация жизненных процессов (ритмов) организма или целой популяции с внешними ритмами, таким образом, циркадная периодичность жизненных функций является врожденным свойством. Спонтанные циркадные ритмы обнаружены едва ли не у каждого вида живых существ. Возможное исключение составляют обитатели океанских глубин и подземных пещер, а также прокариоты (бактерии и сине-зеленые водоросли, клетки которых не имеют оформленного ядра и митохондрий).
Циркадные колебания обычно наблюдаются у более организованных одноклеточных организмов и в изолированных тканях многоклеточных организмов, тем не менее, и у позвоночных, и у беспозвоночных животных часть нервной системы обычно играет роль циркадного ритмоводителя для всего организма. Мишель Менакер с сотрудниками показал, что у некоторых птиц эту функцию выполняет эпифиз, ритмично выделяющий гормон мелатонин. Деятельность эпифиза регулируется светом, проникающим сквозь теменную часть черепа. У воробья даже удается сдвинуть фазу циркадного ритма, пересадив ему эпифиз птицы, живущей в иной временной зоне.
У грызунов эпифиз выделяет мелатонин тоже ритмично, но под контролем двух скоплений нейросекреторных клеток супрахиазменных ядер, расположенных слева и справа в гипоталамусе, над перекрестием зрительного нерва. Информация о свете и темноте идет от глаз. Ежедневные порции мелатонина синхронизируют циркадные колебания. У обезьян подобную роль играют супрахиазменные ядра. У людей с травмами в этой области гипоталамуса наблюдается расстройство ритма, что позволяет предполагать сходную роль супрахиазменных ядер и у человека. Фазу ритмов этих ядер можно сдвинуть светом через зрение, электрическим раздражителем, инъекцией в мозг аналога нейромедиаторов, вызывающих нормальные разряды нейронов, а также мелатонином. Секреция эпифизом мелатонина стимулируется психомиметиками (ЛСД, мескалин, кокаин) и подавляется препаратами, используемыми для лечения психозов. Недавно выяснилось, что антидепрессант бензодиазепин подстраивает фазу циркадных часов у грызунов, действуя на нейромедиаторы в супрахиазменных ядрах гипоталамуса. Это указывает на некую связь между психическими заболеваниями и расстройствами циркадных ритмов, особенно между депрессией и нарушением сна. Человеку для подавления секреции мелатонина требуется гораздо больше света, чем другим млекопитающим. Если бы циркадные ритмы человека реагировали на тусклое освещение, они должны были бы быть в постоянном разладе, и люди, помимо других проблем, постоянно испытывали бы дополнительный стресс.
Для организма человека характерно повышение в дневные и снижение в ночные часы физиологических функций, обеспечивающих его физическую активность (частоты сердечных сокращений, минутного объёма крови, артериального давления, температуры тела, потребления кислорода, содержания сахара в крови, физической и умственной работоспособности и др.). В обычных условиях наблюдаются определенные соотношения между фазами отдельных околосуточных ритмов. Поддержание постоянства этих соотношений обеспечивает согласование функций организма во времени, обозначаемое как внутреннее согласование. Помимо этого, под действием меняющихся с суточной периодичностью факторов среды (синхронизаторов, или датчиков времени) происходит внешнее согласование циркадных ритмов. Различают первичные (имеющие основное значение) и вторичные (менее значимые) синхронизаторы. У животных и растений первичным синхронизатором служит, как правило, солнечный свет, у человека им становится также социальные факторы.
Динамика околосуточных физиологических ритмов у человека и высших животных обусловлена не только врожденными механизмами, но и выработанным в течение жизни суточным стереотипом деятельности. Имеющиеся данные о возможности рассогласования по частоте отдельных циркадных ритмов дают возможность предположить существование целого ряда относительно независимых осцилляторов, каждый из которых регулирует ритм определенной, широко разветвленной функциональной системы. В многоклеточных организмах центральные регуляторы не возбуждают колебаний в периферических тканях, а только синхронизируют присущие каждой клетке организма циркадные ритмы по частоте и фазе. Регуляция физиологических ритмов у высших животных и человека осуществляется в основном гипоталамо-гипофизарной системой.
Циркадный механизм не универсален. Он различается в зависимости от биологического вида или даже от типа клеток у одного организма. Полагают, что циркадный механизм замыкается именно на уровне клетки в отличие, например, от менструального цикла, включающего нервные и эндокринные взаимодействия многих тканей. Клеточные механизмы можно изучать методами биохимии и генной инженерии. Существует множество биохимических способов воздействия на работу циркадных часов. Сначала использовались преимущественно световые импульсы. Так, для дрозофилы постоянного освещения даже на уровне света неполной Луны достаточно, чтобы остановить ход часов. При этом свет действует опосредованно, а не прямо на молекулы колебательного механизма. У большинства циркадных ритмов период почти совсем не зависит от уровня температуры, если только она остается в физиологически допустимых пределах. Более того, циркадные часы в отличие от подлинных независимых (по температуре) систем не защищены от перепадов температуры: малейшее изменение последней способно сдвинуть их фазу. Помимо света и перепадов температуры на период влияют многие химические вещества, изменяющие проницаемость мембран и нарушающие синтез белка. Их кратковременное введение приводит к сдвигу фазы. Однако затрагиваемые при этом процессы многочисленны и многообразны, и не ясно, чем может быть опосредовано их влияние на ход часов. Вероятно, ни сам АТФ, ни процесс его синтеза и распада не являются деталями механизма часов. То же можно сказать и о синтезе белков.
В другую очень важную группу биологических ритмов, имеющих огромное значение для высших и низших организмов, входят сезонные (околосезонные), годичные ритмы, обусловленные вращением Земли вокруг Солнца. Сезонные изменения растительного покрова Земли, миграция птиц, зимняя спячка ряда видов животных это примеры ритмов с годичным периодом. Сезонные колебания жизненных функций характерны и для человека. Так, в регионах с сезонными контрастами климата интенсивность обмена веществ выше зимой, чем летом. Холод является адекватным стимулятором функции щитовидной железы. Артериальное давление, количество эритроцитов, гемоглобина обычно ниже в жаркое время года. Весной и летом у большинства людей работоспособность выше, чем зимой. Пик выдающихся спортивных достижений приходится на весенне-летний и ранний осенний периоды. Хорошо известно волнообразное течение многих заболеваний, при котором периоды обострения сменяются длительными ремиссиями, так, туберкулез человека обостряется весной, а язвенная болезнь желудка и двенадцатиперстной кишки весной и осенью. В осенне-зимний и весенний периоды выявляют наибольшее число первичных больных инсулинзависимым сахарным диабетом.
Сезонные колебания физиологических показателей у многих теплокровных в определенной мере повторяют суточные: в зимний период отмечается понижение обмена и двигательной активности, в весенне-летний активизация физиологических процессов.
Известный терапевт М.Н. Кончаловский еще в 1935 г. писал: "Если пристальнее всмотреться в эволюцию и течение болезней, то очень часто можно заметить волнообразное течение, т.е. приступы, пароксизмы, кризы, которые сменяются относительным покоем, когда видимые признаки уходят, и больной чувствует себя относительно хорошо и нередко даже обращается к труду. Врачи, подобно морякам, которые знают о периодически наступающих бурях при равноденствиях, должны знать, что болезни имеют волнообразное течение, что окончание приступа и криза не есть окончание болезни, что ремиссия это временная передышка, а не выздоровление". Как точно, образно и глубоко звучит эта фраза и для современной медицины! Хорошо известна периодичность эпидемий, и глубоко изучены истоки и генезис этой ритмичности.
Австрийский психолог Герман Свобода, немецкий врач Вильгельм Фисс и австрийский инженер Альфред Тельчер в конце XIX и начале XX века создали известную концепцию о трех ритмах, согласие которой человеку присущи особые ритмы: 23 - суточный (физический), 28 - суточный (эмоциональный) и 33- суточный (интеллектуальный). Отношение к ней спорное.
Краткая суть этой концепции:
- Все три ритма возникают одновременно в момент рождения, или же в момент самого зачатия образования зиготы.
- Все три ритма имеют строго синусоидальную форму, не изменяющуюся на протяжении всей жизни человека, и, следовательно, неизменную частоту, т.е. длительность периода.
3. Положительная часть каждой синусоиды (полуволна, расположенная выше так называемой нулевой линии, горизонтали, проведенной по середине между максимумами и минимумами) соответствует периодам подъема физической, эмоциональной и умственной активности, а отрицательная её часть (полуволна, расположенная ниже указанной горизонтали) характеризуется периодом упадка, снижения этих видов активности. В дни подъема физических сил спортсмены достигают максимальных результатов, в дни спада результаты минимальные. Аналогичное волнообразное течение претерпевает эмоциональный интеллектуальный потенциал человека. В положительной полуволне эмоционального ритма господствуют оптимистические настроения, чувство уверенности в себе, мир представляется прекрасным; в отрицательной полуволне эмоциональная жизнь смещается в минорную фазу.
Интеллектуальные подъемы и спады колеблются в пределах 33-суточного ритма. Дни перехода положительной части каждой синусоиды трех типов в отрицательную, т.е. точку пересечения синусоиды с нулевой волной, отмечены резким снижением "надежности" организма и его устойчивости к любым негативным воздействиям. Такие дни называются критическими или нулевыми. Считают, что именно в эти дни чаще всего допускаются разнообразные ошибки в производственных и бытовых ситуациях, причем опасность появления ошибок возрастает в двойные критические дни, когда в одной точке на уровне нулевой линии пересекаются одновременно две синусоиды. Но наиболее опасными являются тройные критические дни, соответствующие взаимному пересечению сразу трех синусоид и нулевой линии.
Итак, согласно гипотезе, все три ритма заложены у человека с момента рождения или зачатия и затем на протяжении жизни сохраняют абсолютное постоянство синусоидальной формы и частоты (23, 28 и 33 сут).
Б.С. Алякринский и С.И. Степанова (1985) дают критический анализ материальной природы этой концепции. Сама жизнь как постоянно меняющееся движение исключает заданные с момента рождения (или даже до него) неизменные по периоду три ритма. Между тем известно, что в течение жизни значительно меняется ритм многих жизненных функций (сердечно-сосудистой, репродуктивной, костно-мышечной и др.), изменяются реакции организма на экстремальные воздействия и др. Поэтому придание трем ритмам предельной стабильности на протяжении всей жизни без учета возраста, пола, типа нервной системы явно противоречат способностям человеческого организма к исключительной, феноменальной пластичности, адаптации и выживанию, казалось бы, в невероятных экстремальных ситуациях. Совершенно справедливо замечание Б.С. Алякрниского и С.И. Степановой о том, "...что самая малая доля эндогенности в природе этих ритмов исключала бы приписываемую им статичность. Ведь эти ритмы образно можно представить себе как бы отлитыми из предельно прочного, не знающего разрушения материала и поэтому обладающими абсолютной жесткостью и в то же время надежно вмонтированными в живую систему, не знающую такой жесткости ни в своих частях, ни в целом". Следовательно, концепция эндогенной природы трех ритмов практически не имеет серьезных аргументов.
В постоянных условиях, т.е. при максимально возможном исключении действия синхронизаторов на человека, обычно происходит изменение периода околосуточных колебаний, а в некоторых случаях наступает рассогласование (десинхронизация) околосуточных ритмов по частоте. Десинхронизация наблюдается при быстрых перелётах в другие поясные зоны, при работе в ночную смену, в полярных широтах. Повторные нарушения привычного суточного распорядка могут оказать неблагоприятное действие на здоровье человека. Десинхронизация – один из патогенетических механизмов неблагоприятного действия некоторых факторов среды и изменённого режима жизнедеятельности на организм человека.
Человеческое тело представляет собой сложную систему, организованную во времени и пространстве. При многих заболеваниях нормальная организация нарушается и заменяется аномальной динамикой. Болезни, характеризующиеся аномальной временной организацией, называются динамическими болезнями.
Вся наша повседневная жизнь строго укладывается в 24-часовые рамки, в том числе и интенсивность физиологических функций, колеблется в соответствии с наиболее заметным циклом чередования сна-бодрствования.
Например, ежедневное повышение и снижение порога болевой чувствительности наших зубов. Во второй половине дня порог болевой чувствительности зуба в полтора раза выше, а онемение в результате анестезии продолжается в несколько раз дольше, чем ночью. Удержание алкоголя в крови быстро возрастает примерно после 10 часов утра. Поэтому идти на прием к стоматологу лучше после обеда. Эффективность обезболивания максимальна тоже вскоре после полудня: доза наркоза, необходимая утром, днем может оказаться избыточной. Аллергические реакции возникают быстрее и проявляются тяжелее в начале ночи, чем в полдень. Печень удерживает низкий уровень алкоголя в крови вечером гораздо лучше, чем утром.
Поставить диагноз значительно проще, зная клиническую норму с учетом её ритмичности. Аддисонова болезнь (бронзовая болезнь) и болезнь Иценко-Кушинга обусловлены нарушением функции надпочечников (соответственно недостаточностью и избыточностью), поэтому для их диагностики требуется измерять уровень гормона кортизола (гидрокортизона) в крови, но с учетом времени забора крови. Диагноз и терапевтические меры могут быть более эффективными, если их строить на основе циркадного цикла. Многие типы делящихся клеток предпочитают определенное время суток для репликации ДНК, поэтому циркадные вариации особенно ярко проявляются в токсичности различных лекарственных препаратов и эффектах облучения с целью поразить делящиеся опухолевые клетки. Эрхард Хаус с коллегами добился значительного повышения процента выживания среди мышей, больных раком, не увеличивая дозу лекарства, а сконцентрировав её в то время суток, когда опухолевые клетки предположительно более чувствительны, чем нормальные.
При применении гормональной терапии важно тоже правильно выбрать время для введения препарата, так, при недостаточности функции надпочечников больным обычно делают инъекции кортизона по утрам, когда в норме активность коры надпочечников максимальна. Введение кортизона в иное время суток будет подавлять деятельность и без того ослабленных надпочечников.
Во многих клинических ситуациях используется в качестве терапевтического воздействия на пациента периодическая стимуляция. Например, введение лекарств и использование электронных сердечных пейсмекеров и механических вентиляторов, для повышения эффективности терапевтического действия которых были разработаны датчики, устанавливающие обратную связь между пациентом и механическим регулятором дыхания или сердцебиения. Эта связь позволяет облегчить управление этими приборами и избежать, опасной конкуренции между навязанным ритмом и внутренними ритмами.
У некоторых больных диабетом могут возникнуть трудности в установлении соответствующего графика введения инсулина. У этих больных периодическое введение инсулина в соединении с регулярным приемом пищи и режимом физической нагрузки оказывается неэффективным для поддержания уровня глюкозы в крови в нормальных пределах. Вместо этого могут быть нерегулярные флуктуации (например, при слежении за уровнем глюкозы в крови после его повышения). Для таких пациентов необходимо разрабатывать схемы введения инсулина, основанные на данных о текущем уровне сахара в крови и понимании динамики системы его регуляции.
John Milton из Монреальского нейрологического института предположил подавлять тремор с помощью периодической стимуляции. Этот эффект был бы аналогичен подавлению колебаний в сердечных клетках периодическими деполяризующими стимулами. Подобным образом упорядоченное во времени медикаментозное лечение способствовало бы подавлению припадков у эпилептиков с регулярной цикличностью заболевания.
Другой клинически важный случай взаимодействия между эндогенными и экзогенными ритмами связан с суточной периодичностью. Циркадные ритмы часто изменяются у людей с эмоциональными расстройствами. Появилась попытка лечить таких больных, восстанавливая нормальные фазовые соотношения между собственным циклом сна и бодрствования и нормальным 24-часовым циклом. Фазовый сдвиг циркадных часов может осуществляться световым режимом, небольшими изменениями в режиме сна, навязываемыми в течение нескольких дней, и с помощью лекарств. Изменения в циркадном ритме могут быть одним из проявлений, а не причиной эмоционального расстройства, так что устранение циркадных нарушений не осязательно будет производить лечебный эффект. Установление факта, что бензодиазепины могут влиять на циркадные ритмы у хомяков, навело на мысль о возможности уменьшения влияния поясных сдвигов во времени при перелетах на реактивных самолетах соответствующим введением лекарственных веществ, приводящим к фазовому сдвигу циркадного ритма. Но установить необходимые дозы и графики приема лекарств пока невозможно.
Сезонные и другие адаптивные виды ритмов также не являются простой реакцией на циклические изменения среды обитания, а характеризуются определенной эндогенностью. Учет физиологических ритмов необходим при составлении рационального режима труда и отдыха человека, при выборе времени приема лекарств, особенно гормональных препаратов. Физиологические ритмы имеют и определенное диагностическое значение в клинике, физиологии труда и спортивной медицине: при различных заболеваниях и переутомлении отмечается их нарушение.
Многие заболевания человека характеризуются необычной и сложной динамикой. Анализ механизмов, лежащих в основе таких заболеваний, неизбежно связан с теоретическим анализом наблюдаемой динамики. Методы изучения этих проблем заключаются в формулировании теоретических и биологических моделей болезни. Далеко идущей целью исследователей является помощь в разработке новых диагностических и терапевтических стратегий в лечении людей.
1.5. Хронофармакология
По мнению президента Международного общества хронобиологов (WCBA) F. Halberg (1973) медицина, равно как и ветеринария, вплотную приблизились к концепции хронопсии (от греч. chronos – время, opsis – рассмотрение), т.е. к рассмотрению всех процессов в организме человека и животных «в проекции» на определенные процессы времени. Лечение и профилактика также должны строиться на хронобиологической основе (Арушанян Э.Б., 2000).
Исследованием зависимости действия лекарственных средств от состояния биоритмических процессов, равно как и обратной задачей – оценкой влияния лекарств на колебательные явления занимается хронофармакология. Ее усилия направлены на изучение хронестезии – ритмических изменений во времени чувствительности к лекарственным веществам и хронокинетики – учет фактора времени в фармакокинетике препаратов. Ряд авторов отмечают ведущую роль фазы собственного биоритма органа или системы-мишени в различии чувствительности к лекарственным воздействиям. Другие исследователи акцентировали внимание на влияние фармакологических препаратов в отношении собственных ритмов организма (Rietveld et al., 1993). Высказывается мнение о том, что фармакодинамика различных лекарств является «функцией фазы» биологического времени макроорганизма (Заславская Р.М., 2000).
Наслаиваясь во времени на естественные и патологически измененные флюктуации физиологических функций, эффект лекарственных веществ приобретает определенную периодичность. Для определения этого нестационарного состояния А. Reinberg (1971) выделяет 3 направления:
1) хронофармакокинетика веществ, предусматривающая изучение ритмических изменений биодоступности, фармакокинетики и экскреции веществ;
2) хронестезия биосистем к веществам, т.е. ритмические изменения чувствительности различных систем к веществу;
3) хроэнергия веществ, т.е. хронофармакокинетика и хронестезия заинтересованных систем и хроноэффективность препаратов. Разработка этого аспекта предполагает изучение ритмических изменений в эффектах биосистем и в эффективности различных веществ.
Хронестезия по А. Reinberg (1971), может определяться временными колебаниями чувствительности к лекарственным веществам на молекулярном, клеточном, тканевом, органном, организменном уровнях. Выраженность хронестезии зависит от различных эндогенных и экзогенных факторов. Все они на молекулярном уровне, в конечном счете, меняют содержание, либо активность рецепторов, специфически реагирующих на лекарство. Среди эндогенных факторов наиболее значимыми представляются автономные ритмические сдвиги внутриклеточного метаболизма, обнаруживающие флюктуации с разным периодом в культуре ткани, колебания нейрогуморального контроля над состоянием органа-мишени.
Причину ритмических изменений фармакологической чувствительности нужно, прежде всего, искать в спонтанных осцилляциях внутриклеточного содержания макроэргических соединений, цАМФ, темпов синтеза белка (Арушанян Э.Б., 1988). Эти осцилляции совершаются с различной частотой от миллисекунд до недель и месяцев. Они, вероятно, в свою очередь, определяются как циркадианные, так и месячные, сезонные особенности хронестезии.
По мнению Э.Б. Арушаняна (2000), в роли внешних пейсмейкеров по отношению к первичным клеточным осцилляторам, выступают нейрогуморальные влияния.
В свою очередь, нервные и гуморальные механизмы выступают в качестве посредников, обеспечивающих перенос информации из внешней среды к первичным осцилляторам при участии центральных аппаратов управления биоритмами (Комаров Ф.И. и соавт, 2000).
Среди внешних синхронизаторов, которые особенно важны для формирования хронестезии, надо указать на характер и периодичность питания, фотопериодизм, влияние геомагнитных и климатических факторов.
Наряду с хронестезией, вторым слагаемым хронергии служит хронокинетика (Арушанян Э.Б., 2000). Хотя по многим аспектам хронокинетики в литературе все еще отсутствует фактическое обоснование, тем не менее, их зависимость от циркадианных, месячных, сезонных биоритмов не трудно предугадать. Изначально временную динамику, причем значительно модифицирующую фармакологический ответ, должны обнаруживать все без исключения фармакологические параметры (Зидермане А.А., 1988).
С разным периодом будут неизбежно колебаться процессы усвоения, резорбции и транспорта лекарств у человека и животных, учитывая, например, околосуточные или сезонные особенности работы желудочно-кишечного тракта. Неодинаковой должна быть и динамика распределения, биотрансформации, выделения фармакологических средств из организма, если помнить о временных колебаниях функции сердечно-сосудистой системы, активности микросомального аппарата печени, мочевыделительной системы. Однако не стоит забывать, что временной рисунок указанных явлений может быть весьма индивидуален в зависимости от многих, в том числе генотипичеких особенностей субъекта (Романов Ю.А., 1989; Арушанян Э.Б., 2000; Комаров. Ф.И. и соавт., 2000).
Таким образом, проблема биологического времени стала интердисциплинарной проблемой, которая решается в исследованиях биологов, физиологов, патофизиологов, фармакологов, философов, математиков и других ученых, а хронофармакология в настоящее время оформилась как самостоятельное научное междисциплинарное направление, которое является основой для дальнейшей оптимизации лечебных и профилактических мероприятий в медицине и ветеринарии.






